脂质载体用作黏膜疫苗佐剂-传递系统
2019-06-11陈敏囡邱昌露
陈敏囡,邱昌露,王 汀*,王 宁
脂质载体用作黏膜疫苗佐剂-传递系统
陈敏囡1,邱昌露1,王 汀1*,王 宁2*
(1. 安徽医科大学 药学院,安徽 合肥 230032;2. 合肥工业大学 食品与生物工程学院,安徽 合肥 230003)
综述近年来纳米脂质载体用于黏膜疫苗佐剂-传递系统的研究进展情况。通过“Pubmed”和“中国知网”搜索“脂质纳米载体”“疫苗”“黏膜免疫”“疫苗佐剂”和“传递系统”等一系列关键词,查阅了近十年来有关黏膜疫苗发展的学术论文。通过检索获得了许多有关黏膜疫苗佐剂-传递系统(VADSs)的文献,并引用了大量相关重要成果,综述了脂质体、免疫刺激复合物、病毒体、微泡和乳剂不同脂质载体的黏膜疫苗佐剂-传递系统研究进展。作者重点论述了载体的主要功能,如靶向黏膜传递抗原、保护抗原免于降解、促进抗原的提呈、增强抗原特异性免疫应答以及他们在黏膜疫苗接种中的优缺点。尽管基于纳米脂质载体的黏膜疫苗佐剂-传递系统已取得了巨大的发展并在免疫病原体方面具有很大的潜力,但仍存在一些挑战有待克服。
药剂学;黏膜疫苗佐剂-传递系统;综述;脂质粒子;感染
疫苗接种大大降低了全球传染病的发病率和死亡率,对治疗、预防疾病发挥着重要作用,是最成功的医疗手段之一。目前大多数获得许可的疫苗主要通过皮下或肌肉注射接种,通常仅能诱导体液免疫应答,难以引发细胞免疫和黏膜免疫应答。相比之下,黏膜疫苗产生的免疫应答具有多样性,不仅能有效诱导黏膜抗体(IgA),还能诱导细胞免疫应答,并产生全身免疫[1],为机体抵抗病原体入侵提供了完全保护。现在,研究人员只成功开发出少数几种适用于黏膜接种的亚单位疫苗,主要是因为缺乏安全、且能够防止抗原降解的疫苗佐剂-传递系统。然而,近来开发出的脂质纳米粒子具有独特的性质,可用作黏膜疫苗佐剂-传递系统,因而备受研究者的青睐。
1 黏膜免疫系统
免疫系统包括两个重要组成部分:黏膜免疫系统和全身免疫系统。黏膜免疫系统由诱导位点和效应位点组成。诱导位点负责抗原的摄取和诱导初始T细胞和B细胞免疫反应,然后再迁移至其他黏膜效应部位,诱导产生分泌型免疫球蛋白A(IgA),形成黏膜免疫应答[2]。
大部分细菌、病毒通过黏膜感染人体,因为黏膜表面持续暴露于各种环境(如食物、空气或体腔)病原性微生物中。因此,黏膜免疫保护是抵御病原体感染的第一道防线[3]。成人的黏膜表面积大约有400 m2,并且几乎80%的人体免疫细胞存在于黏膜部位。大部分黏膜表面含有特异性黏膜相关淋巴组织(mucosa- associated lymphoid tissue, MALT),包括胃肠相关淋巴组织、支气管和鼻腔相关淋巴组织以及结膜和泌尿生殖相关淋巴组织,因此黏膜表面是抗原摄取和诱导黏膜免疫应答不可缺少的场所[4]。例如,通常肠道抗原由M细胞的内吞作用转运至黏膜表面上皮组织下方的MALT,经专职抗原呈递细胞(Antigen-presenting cells,APC)(如树突状细胞[DC])递呈给T细胞和B细胞,产生抗原特异性T淋巴母细胞,然后在淋巴结等生发中心增殖后,再经血液迁移到黏膜和腺体组织,进一步分化为浆细胞并分泌IgA[5]。
2 黏膜疫苗接种的佐剂-传递系统
为了保护疫苗并使其能有效诱导保护性免疫应答,黏膜疫苗,尤其是亚单位疫苗,必须选择合适的传递系统。当经黏膜途径接种疫苗时,选择的佐剂-传递系统应能够保护疫苗抗原避免被蛋白水解酶和黏膜表面特殊环境等的化学降解。脂质疫苗佐剂-传递系统能运载保护抗原并发挥佐剂功能,靶向传递抗原减少用量,从而降低有关毒性,因此佐剂-传递系统的研究具有重要的意义。以下对几种常见的疫苗脂质佐剂-传递系统进行介绍。
2.1 脂质体
脂质体是由磷脂分散于水溶液中自排形成的具有双分子层结构的球形囊泡,直径为数十纳米至数微米,内部包裹着水核[6]。根据化学性质的不同,水溶性化合物(如蛋白质、半抗原等)可以被包裹在水核中,而亲脂性化合物(如抗原、佐剂等)则能够被嵌入脂质双分子层。脂质体主要由具有良好生物相容的磷脂和胆固醇组成,具有一定的结构稳定性,用作疫苗佐剂-传递系统,能够提高免疫原性。通过选择适当的材料组成和制备工艺,如脂质的组成、电荷、大小、包裹模式等,脂质体能够形成疫苗的多功能传递系统[7]。例如,经过特定的pH敏感脂质修饰,能实现控制释放;采用合成的阳离子脂质修饰,可进一步提高疫苗制剂的免疫原性[6]。
研究人员采用二油酰基三甲氨基丙烷(DOTAP),二甲基二十八烷基溴化铵(DDA),二甲基氨基乙烷-氨基甲酰基-胆固醇等材料制备阳离子脂质体用作疫苗佐剂-传递系统。与非阳离子脂质囊泡相比,基于DDA的脂质体疫苗经鼻腔接种能更好地诱导免疫系统产生局部黏膜和阴道IgA。此外,PEG化脂质体用作疫苗佐剂-传递系统,能进一步增强免疫应答的诱导功能[8]。同样,鼻腔接种由DOTAP和氨基甲酰基-胆固醇制备的阳离子脂质体疫苗,能够被鼻黏膜相关淋巴组织中DC有效摄取,并在鼻黏膜组织中诱导产生抗原特异性IgA和T细胞[9]。CAF01是一种基于阳离子脂质体的、适合于黏膜接种的疫苗佐剂-传递系统。研究表明,经鼻接种基于CAF01的、用于预防流感或化脓性链球菌的疫苗制剂,能有效诱导产生黏膜效应T细胞和IgA免疫反应,并有效保护接种疫苗的模型动物。另外,接种CAF01疫苗的小鼠脾脏产生抗原特异性IFN-应答水平比采用非佐剂制剂接种的小鼠高4倍,结果证明CAF01能显著增强疫苗特异性血清IgG的水平[10]。由此可见,脂质的类型和佐剂的存在对疫苗诱导免疫应答具有重要影响。
大多数脂质体疫苗制剂具有良好的耐受性,仅诱导一些炎症反应,如刺激性、打喷嚏等。然而,脂质体的稳定性在一定程度上制约了其作为疫苗载体的应用,特别是在胃肠道中,受胃肠道酶类的影响脂质体及其运载的疫苗容易发生降解。而采用特定的脂质组成能改善脂质体制剂的稳定性。例如,在脂质体中加入甘露糖、壳聚糖和PEG,脂质体稳定性显著提高,同时能更好的靶向传递疫苗到APC,提高接种疫苗的免疫原性;也有报道通过逐层沉积聚电解质的方法来稳定脂质体,同时又增加了抗原特异性IgA和IgG抗体水平及T细胞免疫应答[11]。
2.2 免疫刺激复合物(ISCOMs)
ISCOMs(immune stimulating complexes)是一种带负电荷的球形笼状纳米粒子,由磷脂、胆固醇和Quil A(从植物皂树Quillaja saponaria树皮中提取的皂苷)组成,将抗原与之混合可自发形成ISCOMs。疏水性抗原可直接嵌入或锚定到脂质的胶体结构,而亲水性抗原则需要一定的修饰才能有效载入ISCOMs[12]。
ISCOMs最初用于注射接种,后逐渐被研究用于黏膜接种(如鼻内和口腔等)。基于ISCOMs的疫苗能诱发抗原特异性黏膜IgA应答,产生血清IgG抗体以及细胞毒性T细胞(CTL)[13]。研究显示,含有流感病毒、呼吸道合胞体病毒、乙型肝炎病毒和麻疹抗原实体的ISCOMs疫苗经鼻/肺接种后,有效诱导了机体的免疫应答,在鼻腔和肺部产生了较高滴度的IgA。流感ISCOMs亚单位疫苗经鼻腔接种后也能引起强烈的黏膜IgG和IgA免疫反应[14]。在某些情况下,这种局部黏膜接种产生的免疫比注射接种更加有效。采用皂苷巴西藜(Quilaja brasiliensis)替代Quil A制备的ISCOMs,也可以包裹卵白蛋白(OVA)抗原,发挥疫苗佐剂-传递系统的作用,经鼻腔接种后,诱导产生局部黏膜和远端IgA[15]。此外,在ISCOMs中加入DNA质粒,能在鼻部接种疫苗的动物鼻咽中引发产生抗流感嗜血杆菌的细胞及抗体反应[16]。目前,人们也正在研究基于ISCOMs口服接种的疫苗,现有结果显示只能诱导产生有限的肠道IgA反应。不同于其它载体,尽管ISCOMs由于皂苷的佐剂性质而具有强大的佐剂功能,但在ISCOMs结构中加入佐剂CTA1-DD也可以在鼻腔接种后诱导强大的黏膜IgA应答,T细胞增殖以及全身免疫应答[17]。
ISCOMs作为适于鼻腔接种的黏膜疫苗佐剂-传递系统,也仍然存在一些局限性。亲水性抗原必须进行修饰提高亲脂性才能进行有效运载,而某些皂苷在高剂量使用时存在较强的毒性等。这些都在某种程度上限制了ISCOMs在疫苗制剂中的开发应用。除鼻黏膜途径外,舌下途径仍有待进一步探索。
2.3 病毒体
病毒体是一类特殊的脂质体,由天然或合成的磷脂和病毒蛋白结合而成。与原生病毒抗原的结构相似,但缺乏病毒的基因组,是能经自我装配而形成的复合物[18]。最初,病毒体也被称为免疫增强重建流感病毒体(IRIVs),含有来自流感病毒的血凝素和唾液酸苷酶。IRIVs将抗原呈递给APC,后者通过MHC-Ⅰ和MHC-Ⅱ途径处理、提呈抗原,并诱导B细胞和T细胞产生免疫反应[7]。虽然添加免疫增强剂可进一步提高疫苗效力,但研究表明在不添加任何佐剂的情况下,病毒体仍具有很强的免疫原性。同时,病毒体有着与普通脂质体相似的应用多样性及其他优点。但是,从流感病毒中提取所有必需成分的过程相对复杂,对于病毒体广泛用作疫苗佐剂-传递系统造成较大困难。
病毒体的研究,主要集中在肠胃外疫苗接种,但也有探索病毒体用于黏膜接种的相关报道。经鼻途径接种基于IRIVs对抗呼吸道病原体的DNA疫苗,能有效诱导动物产生黏膜和全身免疫应答。例如,在小鼠模型中,用作佐剂的病毒体经鼻或舌下接种,促进了黏膜和全身性抗体免疫应答,以及Th1型细胞免疫应答,从而有效地预防了流感和呼吸道合胞体病毒的感染[19]。除此之外,病毒体作为疫苗佐剂-传递系统,还被用于接种艾滋病病毒感染的猿类模型,采用肌内注射初免-鼻腔接种加强的免疫接种方法,全面地保护了猿猴免于阴道HIV的攻击。这是由于黏膜IgA和IgG阻断了病毒胞吞作用,以及产生了中和抗体依赖性细胞毒性作用[20],这为HIV疫苗的研究发展提供了一条新途径。
2.4 微泡
微泡首先报道是由单层二硬脂酰磷脂酰胆碱和棕榈酸组成的脂质微粒。微泡分子层可以包裹惰性气体,形成充气微泡,常用作血流成像的超声造影剂[21]。基于脂质的微泡用作疫苗佐剂-传递系统,可被APC摄取,并在细胞内传递抗原产生有效的负荷剂量[22]。外壳中掺入阳离子脂质能制备特定的微泡载体,可以更好地结合抗原及DNA等荷负电成分。通过在微泡表面连接细胞特异性配体或抗体,使其靶向到特定组织,提高了成像和药物传递的特异性[23],这对发展黏膜靶向疫苗,提供了一种策略。此外,微泡还可以与佐剂结合,进一步增强了疫苗的免疫原性。例如,鼻内接种运载-半乳糖神经酰胺佐剂的微泡,在黏膜表面提呈沙门氏菌衍生的SseB 抗原,能够诱导肠道Th1-/ Th17-型T细胞反应,并产生相关的IgA、IgM和IgG体液免疫应答。这使得接种疫苗的小鼠口服伤寒沙门氏菌后,局部和全身细菌显著降低,其预防效果比采用肠胃外注射接种相同的微泡疫苗制剂更有效[24]。尽管目前口服接种微泡疫苗制剂诱导局部免疫应答的效果并不明显,但通过优化制备能够增强免疫原性。近年来,已经开发出了纳米气泡,在全身接种后稳定性和外渗性均增加,更适合用于疫苗佐剂-传递系统[25]。
2.5 纳米乳
纳米乳是纳米液滴(20~500 nm)的各向同性分散体,由油相、水相、表面活性剂和辅助表面活性剂组成。因为其粒径大小与抗原相似,纳米乳很容易的被黏膜表面的M细胞摄取,然后递呈抗原至APC,诱导产生免疫应答。由于具有先天免疫佐剂的特性(如含有角鲨烯油的纳米液滴),纳米乳可以被DC/巨噬细胞处理,激活免疫通路,从而增强疫苗的免疫原性[26],提高抗原的传递效率。例如,一种基于大豆油和氯化十六烷基吡啶(W805EC)的纳米乳,已经被证实可以通过迁移活化的DC,将抗原有效负荷传递到纤毛化的鼻上皮细胞和NALT中的区域淋巴结中,通过TLR-2和TLR-4激活NK-B通路,诱导强大的抗体和Th1 / Th17型细胞免疫反应[27]。同时当与灭活的流感疫苗联合应用时,会产生针对流感的保护性免疫[28]。纳米乳虽然具有容易制备的优势,但在接种时对于提高抗原稳定性的保护作用比较有限。目前,通过双乳化技术形成W/O/W复乳,能够改善疫苗的保护作用,实现鼻腔和口服接种,诱导产生强大的全身IgG和黏膜IgA免疫应答[29]。另外,通过偶联技术,如脂肽与聚赖氨酸核的偶联,采用纳米乳能够制备5~15 nm纳米粒,鼻腔接种后有效促进了产生全身和黏膜以及细胞免疫应答,形成针对化脓性链球菌感染的保护[30]。关于黏膜疫苗佐剂-传递系统的脂质载体结构见图1,脂质载体作为黏膜疫苗佐剂-传递系统的评估结果见表1。
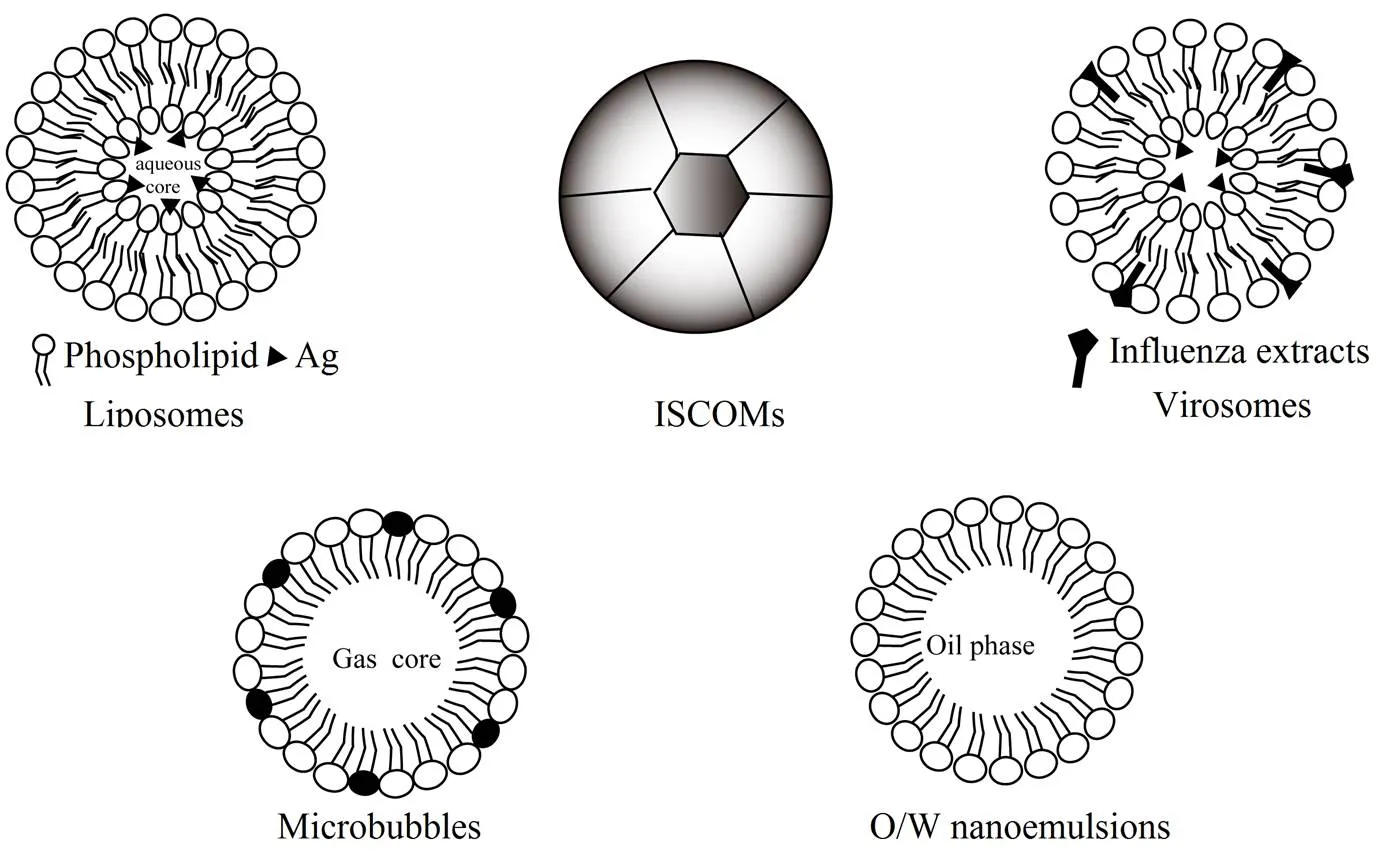
Fig. 1 Schematic diagram of lipid carrier structures for mucosal vaccine adjuvant-delivery system
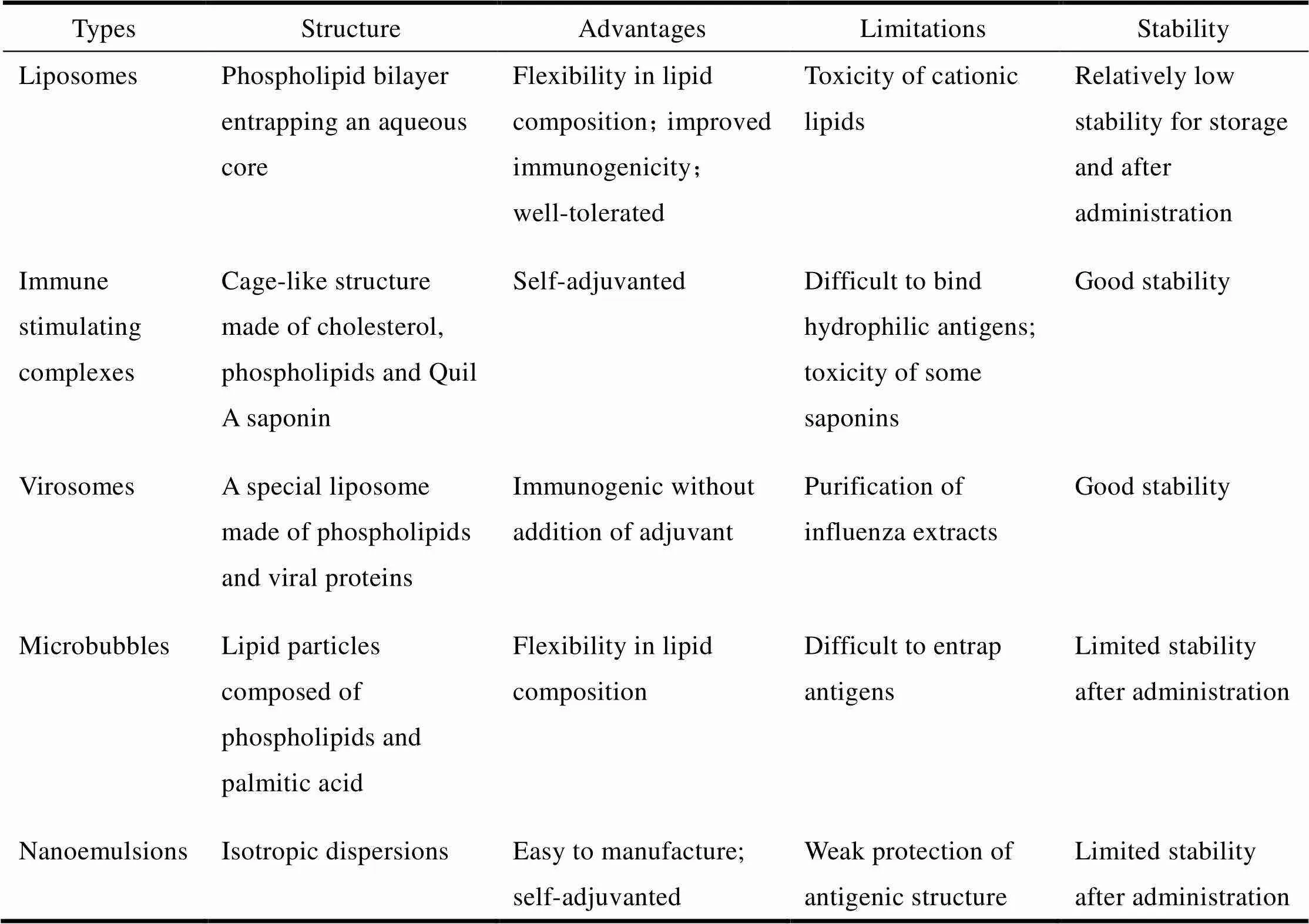
Table1 Evaluation of lipid-based carriers as mucosal vaccine adjuvant-delivery system
3 展望
疫苗接种已控制了相当一部分疾病,但人类仍然面临着遭受感染甚至是死亡的威胁。目前,注射疫苗仍然发挥着重要作用,却难以诱导黏膜免疫应答。针对经胃肠道、呼吸道等各种黏膜途径传播的病原体,黏膜疫苗的开发刻不容缓。除了了解黏膜免疫机制外,选择合理的黏膜疫苗佐剂-传递系统、佐剂和抗原等,对于成功开发黏膜疫苗具有重要意义。
脂质微粒黏膜疫苗佐剂-传递系统可以使黏膜疫苗获得多功能性,满足高效、安全、低剂量抗原的制剂要求。脂质载体在黏膜接种时能传递多种抗原实体,并被用于制备具有独特性能的疫苗制剂,以有效解决、控制病原体和黏膜接种疫苗所涉及的机制相关问题。但是,脂质微粒疫苗佐剂-传递系统在稳定性、促进相关抗原的摄取、制备等方面仍面临一些挑战。因此,还需要做出进一步努力,根据免疫学和疫苗相关的现有知识,逐项克服发展障碍。结合具体疾病、抗原类型和接种途径,发展黏膜疫苗制剂,以产生有效的保护性和治疗性免疫反应。随着黏膜免疫研究的进一步深入,黏膜疫苗佐剂-传送系统将有更广阔的发展前景。
[1]VELA RAMIREZ J E, SHARPE L A, PEPPAS N A.Current state and challenges in developing oral vaccines[J].Adv Drug Deliv Rev,2017,114:116-131.
[2] TAMURA S I, AND KURATA T. Defense mechanisms against influenza virus infection in the respiratory tract mucosa[J]. Jpn J Infect Dis,2004,57(6):236-247
[3] WANG N, ZHEN Y, JIN Y, et al. Combining different types of multifunctional liposomes loaded with ammonium bicarbonate to fabricate microneedle arrays as a vaginal mucosal vaccine adjuvant-dual delivery system (VADDS) [J]. J Controlled Release, 2017, 246: 12–29.
[4]LI W, DENG G, LI M, et al.Roles of Mucosal immunity against Mycobacterium tuberculosis infection[J].Tuberc Res Treat,2012: 1-12.doi:10.1155/2012/791728.
[5]王伟,王健, 王浩.疫苗黏膜输送系统的研究进展[J].中国医药工业杂志,2011,42(10):787-792, 797.
[6]BERNASCONI V, NORLING K, BALLY M, et al.Mucosal vaccine development based on liposome technology[J].J Immunol Res,2016: 1-16. doi:10.1155/2016/5482087.
[7] ZHEN Y, WANG N, GAO Z, et al. Multifunctional liposomes constituting microneedles induced robust systemic and mucosal immunoresponses against the loaded antigens via oral mucosal vaccination[J]. Vaccine, 2015, 33(35): 4330–4340.
[8]YUSUF H, ALI A A, ORR N, et al.Novel freeze-dried DDA and TPGS liposomes are suitable for nasal delivery of vaccine[J].Int J Pharm,2017,533(1):179-186.
[9]TADA R, HIDAKA A, IWASE N, et al.Intranasal immunization with DOTAP cationic liposomes combined with DC-cholesterol induces potent antigen-specific mucosal and systemic immune responses in mice[J].PLoS One,2015,10(10):e0139785.
[10]CHRISTENSEN D, FOGED C, ROSENKRANDS I, et al.CAF01 liposomes as a mucosal vaccine adjuvant:andinvestigations[J].Int J Pharm,2010,390(1):19-24.
[11]WANG N, WANG T, ZHANG M, et al. Mannose derivative and lipid a dually decorated cationic liposomes as an effective cold chain free oral mucosal vaccine adjuvant-delivery system[J]. Eur J of Pharm Biopharm, 2014, 88(1): 194–206.
[12]BAZ MORELLI A, BECHER D, KOERNIG S, et al.ISCOMATRIX: a novel adjuvant for use in prophylactic and therapeutic vaccines against infectious diseases[J]. J Med Microbiol,2012,61(Pt7):935-943.
[13]COULTER A,HARRIS R,DAVIS R, et al.Intranasal vaccination with ISCOMATRIX adjuvanted influenza vaccine[J].Vaccine,2003,21(9/10):946-949.
[14]RIMMELZWAAN GF, BAARS M, VAN AMERONGEN G, et al. A single dose of an ISCOM influenza vaccine induces long-lasting protective immunity against homologous challenge infection but fails to protect Cynomolgus macaques against distant drift variants of influenza A (H3N2) viruses[J].Vaccine,2002,20(1/2):158–163.
[15]CIBULSKI S P, MOURGLIA-ETTLIN G, TEIXEIRA T F, et al.Novel ISCOMs from Quillaja brasiliensis saponins induce mucosal and systemic antibody production, T-cell responses and improved antigen uptake[J].Vaccine,2016,34(9):1162-1171.
[16]KODAMA S, HIRANO T, NODA K, et al.Nasal immunization with plasmid DNA encoding P6 protein and immunostimulatory complexes elicits nontypeable Haemophilus influenzae-specific long-term mucosal immune responses in the nasopharynx[J].Vaccine,2011,29(10):1881-1890.
[17]HELGEBY A, ROBSON N C, DONACHIE A M, et al.The Combined CTA1-DD/ISCOM Adjuvant vector promotes priming of mucosal and systemic immunity to incorporated antigens by specific targeting of B cells[J]. J Immunol,2006,176(6):3697-3706.
[18]ALEKSANDRAL, LE THUY T T, DRANE DEBBIE, et al.ISCOM® based vaccines for cancer immunotherapy[J].Vaccine,2004,22(8):963-974.
[19]SHAFIQUE M, MEIJERHOF T, WILSCHUT J, et al.Evaluation of an intranasal virosomal vaccine against respiratory syncytial virus in mice: effect of TLR2 and NOD2 ligands on induction of systemic and mucosal immune responses[J].PLoS One,2013,8(4):e61287.
[20]BOMSEL M, TUDOR D, DRILLET A S, et al.Immunization with HIV-1 gp41 subunit virosomes induces mucosal antibodies protecting nonhuman primates against vaginal SHIV challenges[J].Immunity,2011,34(2):269-280
[21]CORTHESY B, BIOLEY G.Gas-filled microbubbles: Novel mucosal antigen-delivery system for induction of anti-pathogen's immune responses in the gut[J].Gut Microbes,2017,8(5):511-519.
[22]SENNOGA C A, KANBAR E, AUBOIRE L, et al.Microbubble-mediated ultrasound drug-delivery and therapeutic monitoring[J].Expert Opin Drug Deliv,2017,14(9):1031-1043.
[23]WU W, WANG Y, SHEN S, et al.ultrasound molecular imaging of inflammatory thrombosis in arteries with cyclic Arg-Gly-Asp-modified microbubbles targeted to glycoprotein IIb/IIIa[J]. Invest Radiol,2013,48(11):803-812.
[24]PIGNY F, LASSUS A, TERRETTAZ J, et al.Intranasal vaccination with Salmonella-derived SseB associated to gas-filled microbubbles partially protects against gut infection in mice[J]. J Infect Dis, 2016,214(3):46-438.
[25]CAVALLI R, SOSTERM, ARGENZIANO M.Nanobubbles: a promising effcient tool for therapeutic delivery[J].Ther Deliv,2016,7(2):117–138.
[26]KAMMONA O, BOURGANIS V, KARAMANIDOU T, et al.Recent developments in nanocarrier-aided mucosal vaccination[J].Nanomedicine,2017,12(9):1057-1074.
[27]BIELINSKA A U, MAKIDON P E, JANCZAK K W, et al.Distinct pathways of humoral and cellular immunity induced with the mucosal administration of a nanoemulsion adjuvant[J].J Immunol,2014,192(6):2722-2733.
[28]AHMED M, SMITH D M, HAMOUDA T, et al.A novel nanoemulsion vaccine induces mucosal Interleukin-17 responses and confers protection upon Mycobacterium tuberculosis challenge in mice[J].Vaccine,2017,35(37):4983-4989.
[29]SHAHIWALA A, AMIJI M M.Enhanced mucosal and systemic immune response with squalane oil-containing multiple emulsions upon intranasal and oral administration in mice[J].J Drug Target,2008,16(4):302-310.
[30] SCHULZE K, EBENSEN T, CHANDRUDU S, et al. Bivalent mucosal peptide vaccines administered using the LCP carrier system stimulate protective immune responses against Streptococcus pyogenes infection[J]. Nanomedicine, 2017, 13(8): 2463-2474.
Using lipid-based carriers as mucosal vaccine adjuvant-delivery systems
CHEN Minnan1, QIU Changlu1, WANG Ting1*, WANG Ning2*
( 1.,,230032,; 2.,,230003,)
This review paper describes recent advances in the use of lipid nanocarriers for mucosal vaccine adjuvant-delivery systems.Pubmed and CNKI websites were exploited for searching a cascade of key words including lipid nanoparticles, vaccine, mucosal immunization, vaccine adjuvant and delivery system to collect the references published in the past 10 years in professional journals involving the developing of mucosal vaccines.Numerous publications fitting the keywords on mucosal vaccine adjuvant-delivery systems (VADSs) were gained, and most of these key references representing important achievements were cited to summarize the development of these different lipid carriers, such as liposomes, immune stimulating complexes,somes, microbubbles and emulsions, which are crucial mucosal VADSs. This paper discussed the carriers on their key functions, such as targeting mucosa for delivery of antigens, protecting antigens from degradation, promoting antigens presentation, and enhancing antigen-specific immune responses, as well as their advantages and disadvantages for mucosal vaccinations.Although the mucosal vaccine adjuvant-delivery systems based on lipid nano-carriers have made great progress and have great potential in immune pathogens, there are still some challenges to be overcome.
pharmaceutics; mucosal vaccine adjuvant-delivery systems; review; lipid particles; infection
2019-02-12
陈敏囡(1996-), 女(汉族), 江苏张家港人, 硕士研究生, E-mailchen2269406534@163.com;
王汀(1972-), 男(汉族), 安徽泗县人, 教授, 博士, 硕士生导师, 主要从事新型药物传递系统及疫苗佐剂-传递系统研究, Tel. 0551-65161115, E-mailtwangcn@163.com。
(2019)03–0069–08
10.14146/j.cnki.cjp.2019.03.005
R94
A
(本篇责任编辑:赵桂芝)
