单剂量口服芍药苷微乳在大鼠体内的药动学研究
2019-06-11韩嘉艺陈立江朱书樊
韩嘉艺,高 飞,陈立江,朱书樊,李 杭,刘 洋
单剂量口服芍药苷微乳在大鼠体内的药动学研究
韩嘉艺,高 飞,陈立江,朱书樊,李 杭,刘 洋*
(辽宁大学 药学院,辽宁 沈阳 110036)
研究大鼠口服芍药苷微乳后芍药苷在大鼠体内的药动学特征,评价芍药苷微乳的相对生物利用度。将12只SD大鼠随机分成芍药苷微乳实验组和芍药苷混悬液对照组,运用高效液相色谱法测定不同时间点血浆中芍药苷的质量浓度,计算药动学参数和相对生物利用度。经口服给予芍药苷微乳和混悬液后,其1/2分别为(3.71±1.08)h和(2.36±0.17)h,max分别为(11.20±0.89)mg·L-1和(7.61±0.48)mg·L-1,AUC0-∞分别为(40.56±4.33)mg·h·L-1和(22.78±1.25)mg·h·L-1,统计分析结果表明,芍药苷微乳与芍药苷混悬液的1/2、max、AUC0-∞、CL、MRT之间均有显著性差异。与芍药苷混悬液对比,芍药苷微乳能够显著提高芍药苷在大鼠体内的生物利用度。
药剂学;药代动力学;高效液相色谱法;芍药苷;微乳;生物利用度
赤芍为毛茛科植物芍药Pall.或川赤芍Lynch的干燥根[1]。赤芍总苷(total glycosides in,TGP)为赤芍的有效部位,具有抗凝抗血栓[2]、改善微循环[3]、抗心肌缺血[4]、保护心脏和肝脏[5]、抗肿瘤[6]等广泛的药理活性。目前芍药苷作为赤芍总苷的主要成分,体内实验证明具有降低血液黏度、抗血小板聚集、扩张血管、改善微循环[7]等心脑血管方面的作用,并且毒性及不良反应较小,但是其口服生物利用度低[8],影响了其临床应用。文献报道,单独给大鼠灌胃芍药苷,其生物利用度仅仅为3%[9]。微乳作为一种新型的药物载体,其粒径一般小于100 nm,具有提高药物的溶解度、促进药物吸收的特性,能够显著提高药物的生物利用度[10],并且制备工艺简单。作者以芍药苷混悬液为对照组,研究了芍药苷微乳在大鼠体内的药动学,并进行了生物利用度的比较,从而为芍药苷微乳口服制剂的开发提供依据。
1 仪器与材料
6000 CoMetro高效液相色谱仪(6000PVW UV/VIS检测器,6000LDI泵,美国康诺公司),XK96-A快速混匀器(姜堰市新康医疗器械有限公司),TDL80-2B台式离心机(上海安亭科学仪器厂),KQ-5200DB数控超声波清洗器(昆山超声仪器有限公司),AL204梅特勒电子天平(梅特勒-托利多仪器有限公司)。
芍药苷(实验室自制,芍药苷质量分数含量≥95%),芍药苷微乳及芍药苷混悬液(实验室自制,空白微乳由Labrafil M1944/Cremophor EL 35/ Transcutol HP和水按适当比例组成,均含芍药苷50 g·L-1),香兰素(国药集团化学试剂有限公司,纯度质量分数≥99.5%),肝素钠注射液(江苏万邦生化医药股份有限公司),乙腈、甲醇(色谱纯,山东禹王实业有限公司化工分公司),乙酸乙酯(天津富宇精细化工有限公司),娃哈哈纯净水(杭州娃哈哈集团有限公司)。
健康SD大鼠(雄性),体质量180~220 g,由沈阳市沈河区龙元经济动物养殖场提供,动物合格证号SCXK(辽)2010-0001。
2 方法与结果
2.1 溶液的配制
2.1.1 芍药苷标准溶液的配制
精密称取10.0 mg芍药苷,加甲醇溶解,定容至50 mL量瓶中,摇匀,得到质量浓度为0.2 g·L-1的芍药苷储备液,置于4 ℃冰箱保存,备用。
2.1.2 内标溶液的配制
精密称取内标香兰素10.0 mg,加甲醇溶解,定容至50 mL量瓶中,摇匀,得到质量浓度为 0.2 g·L-1的香兰素储备液,再将其稀释至5 mg·L-1,置于4 ℃冰箱保存,备用。
2.2 HPLC色谱条件
色谱柱:Diamonsil C18柱(250 mm×4.6 mm, 5 μm);柱温:30 ℃;流动相:乙腈-水(体积比20∶80,磷酸调pH值为3.05);检测波长:230 nm;流速:1.0 mL·min-1;进样量:20 μL。
2.3 血浆样品采集
取12只健康SD大鼠,随机分为2组,每组6只,实验前禁食12 h,自由饮水,再分别灌胃给予芍药苷口服微乳(500 mg·kg-1)与芍药苷混悬液(500 mg·kg-1)。实验动物称重后,按照计算药量给药,两组灌胃给药前0 min和给药后5、10、20、30、45 min及1、1.5、2、3、4、6、8、12 h于大鼠眼眶静脉取血0.5 mL,采样过程中给大鼠适当补充水分。全血置于肝素化的离心管中,4 000 r∙min-1离心15 min,分离血浆,-20 ℃冷冻保存,备用。
2.4 血浆样品处理
精密取血浆100 μL置于5 mL玻璃离心管中,加入香兰素甲醇溶液20 μL,加入1.2 mL乙酸乙酯萃取,涡旋混匀2 min,4 000 r·min-1离心10 min后,吸取上层乙酸乙酯1 mL置于离心管中,室温下空气吹干,残渣用甲醇30 μL复溶,离心后进样20 μL上清液分析。
2.5 统计分析及数据处理
使用DAS 2.0药动学软件计算芍药苷微乳及混悬液的药动学参数,并计算相对生物利用度,所得参数采用SPSS PASW Statistics v18软件进行统计分析。
2.6 专属性考察
取空白大鼠血浆、含有芍药苷和内标香兰素的血浆以及大鼠给药后的血浆样品,按“2.4”条方法处理血浆样品,按“2.2”条色谱条件进行HPLC测定。由图1可见,在“2.2”条色谱条件下,大鼠血浆的内源性物质不干扰血浆中样品的测定,内标香兰素的保留时间为12.9 min,芍药苷的保留时间为7.9 min。
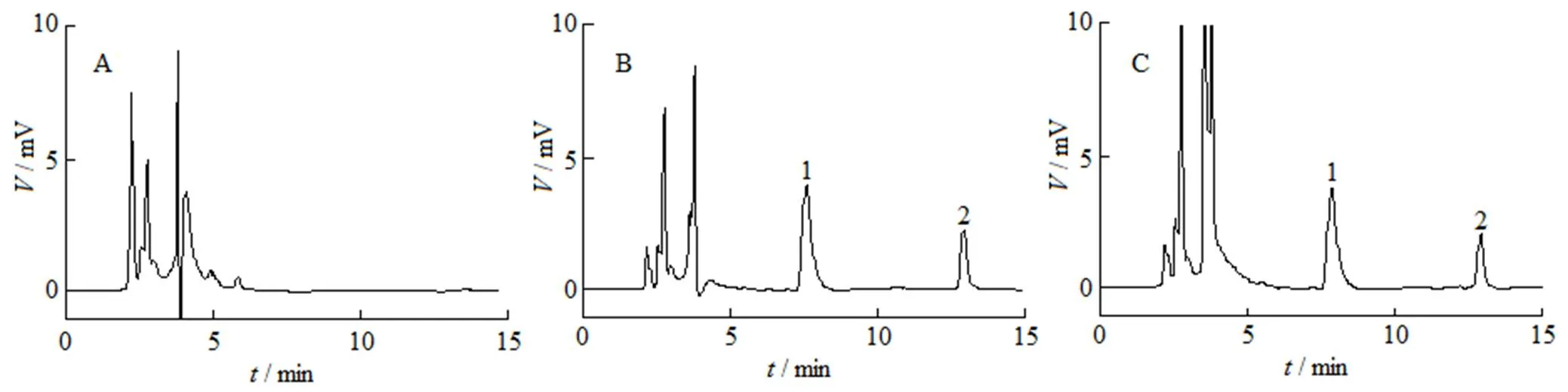
A—Blank plasma; B—Plasma with paeoniflorin and vanillin; C—Plasma after oral administration of paeoniflorin microemulsions
2.7 标准曲线的制备
取空白血浆100 μL共8份,再分别加入不同质量浓度的芍药苷标准溶液,使血浆质量浓度分别为0.1、0.2、0.4、0.8、1.6、3.2、6.4和12.8 mg·L-1,按“2.4”条方法处理血浆样品,以样品峰面积与内标峰面积的比值对血药质量浓度(,mg·L-1)进行回归计算,回归方程为=0.711 96+ 8.108×10-2(=0.999 5),结果显示大鼠血浆中芍药苷质量浓度在0.1~12.8 mg·L-1内线性关系良好。
2.8 精密度试验
配制质量浓度分别为0.2、1.6和12.8 mg·L-1低、中、高3种芍药苷标准血浆样品,按“2.4”条方法操作,每个质量浓度各平行配制5份,一天内重复检测5次,每个质量浓度连续检测5 d,依法测定日内、日间精密度。结果低、中、高3种质量浓度的芍药苷血浆样品的日内精密度RSD分别为7.93%、4.05%和2.31%,日间精密度RSD分别为8.13%、7.26%和2.82%。低、中、高3种浓度的芍药苷血浆样品的日内、日间精密度RSD均小于10%,表明该分析方法的精密度符合生物样品分析要求,可用于大鼠血浆样品中芍药苷的含量测定。
2.9 回收率试验
配制质量浓度分别为0.2、1.6、12.8 mg·L-1低、中、高3种芍药苷标准血浆样品,按“2.4”条血浆样品处理方法操作,每个质量浓度样品重复5次,由标准曲线计算质量浓度,该质量浓度与加入的质量浓度之比即为相对回收率,计算结果见表1;配制质量浓度分别为0.2、1.6、12.8 mg·L-1低、中、高3种芍药苷标准溶液直接进样,每个质量浓度样品重复5次,记录峰面积,血浆样品处理后测得的峰面积与直接进样测得的峰面积之比即为绝对回收率,计算结果见表1。
Table 1 Recovery of the HPLC for paeoniflorin in rat plasma (±s, n=5)
由表1可知,低、中、高3种质量浓度的芍药苷血浆溶液的回收率在90%~110%内,方法回收率良好,符合生物样品测定要求。
2.10 稳定性考察
配制质量浓度分别为0.2、1.6、12.8 mg·L-1低、中、高 3种芍药苷标准血浆样品,考察3种条件下含药血浆样品的稳定性:第一份含药样品未经处理,经室温放置2 h后,按“2.4”条方法操作,按“2.2”条色谱条件检测,计算出相应质量浓度;第二份含药血浆样品经处理后,室温放置12 h,按“2.2”条色谱条件检测,考察样品在室温条件下的稳定性;第三份于-20 ℃保存7 d,用37 ℃水浴解冻,考察样品在冻融条件下的稳定性。每个质量浓度平行操作5次,结果见表2。
Table 2 Stability of the HPLC for paeoniflorin in rat plasma (± s, n=5)
由表2可知,稳定性试验的RSD均小于10 %,表明血浆样品在室温放置和冷冻储存等情况下稳定性良好。
2.11 药动学结果
采用DAS 2.0非房室模型法,求算药动学参数。两组大鼠分别单次灌胃500 mg·kg-1芍药苷微乳和芍药苷混悬液,平均血药浓度时间曲线见图2,药动学参数见表3。
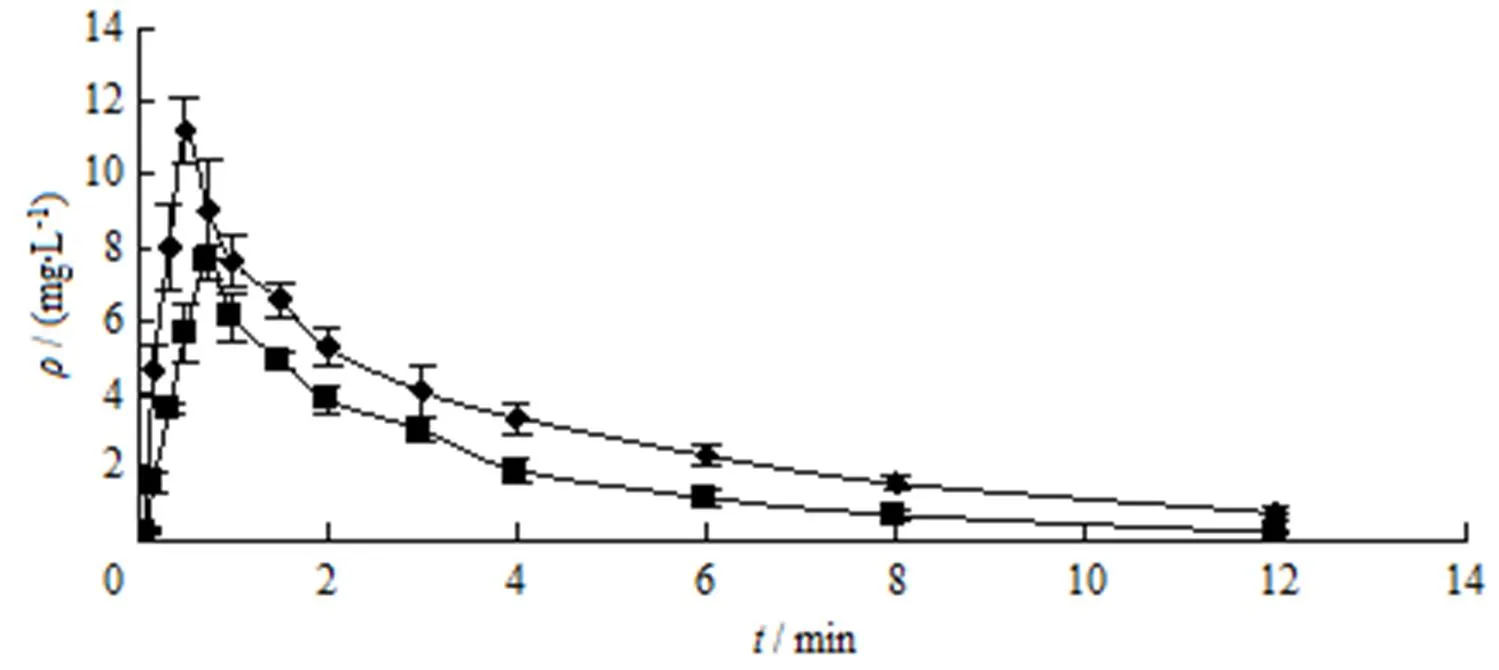
♦—Paeoniflorin microemulsions; ■—Paeoniflorin suspensions
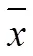
Table 3 The vivo pharmacokinetic parameters after oral administration of paeoniflorin microemulsions and paeoniflorin suspensions (± s, n=6)
Notes::*<0.05,**<0.01 vs Paeoniflorin suspensions
主要药代动力学参数表明,芍药苷口服微乳较芍药苷混悬液的max显著增加,达峰时间短,且血药浓度能够长时间保持较高水平,芍药苷口服微乳与芍药苷混悬液的相对生物利用度为178.03%,经统计分析,1/2、max、AUC0-∞、CL、MRT均有显著性差异。与芍药苷混悬液相比,芍药苷微乳的口服生物利用度有了很大的提高。
3 讨论
作者在血浆样品处理过程中考察了甲醇、乙腈及不同质量浓度的高氯酸沉淀蛋白,但结果均不理想。采用乙酸乙酯液液萃取法,操作简单快速,血浆中内源性杂质无干扰,方法准确可靠。实验中采用HPLC法进行芍药苷血药浓度的测定,内源性物质与芍药苷能得到较好分离,并且选用了合适的内标,测定结果准确,重复性好,符合生物样品分析要求。药动学结果表明,芍药苷口服微乳较芍药苷混悬液的max显著增加,芍药苷微乳能显著提高芍药苷的口服生物利用度。芍药苷口服微乳之所以能提高芍药苷的生物利用度可能是因为微乳能改善芍药苷在水性介质中的溶出,此外微乳粒径小且具有较大的表面积,同时由于其低表面张力极易于通过胃肠上皮的水化层,能够使药物直接与胃肠上皮细胞接触,增加了其对肠道上皮细胞的通透性,在肠道吸收后能经淋巴转运,避免了经肝的首过效应,也这是提高芍药苷口服生物利用度的原因[11]。
[1] 国家药典委员会. 中华人民共和国药典: 一部[M]. 北京:中国医药科技出版社, 2010: 147-148.
[2] 徐红梅, 刘青云, 戴敏, 等. 赤芍总甙抗血栓作用研究[J]. 安徽中医学院学报, 2000, 19(1): 46-47.
[3] 莫玉兰. 赤芍总苷药理作用研究概况[J]. 光明中医, 2009, 24(4): 782-784.
[4] 孙英莲, 王英军, 许荔新. 赤芍总苷对大鼠急性心肌缺血的影响[J]. 中草药, 2009, 40(12): 1961-1962.
[5] 阮金兰, 赵钟祥, 曾庆忠, 等. 赤芍化学成分和药理作用的研究进展[J]. 中国药理学通报, 2003, 19(9): 965-970.
[6] 陈志伟, 许惠玉, 严苏纯, 等. 赤芍总苷对荷瘤小鼠肿瘤细胞形态学实验研究[J]. 中华中医药学刊, 2005, 23(7): 1228-1229.
[7] 郑世存, 李晓宇, 欧阳兵, 等. 芍药苷药理作用研究新进展[J]. 中国药物警戒, 2012, 9(2): 100-103.
[8] LIU Z Q, JIANG Z H, LIU L, et alMechanisms responsible for poor oral bioavailability of paeoniflorin: Role of intesinal disposition and interactions with sinomenine[J]. Pharmaceutical Research(Dordrecht), 2006, 23(12): 2768-2780.
[9] TAKEDA S, ISONO T, WAKUI Y, et alAbsorption and excretion of paeoniflorin in rats[J]. Journal of Pharmacy & Pharmacology, 1995, 47(12A): 1036-1040.
[10] BALI V, ALI M, ALI J. Study of surfactant combinations and development of a novel nanoemulsion for minimising variations in bioavailability of ezetimibe[J]. Colloids & Surfaces B Biointerfaces, 2010, 76(2): 410-420.
[11] 刘霞, 向大雄. O/W型、W/O型葛根素口服微乳的制备及质量评价[J]. 中南药学, 2007, 5(5): 451-455.
Pharmacokinetic study of paeoniflorin microemulsions in rats after a single oral administration
HAN Jiayi, GAO Fei, CHEN Lijiang, ZHU Shufan, LI Hang, LIU Yang*
(,,110036,)
To determine the pharmacokinetic parameters of paeoniflorin microemulsions and paeoniflorin suspensions after oral administration in rats and to evaluate the relative bioavailability of paeoniflorin microemulsions.Twelve SD rats were randomly divided into control group with paeoniflorin suspensions and experimental group with paeoniflorin microemulsions. Plasma concentrations of paeoniflorin in rats were assayed using HPLC method. The pharmacokinetic parameters and relative bioavailability were calculated.The main parameters of paeoniflorin microemulsions and paeoniflorin suspensions:1/2were (3.71±1.08) h and (2.36±0.17) h, respectively;maxwere (11.20±0.89) mg·L-1and (7.61±0.48) mg·L-1respectively; AUC0-∞were (40.56±4.33) mg·h·L-1and (22.78±1.25) mg·h·L-1respectively. There were statistically significant differences in pharmacokinetic parameters of paeoniflorin including the1/2,max, AUC0-∞, CL and MRT among the oral administration of paeoniflorin microemulsions and paeoniflorin suspensions in rats.The paeoniflorin microemulsions improves the bioavailability of paeoniflorin in rats significantly compared with that of paeoniflorin suspensions.
pharmaceutics, pharmacokinetics, high performance liquid chromatography, paeoniflorin, microemulsion, bioavailability
2018-12-12
辽宁省教育厅科学研究项目(LR2017065); 沈阳市科技计划项目(Z17-5-078); 2018年辽宁大学大学生创新创业训练计划项目; 2018年第十六届辽宁省挑战杯项目
韩嘉艺(1995-), 女(汉族), 辽宁大连人,硕士研究生, E-mail 504111689@qq.com;
刘洋(1986-), 女(汉族), 辽宁沈阳人, 实验师, 硕士, 主要从事药物化学、分析测试研究, Tel. 13149852406, E-mail liu_yang14@163.com。
(2019)03–0044–06
10.14146/j.cnki.cjp.2019.03.002
R94;R969.1
A
(本篇责任编辑:赵桂芝)
