氯吡格雷硫酸盐阿司匹林复合片体外溶出度测定
2019-06-11魏忠莉何仲贵刘洪卓
魏忠莉,李 冰,何仲贵,刘洪卓
氯吡格雷硫酸盐阿司匹林复合片体外溶出度测定
魏忠莉,李 冰,何仲贵,刘洪卓*
(沈阳药科大学 无涯学院,辽宁 沈阳 110016)
建立氯吡格雷硫酸盐阿司匹林复合片体外溶出度测定方法,比较自制片与市售片的体外溶出行为。采用紫外-可见分光光度法测定自制片与市售片体外溶出度,用ƒ2相似因子法评价自制片与市售片溶出曲线的相似性。氯吡格雷硫酸盐的质量浓度在2.5~30.0 mg·L-1内与吸光度呈良好的线性关系(=0.999 9),阿司匹林的质量浓度在5.0~200.0 mg·L-1内与吸光度呈良好的线性关系(=0.999 7),氯吡格雷硫酸盐与阿司匹林的平均回收率分别为 98.76%和99.02%。自制片与市售片在不同介质中ƒ2相似因子均大于50,两者具有体外溶出一致性。所建立的溶出度测定方法高效简便,可用来测定氯吡格雷硫酸盐阿司匹林复合片的溶出度。
药剂学;氯吡格雷硫酸盐阿司匹林复合片;紫外分光光度计法; ƒ2相似因子法;氯吡格雷;阿司匹林;溶出度
氯吡格雷是一种前体药物,是继噻氯吡啶后发现的第二个噻吩并吡啶类药物,其活性代谢物之一具有抑制血小板聚集的作用[1]。氯吡格雷活性代谢物可选择性抑制腺苷1,6二磷酸(ADP)与血小板P2Y12受体的结合以及抑制随后的 ADP介导的糖蛋白(GP)IIb/ IIIa复合物的活化,从而抑制血小板聚集[2]。阿司匹林能使前列腺素合成酶乙酰化,抑制血小板的释放反应、减少血栓素A2(TXA2)生成,从而抑制血小板的聚集,主要用于预防和治疗缺血性心脏病、心绞痛、心肺梗塞、脑血栓的形成[3]。将氯吡格雷硫酸盐和阿司匹林联合使用能有效治疗由血小板聚集产生的血栓性疾病。
氯吡格雷硫酸盐阿司匹林复合片由赛诺菲安万特公式研制,于2013年在日本上市,商品名Complavin,规格75/100 mg。该复合片先制备阿司匹林肠溶片,作为片芯,后将氯吡格雷硫酸盐外层颗粒包覆在外侧制备成包芯片,使得氯吡格雷硫酸盐在胃中释放,阿司匹林肠溶片芯在小肠释放,有效避免阿司匹林胃肠道反应。国内目前并没有关于氯吡格雷硫酸盐阿司匹林复合片的研究,多是研究氯吡格雷硫酸盐阿司匹林双层片[4],本文作者以Complavin为参比制剂,研发了与其溶出度相似的自制制剂,建立了紫外分光光度计法测定体外溶出度,该方法简便快捷,且溶剂使用量少,能快速得到实验结果。
1 仪器与材料
RC12AD溶出试验仪(天津天大天发科技有限公司),UV1102紫外-可见分光光度计(上海天美科学仪器有限公司),ZP-5旋转压片机(上海天和制药机械有限公司),高效包衣机(创制机电科技发展(上海)有限公司),YD-1片剂硬度测试仪(天津精拓仪器科技有限公司)。
氯吡格雷硫酸盐阿司匹林复合片(自制,规格氯吡格雷硫酸盐75 mg,阿司匹林100 mg),氯吡格雷硫酸盐阿司匹林复合片(法国Sanofi-Aventis公司,规格氯吡格雷硫酸盐75 mg,阿司匹林100 mg),氯吡格雷硫酸盐原料药(浙江车头制药股份有限公司),阿司匹林原料药(吉林金恒制药股份有限公司),二氧化硅、交联聚维酮SH-SL10、玉米淀粉SH-H、羧甲基淀粉钠(安徽山河药用辅料股份有限公司),滑石粉(广西龙胜华美滑石开发有限公司),Eudragit®L30D-55(上海赢创-德固赛投资有限公司)。
2 方法与结果
2.1 溶出度方法学
2.1.1 检测波长的选择
精密称取氯吡格雷硫酸盐原料药适量,加甲醇20 mL使溶解,用pH值2.0盐酸缓冲溶液稀释成氯吡格雷硫酸盐质量浓度约为25 mg∙L-1的对照溶液,同时配制氯吡格雷硫酸盐外层片空白辅料(空白辅料1),在波长200~400 nm内扫描;另精密称取阿司匹林原料药适量,用pH值6.8磷酸盐缓冲溶液溶解并稀释成阿司匹林质量浓度约为100 mg∙L-1的对照溶液,同时配制阿司匹林肠溶片空白辅料(空白辅料2),在波长200~400 nm内扫描,结果见图1。
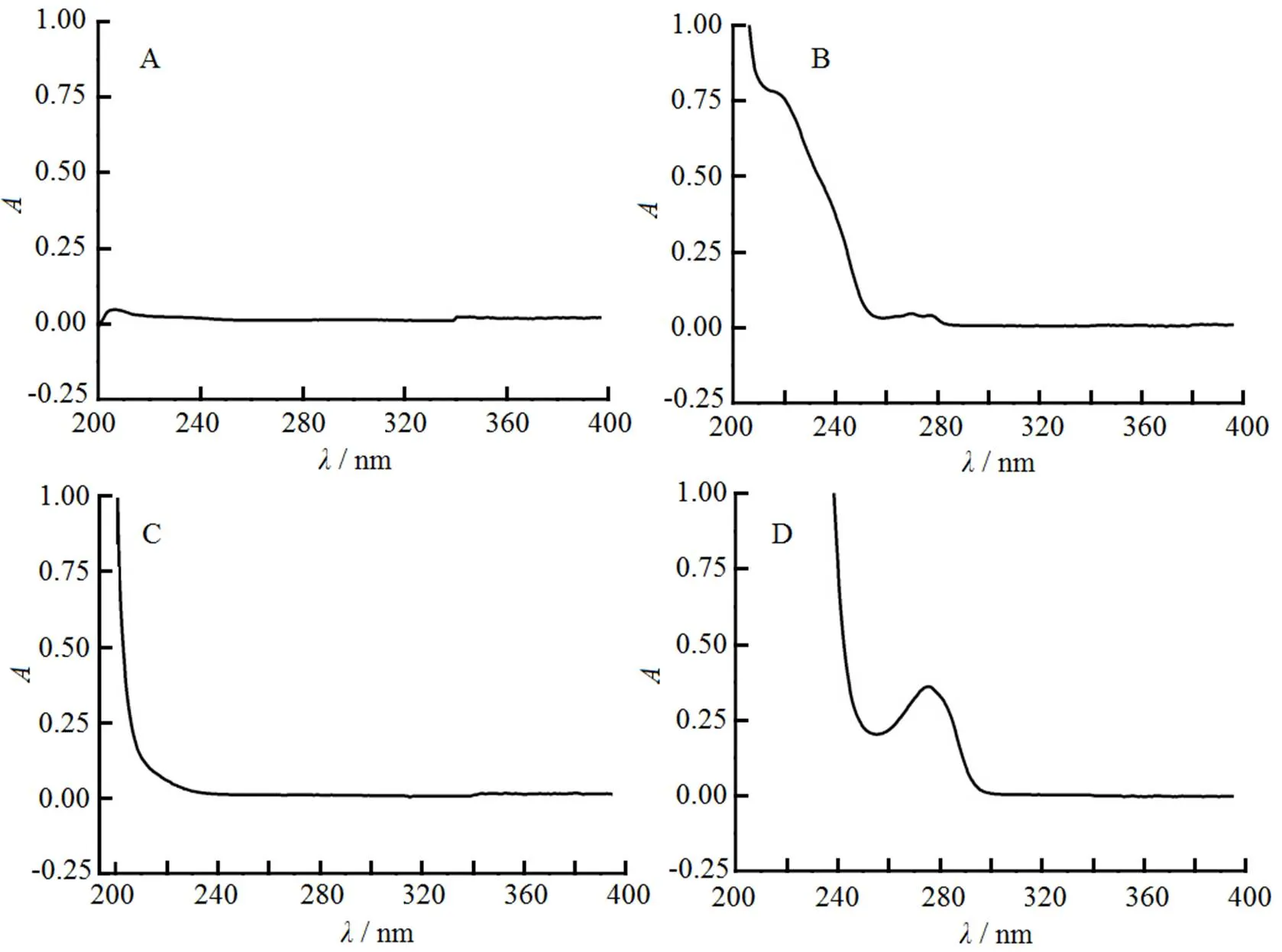
Fig. 1 UV-spectra of blank adjuvants 1(A), clopidogrel sulfate(B), blank adjuvants 2 (C) and aspirin(D)
由图1结果可知,氯吡格雷硫酸盐在240 nm处有较大吸收,辅料在波长240 nm下对主药无干扰,同时参考《USP40-NF35》和《日本药典》,均采用波长240 nm进行检测,故最终选择240 nm为紫外测定波长。阿司匹林在波长265 nm处有较大吸收,辅料在波长265 nm下对主药无干扰,同时参考《中华人民共和国药典》2005版二部选取265 nm为紫外测定波长。
2.1.2 标准曲线的制备与线性关系考察
精密称取氯吡格雷硫酸盐原料药12.50 mg,置于100 mL量瓶中,取甲醇20 mL溶解后,用pH值2.0盐酸缓冲溶液定容至刻度,作为储备液1;另精密称取阿司匹林原料药25.00 mg,置于100 mL量瓶中,用pH值6.8磷酸盐缓冲溶液溶解并稀释至刻度,作为储备液2。取储备液1,精密量取0.2、0.6、1.0、1.2、1.6和2.4 mL,分别置于6个10 mL量瓶中,用pH值2.0盐酸缓冲溶液稀释至刻度,摇匀,测定吸光度;取储备液2,精密量取0.2、0.8、2.0、4.0、6.0和8.0 mL,分别置于6个10 mL量瓶中,用pH值6.8磷酸盐缓冲溶液溶解并稀释至刻度,摇匀,测定吸光度。以吸光度()为纵坐标,质量浓度(,mg·L-1)为横坐标,分别绘制氯吡格雷硫酸盐和阿司匹林标准曲线并计算回归方程,其回归方程依次为:=1.52×10-2+1.68×10-2,=0.999 9;=3.3×10-3-5.6×10-3,=0.999 7。表明氯吡格雷硫酸盐质量浓度在2.5~30.0 mg·L-1内、阿司匹林质量浓度在5.0~200.0 mg·L-1内与吸光度线性关系良好。
2.1.3 精密度试验
精密称取氯吡格雷硫酸盐原料药和阿司匹林原料药,分别用pH值2.0盐酸缓冲溶液和pH值6.8磷酸盐缓冲溶液配制成质量浓度为25.0 mg·L-1和200.0 mg·L-1的溶液,连续测定6次吸光度。氯吡格雷硫酸盐吸光度的RSD值为0.46%,阿司匹林吸光度的RSD值为0.11%。结果表明,两者RSD值均小于2%,精密度符合要求。
2.1.4 回收率试验
根据《中华人民共和国药典》2015版通则9101药品质量标准分析方法验证指导原则[5],按处方量精密称取氯吡格雷硫酸盐外层片辅料分别放入100 mL量瓶内,加入处方量50%、80%、100%的氯吡格雷硫酸盐原料药,用pH值2.0盐酸缓冲溶液配制成低(主药处方量的50%)、中(主药处方量的80%)、高(主药处方量的100%)3种浓度的溶液,经过摇匀,滤过,稀释至线性范围内测定吸光度。按处方量精密称取阿司匹林肠溶片辅料分别放入100 mL量瓶内,加入处方量50%、80%、100%的阿司匹林原料药,用pH值6.8磷酸钠缓冲溶液配制成低(主药处方量的50%)、中(主药处方量的80%)、高(主药处方量的100%)3种浓度的溶液,经过摇匀,滤过,稀释至线性范围内测定吸光度。按上述标准曲线计算回收率,结果见表1。
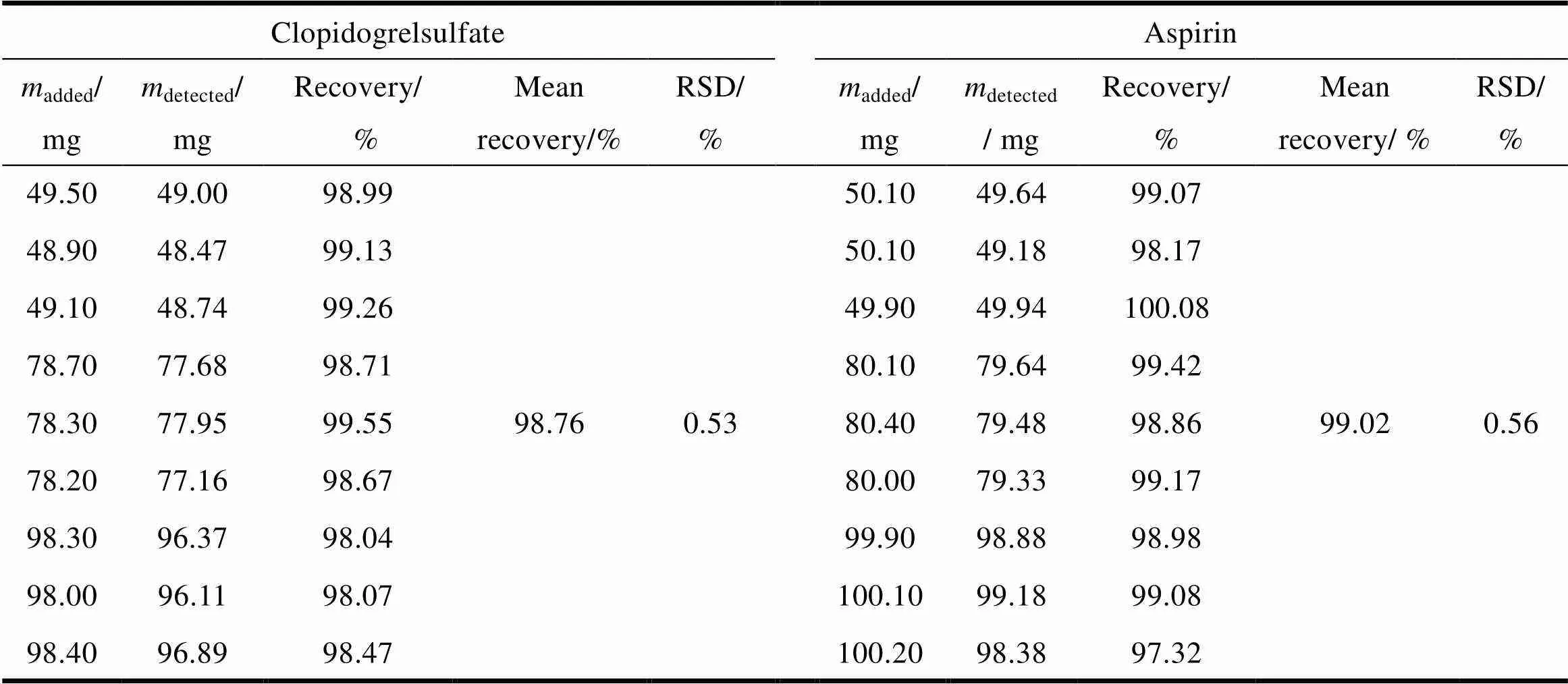
Table 1 The recovery of clopidogrel sulfate and aspirin
结果表明,该方法准确度符合要求。
2.1.5 稳定性试验
按照“2.1.3”条方法配制氯吡格雷硫酸盐和阿司匹林溶液,质量浓度分别为25.0 mg·L-1和200.0 mg·L-1,放置于37 ℃条件下,并于0、1、2、4、6、8和10 h测定吸光度。计算氯吡格雷硫酸盐和阿司匹林吸光度的RSD值分别为0.81%和0.94%。结果表明,氯吡格雷硫酸盐和阿司匹林在37 ℃条件下10 h内稳定性良好。
2.1.6 重复性试验
取自制品6片,按“2.2”条方法测定溶出度,氯吡格雷硫酸盐取pH值2.0盐酸缓冲溶液中45 min时溶出样品,阿司匹林取pH值6.8磷酸盐缓冲溶液中溶出90 min时溶出样品测定吸光度,根据标准曲线求算样品溶液的浓度,氯吡格雷硫酸盐和阿司匹林吸光度的RSD分别为0.77%和1.30%。结果表明,该方法重复性良好。
2.2 氯吡格雷硫酸盐阿司匹林片制备工艺
将阿司匹林原料药与辅料分别过180 μm筛,等量递加混合过筛,制粒,压片,包衣,老化。将氯吡格雷硫酸盐原料药与辅料分别过180 μm筛,等量递加混合过筛,制粒,制备包芯片。
2.3 溶出度测定方法
2.3.1 氯吡格雷硫酸盐溶出度的测定
按照2015版《中华人民共和国药典》释放度测定法[5],采用溶出度测定法第二法,以pH 值2.0盐酸缓冲溶液(取0.2 mol·L-1氯化钾溶液250 mL,加0.2 mol·L-1盐酸溶液65.0 mL,加水稀释至1 000 mL)1 000 mL为溶出介质,转速为50 r·min-1,依法操作,经5、10、15、20、30、45和60 min时,取溶液10 mL用0.45 μm滤膜过滤,取续滤液,在波长240 nm处测定吸光度。
2.3.2 阿司匹林肠溶片耐酸试验
取出未溶阿司匹林肠溶片芯并用pH值1.0盐酸溶液冲洗净后,采用溶出度测定法第一法,以pH值1.0盐酸溶液(9 mL盐酸加水稀释至1 000 mL)1 000 mL为溶出介质,转速为100 r·min-1转,依法操作,经120 min时,取溶液10 mL用0.45 μm滤膜过滤,取续滤液,参照《中华人共和国药典》2005版第二部,在波长280 nm处测定吸光度[6]。
2.3.3 阿司匹林肠溶片溶出度的测定
将阿司匹林肠溶片芯转移至1 000 mL、37 ℃的pH值6.8磷酸钠缓冲溶液(取0.1 mol·L-1盐酸溶液750 mL,0.2 mol·L-1磷酸钠溶液250 mL)中,继续溶出120 min,转速为100 r·min-1,依法操作,经15、30、45、60、90和120 min时取溶液10 mL,用0.45 μm滤膜滤过,取续滤液,参照《中华人民共和国药典》2005版第二部在波长265 nm处测定吸光度[6]。
2.4 氯吡格雷硫酸盐阿司匹林复合片的溶出曲线
2.4.1 氯吡格雷硫酸盐在不同溶出介质中的溶出曲线
分别以pH值1.0盐酸溶液、pH值2.0盐酸缓冲溶液、pH值4.5醋酸缓冲溶液和水为溶出介质,测定各取样点的溶出度,绘制溶出曲线,结果见图2。
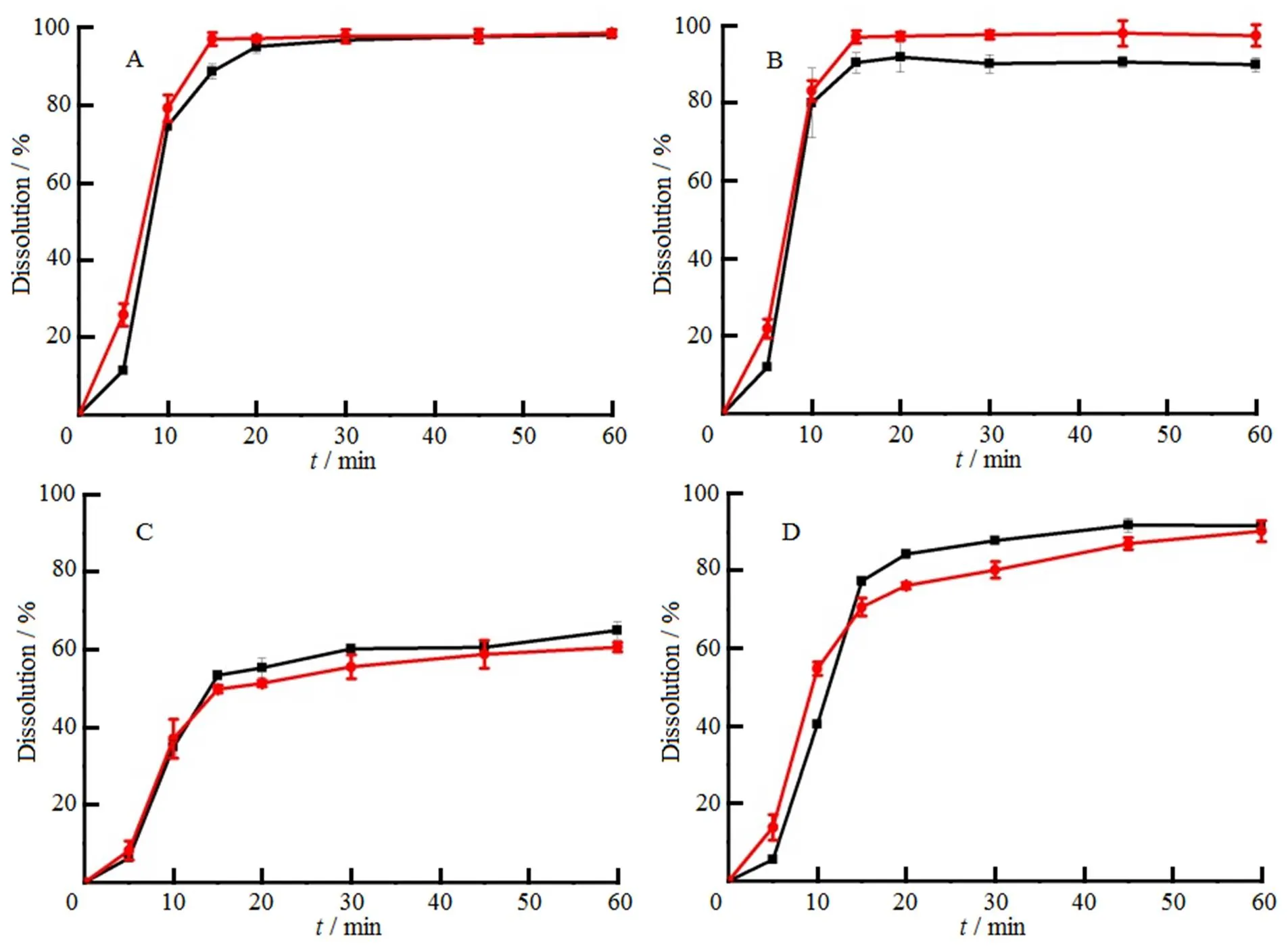
―Prepared tablets; ―Commercial tablets;
2.4.2 阿司匹林肠溶片耐酸试验
阿司匹林肠溶片在pH值1.0盐酸溶液中,耐酸2 h,取续滤液在波长280 nm下测定吸光度,均无吸收,说明阿司匹林肠溶片耐酸性良好。
2.4.3 阿司匹林肠溶片芯的溶出度测定
分别以pH值5.5、6.0、6.4和6.8磷酸盐缓冲溶液和水为溶出介质,测定各取样点的溶出度,绘制溶出曲线,自制片和市售片在pH值5.5、pH值6.0磷酸盐缓冲溶液和水中均无释放。自制片和市售片在pH值6.4、pH值6.8磷酸盐缓冲溶液中溶出曲线,结果见图3。
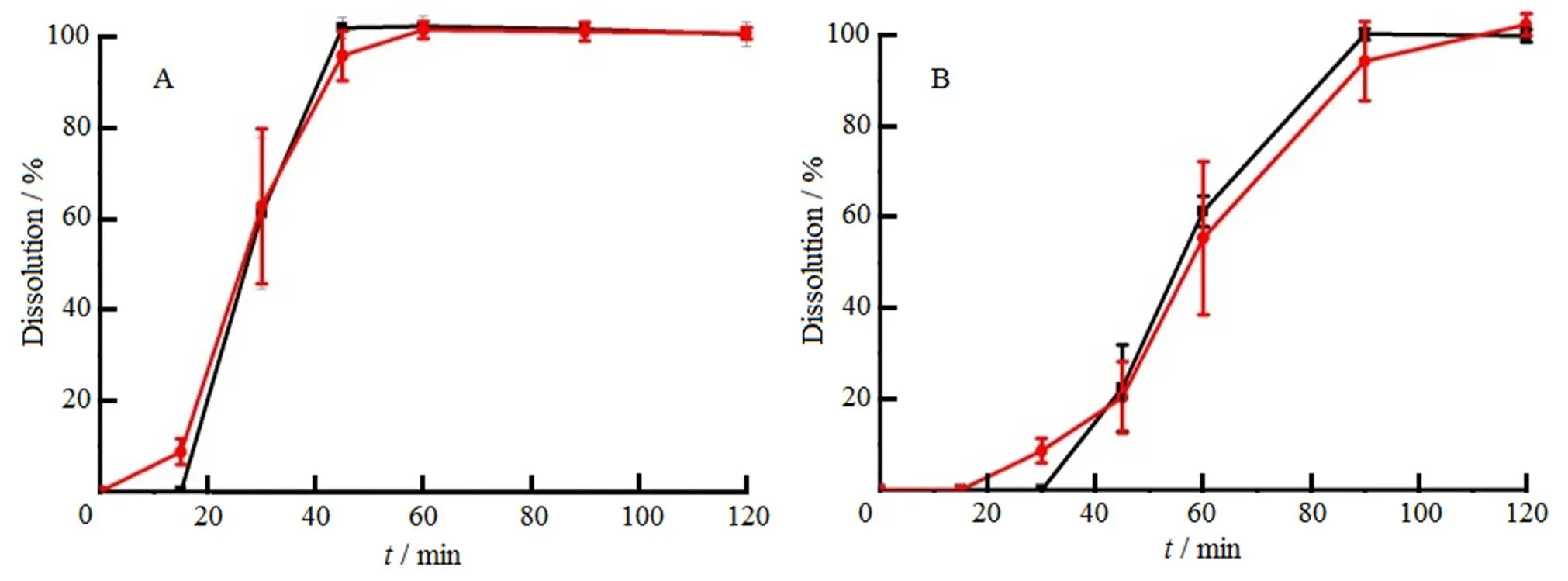
―Prepared tablet; ―Commercial tablet
2.4.4 氯吡格雷硫酸盐阿司匹林复合片溶出曲线相似性评价
溶出曲线相似性通常采用FDA公布的ƒ2相似因子法进行评价,该方法具体计算方法如下:

其中:为取样时间点个数,和分别为各取样时间点自制制剂和参比制剂平均溶出度。
根据溶出曲线相似性计算方法,参比制剂和市售制剂通常取3个时间点以上,且药物释放>85%以上的点选取1个即可,以ƒ2相似因子评价自制片与市售片相似性,当ƒ2>50时,溶出曲线相似,ƒ2越大两条曲线相似性越大[7]。不同介质中氯吡格雷硫酸盐及阿司匹林相似因子见表2。

Table 2 Similarity analysis of prepared tablets and commercial tablets in different mediums
结果表明,在以上溶出介质中,自制片与市售片的相似因子均大于50,说明自制片与市售片溶出行为相似。
3 讨论
a. 采用紫外分光光度法测定氯吡格雷硫酸盐和阿司匹林的溶出度,方法简便易行,且线性关系、精密度和回收率的考察结果表明该方法可靠、准确;相似因子结果表明,自制片与市售片在不同介质中相似因子均大于50,说明自制片与市售片具有良好的体外相似性。
b. 氯吡格雷硫酸盐只有在体内通过肝脏中的CYP3A4和其他CYP酶代谢后才会产生含有硫醇结构的活性分子,且该活性分子在体外极不稳定[8]。本文作者主要测定氯吡格雷硫酸盐的体外溶出,后续将进一步研究氯吡格雷硫酸盐的体内代谢过程,因此实验中没有测定氯吡格雷硫酸盐代谢物。
c. 很多研究表明氯吡格雷硫酸盐与阿司匹林联合使用能有效抑制血小板聚集、抑制血栓形成,有效治疗脑梗塞、不稳定性心绞痛和冠心病等[9]。本文作者将氯吡格雷硫酸盐和阿司匹林制备成包芯片,氯吡格雷硫酸盐在胃中快速释放,阿司匹林制备成肠溶片在小肠中释放,两个药先后发挥血小板聚集抑制作用,同时阿司匹林制备成肠溶片,可以有效避免阿司匹林长期服用带来的胃溃疡、胃出血等不良反应,提高患者顺应性[10]。
[1] 陈敏纯, 李雪晴, 贾艳艳, 等. LC-MS/MS法测定人血浆氯吡格雷酸浓度及生物等效性评价[J]. 中国新药杂志, 2012, 21(24): 2924-2928.
[2] SQUIZZATO A, KELLER T, ROMUALDI E, et al. Clopidogrel plus aspirin versus aspirin alone for preventing cardiovascular disease[J]. Cochrane Database Syst Rev, 2010, 19(1): CD005158.
[3] 王夏芹, 黄晓晖, 陈纭, 等. RP-HPLC法同时测定人血清中氯吡格雷和阿司匹林浓度[J]. 中国药房, 2010, 21(2): 122-124.
[4] 许婷婷, 王宏响, 季金玉, 等. 复方硫酸氢氯吡格雷阿司匹林双层片的制备和溶出度测定[J]. 沈阳药科大学学报, 2015, 32(2): 85-91.
[5] 国家药典委员会. 中华人民共和国药典: 四部[M]. 北京. 中国医药科技出版社, 2015: 374-377.
[6] 国家药典委员会. 中华人民共和国药典:二部[M]. 北京. 化学工业出版社, 2005: 283-284.
[7] 谢沐风. 溶出曲线相似性的评价方法[J]. 中国医药工业杂志, 2009, 40(4): 308-311.
[8] 胡维民. 氯吡格雷片比格犬体内的药物动力学[J]. 中国药剂学杂志: 网络版, 2009, 7(4): 328-337.
[9] JUNG J A, KIM T E, KIM J R, et al. The pharmacokinetics and safety of a fixed-dose combination of acetylsalicylic acid and clopidogrel compared with the concurrent administration of acetylsalicylic acid and clopidogrel in healthy subjects: A randomized, open-lable, 2-sequence, 2-period, single-dose crossover study[J]. Clinical Therapeutics, 2013, 35(7): 985-994.
[10] 褚晓杰. 肠溶型阿司匹林与普通阿司匹林胃肠道不良反应分析[J]. 中国现代药物应用, 2018, 12(13): 162-163.
dissolution of clopidogrel sulfate aspirin combination tablets
WEI Zhongli, LI Bing, HE Zhonggui, LIU Hongzhuo*
(,,110016,)
To establish andissolution method for clopidogrel sulfate aspirin combination tablets, and compare thedissolution behaviors of prepared tablets and commercial tablets.dissolution behaviors of prepared tablets and commercial tablets were determined by UV-visible spectrophotometer. The similarity of the dissolution curve between the prepared tablets and commercial tablets was evaluated by the ƒ2similarity factor method.The concentration of clopidogrel sulfate was linear in the range of 2.5-30.0 mg·L-1(=0.999 9), and the solubility of aspirin was linear in the range of 5.0-200.0 mg·L-1(= 0.999 7). The average recovery rates of clopidogrel sulfate and aspirin were 98.76% and 99.02%, respectively. The similarity factors(ƒ2) in both the prepared tablets and commercial tablets were greater than 50 in different mediums, indicating the consistency ofdissolution.The established dissolution method is efficient and simple, and can be used to determine the dissolution rate of clopidogrel sulfate aspirin combination tablets.
pharmaceutics; clopidogrel sulfate aspirin combination tablets; ultraviolet-visible spectrophotometry; ƒ2similarity factor method; clopidogrel; aspirin; dissolution
2019-01-24
魏忠莉(1992-), 女(汉族), 山东聊城人, 硕士研究生, E-mail weizhongli1992@163.com;
刘洪卓(1979-), 女(汉族), 辽宁沈阳人, 教授, 博士, 硕士生导师, 主要从事药剂学研究, Tel. 13236637187, E-mail liuhongzhuo@syphu.edu.cn。
(2019)03–0050–08
10.14146/j.cnki.cjp.2019.03.003
R94
A
(本篇责任编辑:赵桂芝)
