纳米金酶联免疫分析法的原理及其在医药检测中应用
2019-06-11张瑾,张婷
张 瑾,张 婷
纳米金酶联免疫分析法的原理及其在医药检测中应用
张 瑾,张 婷*
(上海中医药大学交叉科学研究院 穆拉德中药现代化研究中心,上海 201203)
综述了纳米金酶联免疫分析法(nano-ELISA)及其增强分析信号的原理,免疫金的制备方法及该技术在医药检测领域中应用的研究进展。查阅相关文献24篇,对纳米金酶联免疫分析法的原理、纳米金的制备方法及其增强分析信号的原理及在多种病原体、标志蛋白、药物有效成分含量等检测中的应用进行归纳总结。纳米金酶联免疫分析法将传统酶联免疫分析(ELISA)与胶体金标记技术相结合,可以大幅提高分析灵敏度,降低待检物的最低检测限。纳米金酶联免疫分析法在早期诊断标记物检测和药物的含量检测及药代动力学检测方面具有广阔的应用前景。
药剂学;酶联免疫分析;纳米金;医药检测;抗体-抗原
ELISA技术是19世纪70年代发展起来的一种新型免疫测定技术,其测定原理基于抗原与抗体的特异性结合反应,通过将待测物与酶连接,然后通过分析酶与底物的反应颜色标定待测物的浓度。具有灵敏度高、抗干扰性强且不需要复杂设备的优点,是目前应用最为广泛的免疫分析技术。纳米金具有较高的比表面积和便于修饰的表面,在表面选择性修饰多种基团后可起到探测小分子或生化标记物的作用。同时,纳米金由于表面等离子共振而在500~550 nm内有较强的吸收峰,为分析表面负载物的浓度提供了便利。纳米金酶联免疫分析(gold nanoparticles enzyme-linked immunoassay,nano-ELISA)将两者的优点相结合,能够极大放大检测灵敏度,与传统ELISA相比提高了几十倍甚至几百倍,能更早、更准确地发现某些疾病的标志物,因此近年来在临床医学检测及药物检测中已经有了长足的发展。
因而,纳米金作为生化标记物越来越多地应用于免疫标记技术,与ELISA技术结合后大幅提高了其检测限[1-2]。本文作者就该方法在医学检测及药物检测等方面中的应用研究现状和发展方向进行综述介绍。
1 Nano-ELISA分析的基本原理
Nano-ELISA分析的基本原理与传统ELISA相似。在传统ELISA中,基于抗原抗体的特异性结合原理,使抗原或抗体结合于某种固相的载体表面,并保持它的免疫活性,再利用抗原或抗体和某种酶连接形成酶标抗原或抗体,加入酶反应底物后,底物被酶催化变成有色产物,产物的量与受检物质的量直接相关,所以可以根据颜色反应来进行定性或定量分析。然而一个抗原抗体复合物上仅能连接一个酶标二抗分子,催化底物产生颜色反应的能力有限,因而只有在高强度可见光的条件下才能检测,极大地限制了检测灵敏度。而一个胶体金颗粒能够同时标记多个酶标二抗分子,这样应用于ELISA中就能使一个抗原抗体复合物连接多个酶标二抗分子,极大地提高了催化底物的能力,从而间接提高了检测灵敏度(图1)[3]。
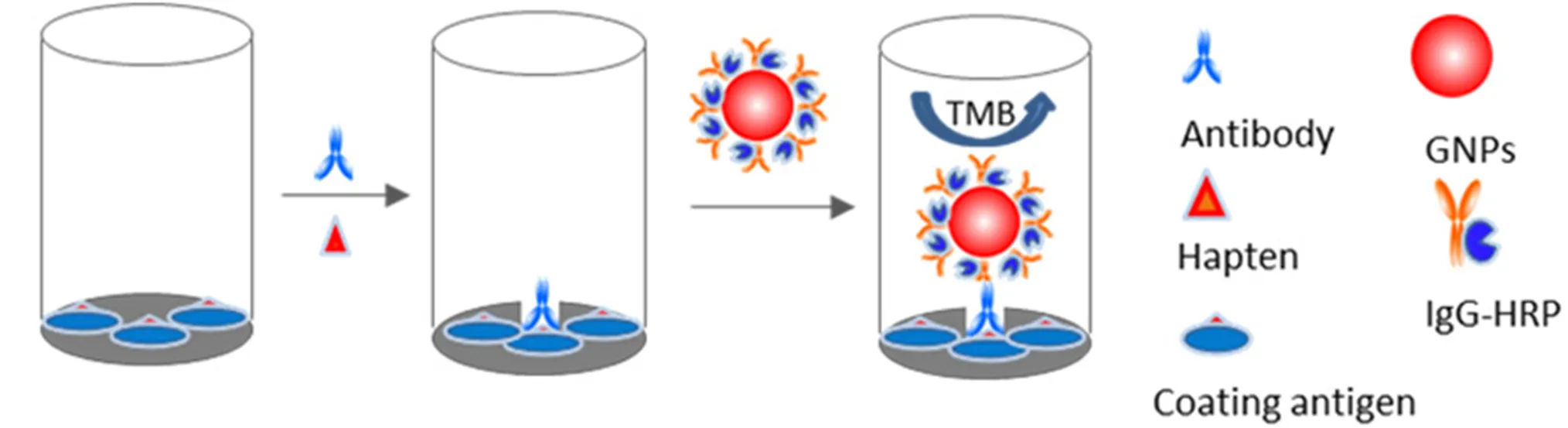
Fig. 1 Nano-enhanced ELISA method
2 纳米金的制备及免疫金的合成

胶体金通常是水溶胶或是Au纳米粒子的胶体悬浮液,因其表面等离子体共振的吸收峰,纳米Au溶液通常显现为红色等浓烈的颜色。胶体金颗粒在弱碱的环境下带负电荷,能够与多种生物分子或有机基团结合而不影响其活性。纳米Au可与巯基生成强的共价键,可通过交换反应改变表面修饰分子的链长;还能与氨基发生非共价键的静电吸附,与亲核试剂发生吸附而生成具备特殊功能的基团。寡核苷酸修饰的纳米金作为探针可用于DNA和蛋白的检测[4]。
3 纳米金增强分析信号的原理
传统ELISA分析灵敏度不足的原因主要有两个,一是抗原-抗体的结合和识别受二维板表面容量限制,固体基板上面吸附抗原或抗体的密度较低;二是ELISA显色信号来源于酶底物分子的显色反应,通常只有在较高的探测分子浓度下才方便肉眼判断。
因此增加固体基板上面吸附抗原或抗体的密度是提高其分析灵敏度的重要途径之一。考虑到纳米金比表面积大和表面化学可定制的优点,苏州大学提出利用纳米金颗粒组装薄膜修饰ELISA板并研究了对三种大小不同分析吸附能力的影响[5],研究结果表明ELISA基板经纳米金薄膜修饰后对溶菌酶、人血清蛋白和纤维蛋白原的吸附能力分别提高2.76、2.34和3.26倍,修饰后对抗凝血酶的检测能力提高约100倍;与未修饰基板的ELISA相比,对IgG的检测限能够降低两个数量级,对癌胚抗原(carcinoembryonicantigen,CEA)的检测限是2 μg∙L-1,而商业化的ELISA试剂盒的检测限是4 μg∙L-1。鉴于健康成人和烟民体内CEA最大值分别为2.5和5 μg∙L-1,纳米金修饰基板的ELISA法显著优于普通ELISA和商业化试剂盒,具有实用价值,可以进一步研究其在其他肿瘤标记物分析中的应用[6]。
利用H2O2诱导形成纳米金颗粒呈现的不同颜色可以进行免疫分析并提高检测灵敏度。Rica R.和Stevens M.在免疫分析过程中利用纳米金标记酶催化反应获得了肉眼可见的结果,其原理是:被分析物不存在时,H2O2将迅速还原生成球形非聚集的纳米金颗粒,从而溶液显红色;被分析物存在时,酶催化反应消耗了H2O2,减缓了金颗粒的生长动力学,形成形状不规则且聚集的纳米粒,从而溶液显蓝色[7]。采用该方法对HIV-1病毒抗原p24的肉眼观察检测限可低至1×10-18g∙mL-1[8]。Liu D.等将葡萄糖氧化酶(glucose oxidase,GOx)与检测抗体Ab2连接后负载于磁珠(MB)表面,通过免疫反应与聚苯乙烯板(PS)表面负载的探测物构成夹心结构。免疫分析时GOx催化葡萄糖氧化生成H2O2诱导形成5 nm金颗粒,使无颜色的金溶液变为红色便于在530 nm可见光波长进行检测分析(图2)。该方法对前列腺特异性抗原(PSA)的检测限为93 amol∙L-1,比商业ELISA检测限的6.3 pmol∙L-1放大4个数量级[9]。
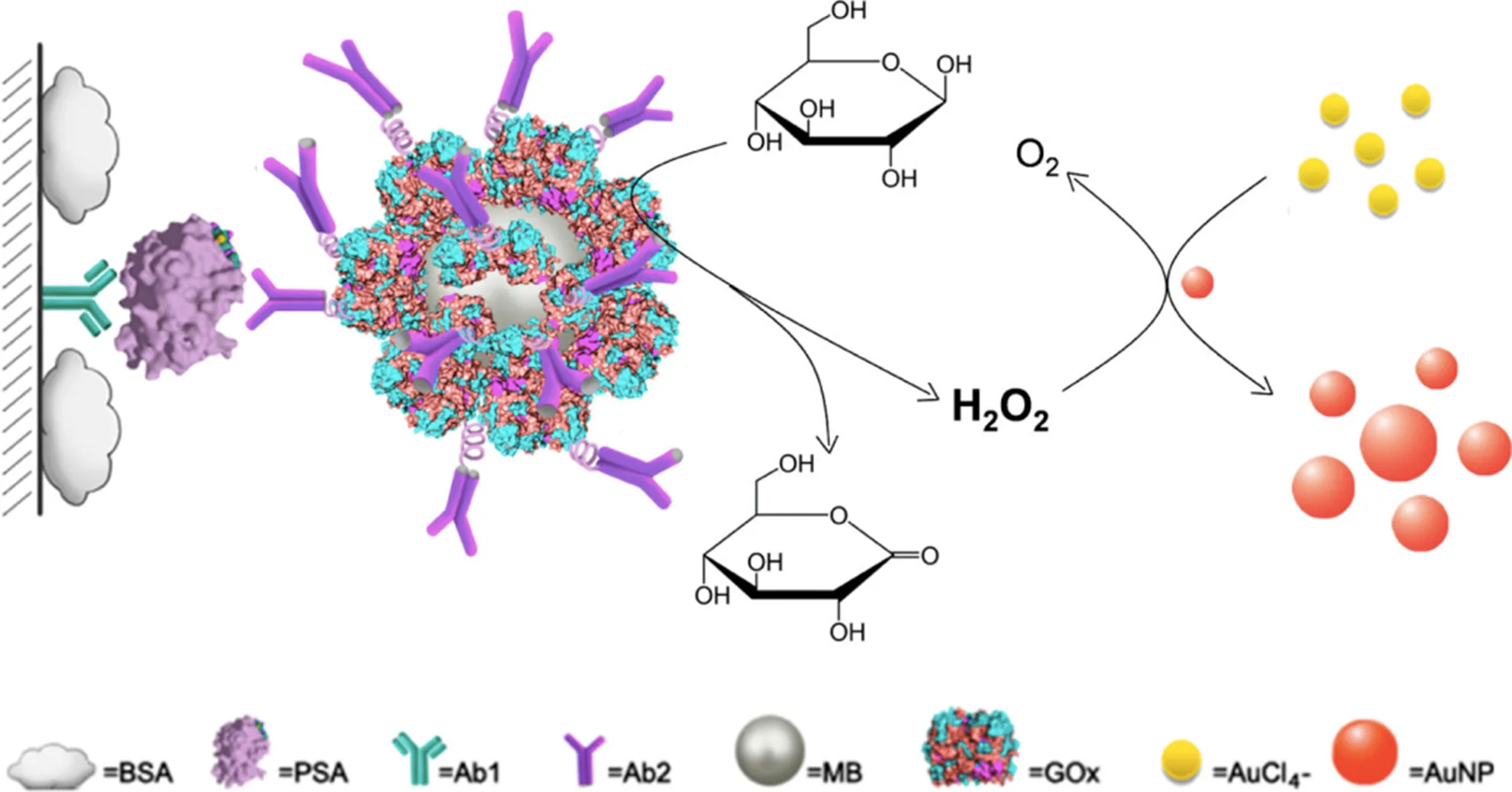
Fig. 2 Schematic diagram of the quantitative immunoassay based on glucose oxidase (GOx)-catalyzed growth of gold
4 在临床检测中的应用
目前临床上传统的免疫学检测方法包括放射免疫分析(RIA)和酶联免疫分析(ELISA),前者因具有放射性不易在临床推广;后者对蛋白质标记物的检测线一般在0.1 μg∙L-1,而疾病早期的标记物分子浓度水平一般低至pg∙L-1~ng∙L-1,因而限制了ELISA技术在临床上的应用。目前已有报道将纳米金与ELISA技术相结合,提高灵敏度可用于某些疾病早期相应分子标记物的检测。
CA15-3抗原是乳腺癌的肿瘤标志物,其准确分析对乳腺癌筛查和术后跟踪均有重要作用。Ambrosi A等将纳米金与HRP标记的CA15-3抗体相连接,建立了nano-ELISA检测方法,与传统ELISA相比,灵敏度提高了两倍,加入底物TMB后的反应时间由30 min缩短至5 min[4]。Seo SH等将兔热病杆菌抗原蛋白和5巯基DNA寡核苷酸(5-AACCACAGTG-3)修饰在纳米金表面组装为Ab-Au-DNA探针用于兔热病杆菌分析,相比传统ELISA检测灵敏度提高37倍以上[10]。
p53蛋白由p53抑癌基因突变产生,是一种重要的肿瘤预后因子。通过将辣根过氧化物酶(HRP)直接或通过寡核苷酸链间接标记在纳米金表面,制备了IgG-Au-HRP和IgG-Au-DNA-HRP两种探针均具备较好的p53蛋白检测效果,且后者的检测灵敏度更高[11]。Jia CP等将HRP标记的链霉亲和素(Streptavidin-HRP)和p53检测抗体按一定比例修饰在纳米金表面,HRP作为信号放大器,然后与p53捕获抗体修饰的磁珠组装成磁珠-目标蛋白-金夹心结构探针建立了nano-ELISA法,可以探测低至5 ng∙L-1的p53蛋白,相比传统的ELISA分析灵敏度提高了约100倍,且检测时间缩短至2 h以内[12]。将纳米金结合大量的检测抗体和HRP用作显色信号放大探针,结合ELISA对鼠伤寒沙门氏杆菌的分析检测限低至103CFU∙mL-1,线性范围是1×103~1×108CFU∙mL-1,分析时间缩短至3 h以内[13]。
骨桥蛋白的过度表达对于口腔鳞状细胞癌的发生是至关重要的,这种过度表达可以通过mRNA定量研究和免疫组织化学分析进行证实。基于此项试验,开发了基于纳米金颗粒的ELISA系统,用于检测非侵入性骨桥蛋白。即在常规ELISA中加入纳米金以提高分析的灵敏度。与骨桥蛋白-ELISA试剂盒相比,在纳米金修饰的情况下,检测限显着降低(检出限:0.14 μg∙L-1)。且改良的ELISA具有更宽的线性范围(0.31~20 μg∙L-1)、良好的重现性和针对唾液中测试干扰物的特异性。最后,使用加入人工唾液和正常唾液样品中的骨桥蛋白验证纳米金酶联免疫分析,结果显示具有良好的准确性,表明此联用系统有望制成试剂盒应用于实际样品的分析[14]。
5 在药学检测中的应用
氟硝西泮是目前临床上应用广泛的苯二氮卓类镇静催眠药,其尿液中的主要代谢物是7-氨基氟硝西泮(7-ANZP)。分析7-ANZP的浓度对研究药物代谢动力学、确保药物安全性并有效改善患者生活质量有重要作用。尽管GC-MS和LC MS-MS等仪器分析方法可以同时检测苯二氮卓类药物及7-ANZP,但程序繁琐、耗时且费用高。Peng C等通过将IgG-HRP修饰在柠檬酸还原法制备的纳米金颗粒表面作为信号探针,建立的nano-ELISA法对7-ANZP的检测限为0.18 ng∙g-1,与不使用纳米金的传统ELISA相比,灵敏度提高了20倍,且具有操作简便的优点[3]。去甲基睾酮是应用于治疗贫血、老年骨质疏松等疾病的合成甾体激素。通过制备高活性的HRP-IgG-纳米金复合物应用于ELISA中,检测灵敏度达到10 ng∙L-1,线性范围为30 ng∙L-1~10 μg∙L-1,灵敏度比传统ELISA提高了10倍。对去甲基睾酮含量为1.0~20 g∙kg-1的牛肉样品中检测回收率达87.8%~96.2%[15]。
相思子毒素是豆科植物相思子中的毒蛋白,分子由两条多肽链通过一个二硫键连接而成。由于相思子毒素的蛋白质抑制作用,对多种肿瘤细胞有很强的抑制作用,是一种有开发前途的抗癌药物。Xu C等将单捕捉抗体接在纳米金表面作为探针,通过三明治结构ELISA方法分析相思子毒素蛋白的检测限低至15.6 μg∙L-1[16],为中药的药物机理研究提供了便利工具。除单纯使用纳米金负载酶提高ELISA的检测灵敏度,学术界还利用纳米Ag较强的表面等离子体共振(SPR)效应进一步增强其检测相思子毒素蛋白的信号[17]。通过在纳米金表面生成一层纳米结构银使SPR共振波长蓝移,由于SPR吸收峰移动量与Au表面连接酶的量相关,因而可以检测更低浓度的药物分子。
6 在食品安全检测中的应用
纳米金ELISA还可以用于检测与食品卫生、环境安全相关的特定分子。这些分子往往只有一个抗体结合位,因而难以应用基于捕获抗体-目标蛋白-检测抗体夹心结构的ELISA方法提高检测灵敏度。Zhou等人进一步提出基于特异抗体及HRP双修饰的纳米金和单克隆抗体的增强ELISA检测方法,并在成功运用于水中多种重金属离子(如铅、汞、镉等)[18-19]和牛奶中干酪素[20]的检测。食源性动物中19-去甲睾酮对人体代谢会产生不良影响,传统上通过较为复杂的GC-MS方法检测。Jiang等人借助细胞融合技术获得的19-去甲睾酮的单克隆抗体并通过单步试纸条ELISA方法分析了牛肉中的残余含量,在PBS缓冲溶液中的分析线性范围为0.03–38 μg∙L-1,检测限为10 μg∙L-1[21]。类似地,将结合BPA抗体核酸适体的纳米金制作的检测试纸可通过肉眼判断水中的双酚A(BPA)残留[22]。黄曲霉毒素B 1(AFB 1)在自然界普遍存在,污染多种粮食作物和饲料,对动物和人类的健康造成严重危害。章先等人通过采用纳米金颗粒和辣根过氧化物酶双标记的AFB_1单克隆抗体,建立了一种新型酶联免疫检测方法,通过实验表明,此方法耗时短且灵敏度高,交叉反应率低,可用于实际样本中AFB_1的快速定量检测与分析,也为其他霉菌毒素的精准检测技术开发提供了参考[23]。由于Ag的表面等离子体共振效应强于Au,通过在Au表面沉积部分Ag还可以进一步提高分析的灵敏度[24]。
7 结论与展望
现代医疗技术的进步要求实现对肿瘤等多种恶性疾病的早期发现,因此对较低浓度的分子标记物的高灵敏度识别是早期诊断的关键,寻找可靠性高的诊断方法已成为医学检测研究的一项重要课题。ELISA是当前临床诊断应用最为广泛的免疫分析技术,而采用纳米金作为酶载体后大幅提高了其检测灵敏度,已在多种病原体和肿瘤标记物检测中获得了广泛应用,可为疾病早期诊断标记物分子浓度低的检测问题提供较好的解决方案。
此外,纳米金酶联免疫分析在应用于天然活性成分检测的研究则少见报道。目前ELISA应用于天然活性成分的检测已经比较成熟,但检测灵敏度仍有待提高的空间。因此此技术也适用于药材或中成药中有效成分或指标成分的检测,及天然药物活性成分或毒性成分的药代动力学检测。
[1] ZHANG S, GARCIA-D'ANGELI A, BRENNAN J P, et al. Predicting detection limits of enzyme-linked immunosorbent assay (ELISA) and bioanalytical techniques in general[J]. The Analyst, 2014, 139(2): 439-445.
[2] CHO I H, IRUDAYARAJ J. In-situ, immuno-gold nanoparticle network ELISA biosensors for pathogen detection[J]. International Journal of Food Microbiology, 2013, 164(1): 70-75.
[3] PENG C, DUAN X, SONG S, et al. Parts per trillion detection of 7-aminonitrazepam by nano-enhanced ELISA[J]. International Journal of Molecular Sciences, 2013, 14(10): 19474-19483.
[4] AMBROSI A, AIRÒ F, MERKOÇI A. Enhanced gold nanoparticle based ELISA for a breast cancer biomarker[J]. Analytical Chemistry, 2010, 82(3): 1151-1156.
[5] ZHOU F, YUAN L, WANG H, et al. Gold nanoparticle layer: A promising platform for ultra-sensitive cancer detection[J]. Langmuir the Acs Journal of Surfaces & Colloids, 2011, 27(6): 2155-2158.
[6] ZHOU F, WANG M, YUAN L, et al. Sensitive sandwich ELISA based on a gold nanoparticle layer for cancer detection.[J]. Analyst, 2012, 137(8): 1779-1784.
[7] RICA R, STEVENS M. M. Plasmonic ELISA for the ultrasensitive detection of disease biomarkers with the naked eye[J]. Nature Nanotechnology, 2012, 7(12): 821-824.
[8] RICA R, STEVENS M M. Plasmonic ELISA for the detection of analytes at ultralow concentrations with the naked eye[J]. Nature Protocols, 2013, 8(9): 1759-1764.
[9] LIU D, YANG J, WANG H F, et al. Glucose oxidase-catalyzed growth of gold nanoparticles enables quantitative detection of attomolar cancer biomarkers[J]. Analytical Chemistry, 2014, 86(12): 5800-5806.
[10] SEO S H, LEE Y R, JEON J H, et al. Highly sensitive detection of a bio-threat pathogen by gold nanoparticle- based oligonucleotide-linked immunosorbent assay[J]. Biosensors & Bioelectronics, 2015, 64: 69-73.
[11] 黄云艳, 贾春平, 刘美英, 等. 两种纳米金标记p53抗体探针的制备、表征和性质研究[J]. 中国医药生物技术, 2010, 5(3): 171-176.
[12] JIA C P, ZHONG X Q, HUA B, et al. Nano-ELISA for highly sensitive protein detection[J]. Biosensors & Bioelectronics, 2009, 24(9): 2836-2841.
[13] WU W, LI J, PAN D, et al. Gold nanoparticle-based enzyme-linked antibody-aptamer sandwich assay for detection ofTyphimurium[J]. ACS Applied Materials & Interfaces, 2014, 6(19): 16974-16981.
[14] CHAKRABORTY D, VIVEKA T S, ARVIND K, et al. A facile gold nanoparticle–based ELISA system for detection of osteopontin in saliva: Towards oral cancer diagnostics[J]. Clinica Chimica Acta, 2018, 477: 166-172.
[15] 刘春丽, 宋姗姗, 刘丽强, 等. 动物食品中去甲基睾丸酮的纳米增强酶联免疫分析方法[J]. 食品与生物技术学报, 2013, 32: 656-660.
[16] XU C, LI X, LIU G, et al. Development of ELISA and colloidal gold-pab conjugate-based immunochromatographic assay for detection of abrin-a[J]. Monoclonal Antlibodies in Immunodiagnosis and Immunotherapy, 2015, 34(5): 341-345.
[17] YANG W, LI X B, LIU G W, et al. A colloidal gold probe-based silver enhancement immunochromatographic assay for the rapid detection of abrin-a[J]. Biosensors & Bioelectronics, 2011, 26(8): 3710-3713.
[18] ZHOU Y, TIAN X L, LI Y S, et al. An enhanced ELISA based on modified colloidal gold nanoparticles for the detection of Pb(II)[J]. Biosensors & Bioelectronics, 2011, 26(8): 3700-3704.
[19] ZHOU Y, TIAN X L, LI Y S, et al. A versatile and highly sensitive probe for Hg(II), Pb(II) and Cd(II) detection individually and totally in water samples[J]. Biosensors & Bioelectronics, 2011, 30(1): 310-314.
[20] LI Y S, ZHOU Y, MENG X Y, et al. Enzyme–antibody dual labeled gold nanoparticles probe for ultrasensitive detection of-casein in bovine milk samples[J]. Biosensors & Bioelectronics, 2014, 61: 241-244.
[21] JIANG Jinqiang, WANG Ziliang, ZHANG Haitang, et al. Monoclonal antibody-based ELISA and colloidal gold immunoassay for detecting 19-nortestosterone residue in animal tisues[J]. Agric. Food Chem, 2011, 59: 9763-9769.
[22] MEI Zhanlong, CHU Huaqin, CHEN Wei, et al. Ultrasensitive one-step rapid visual detection of bisphenol a in water samples by label-free aptasensor[J]. Biosensor & Bioelectro, 2013, 39: 26-30.
[23] 章先, 方云, 付子贤, 等. 基于纳米金和辣根过氧化物酶双标记抗体的黄曲霉毒素B_1高灵敏检测方法的建立及应用[J]. 菌物学报, 2018, 37(11): 1516-1524.
[24] CUI Gang, CHU Huaqin, HU Yongming, et al. Ultrasensitive signal amplified immunoassay of medroxy progesterone acetate (MPA) using the atomic absorption of silver deposited on the surface of gold nanoparticles[J]. Food and Agricultural Immunology, 2010, 21: 165-173.
Current progress on the principle and application of gold nanoparticles combined ELISA in medical and pharmaceutical detections
ZHANG Jin, ZHANG Ting*
(,,,201203,)
To review the recent process of the basic principles and application of gold nanoparticles combined enzyme linked immunoassay (ELISA), including the preparation and surface modification of gold nanoparticles, and analysis protocols in medical and pharmaceutical detections.The principle of nano-ELISA and preparation of gold nanoparticles and the principle of the signal enhancement were introduced, and its application in the detection of a variety of pathogens, marker proteins, and the contents of effective components of drugs were summarized.The ELISA combined with colloidal gold labeling technique can significantly improve the analytical sensitivity and reduce the detection limit of the subject.Nano-ELISA offers huge potential in clinic diagnosis and drug content and pharmacokinetics detection.
pharmaceutics; ELISA; Gold nanoparticles; Clinical diagnosis; Antibody-antigen
2019-01-13
张瑾(1990-), 女(汉族), 辽宁沈阳人, 硕士研究生, E-mail 1243706441@qq.com;
张婷(1978-), 女(汉族), 江苏徐州人, 副研究员, 博士, 硕士生导师, 主要从事中药活性成分与质量评价方面的研究, Tel. 13611939030, E-mail zhtcpu@163.com。
(2019)03–0083–08
10.14146/j.cnki.cjp.2019.03.007
R94;R392
A
(本篇责任编辑:赵桂芝)
