基于细胞膜伪装的纳米药物传递系统的研究进展
2019-06-11马徵薇骆芙瑶宁宝入陈立江
马徵薇,骆芙瑶,宁宝入,陈立江
基于细胞膜伪装的纳米药物传递系统的研究进展
马徵薇,骆芙瑶,宁宝入,陈立江*
(辽宁大学 药学院,辽宁 沈阳 110036)
近年来,随着纳米载药系统的不断深入研究,人们发现纳米制剂有着易被网状内皮系统的巨噬细胞吞噬、难以达到特定靶向部位、对肝脾伤害较大等缺陷。一种新型复合类载体的出现大大解决了这些问题,这类载体由安全友好的内源性细胞膜和纳米载药系统结合形成,能够同时拥有两种载体的共同优势。而通过选择不同细胞外膜如红细胞外膜、癌细胞外膜、血小板外膜等还能够具有逃避免疫系统的识别、靶向定位肿瘤部位、高效地完成药物传递等作用。本文作者对这类复合类载体的外层细胞膜及内核纳米载药系统的种类、优势、载体制备过程、发展情况进行了综述,以期促进这类新型复合类载体在药物传递系统中的临床应用。
药剂学;纳米药物传递系统;综述;复合类载体;细胞膜
传统的纳米药物载体在药学应用中占据极为重要的地位[1],这类纳米微粒,由天然高分子或合成类高分子化合物制成,能够将药物包封在其中,形成纳米载药传递系统。纳米载药技术在药物传送方面具有许多自身特有的优势[2],但是同时也一直都存在着一个问题,就是所有表面无修饰的外源性纳米药物均会被网状内皮系统的巨噬细胞所吞噬,这使得大部分纳米制剂都富集在肝、脾,在体内没有长循环作用,也不能较好到达靶向部位[3]。
近年来,细胞类载体逐步迈入人们的视线。这类载体因源于自身细胞[3-4],与生物体融合性强,所以将它们作为药物载体制成的仿生药物传递系统[5],能够到达指定位置再特异性地释放药物,从而减少药物给人体带来不必要的刺激,但同时也有较明显的缺陷:载药量不高,且很难从工艺上提高药物载入的计量。
为解决以上问题,科研人员提出了复合类载体的概念[3],这类载体在纳米载药系统的外层修饰了一层细胞膜,综合了纳米载药系统的载药量高、细胞类载体生物相容性好的优势,也摒弃了其各自作为载体时的劣势,从而显著提高纳米粒子的稳定性,减少了药物的泄漏[6]。通过选择复合类载体外层修饰的细胞膜,可以达到不同的药物设计目的。例如,利用红细胞外膜充当伪装纳米载药系统身份的“外衣”,帮助药物避开免疫系统的检测;利用癌细胞外膜充当伪装纳米载药系统身份的“外衣”能够实现主动靶向,帮助更好的定位到肿瘤部位,起到更显著的疗效[7]。细胞膜伪装纳米药物过程见图1。
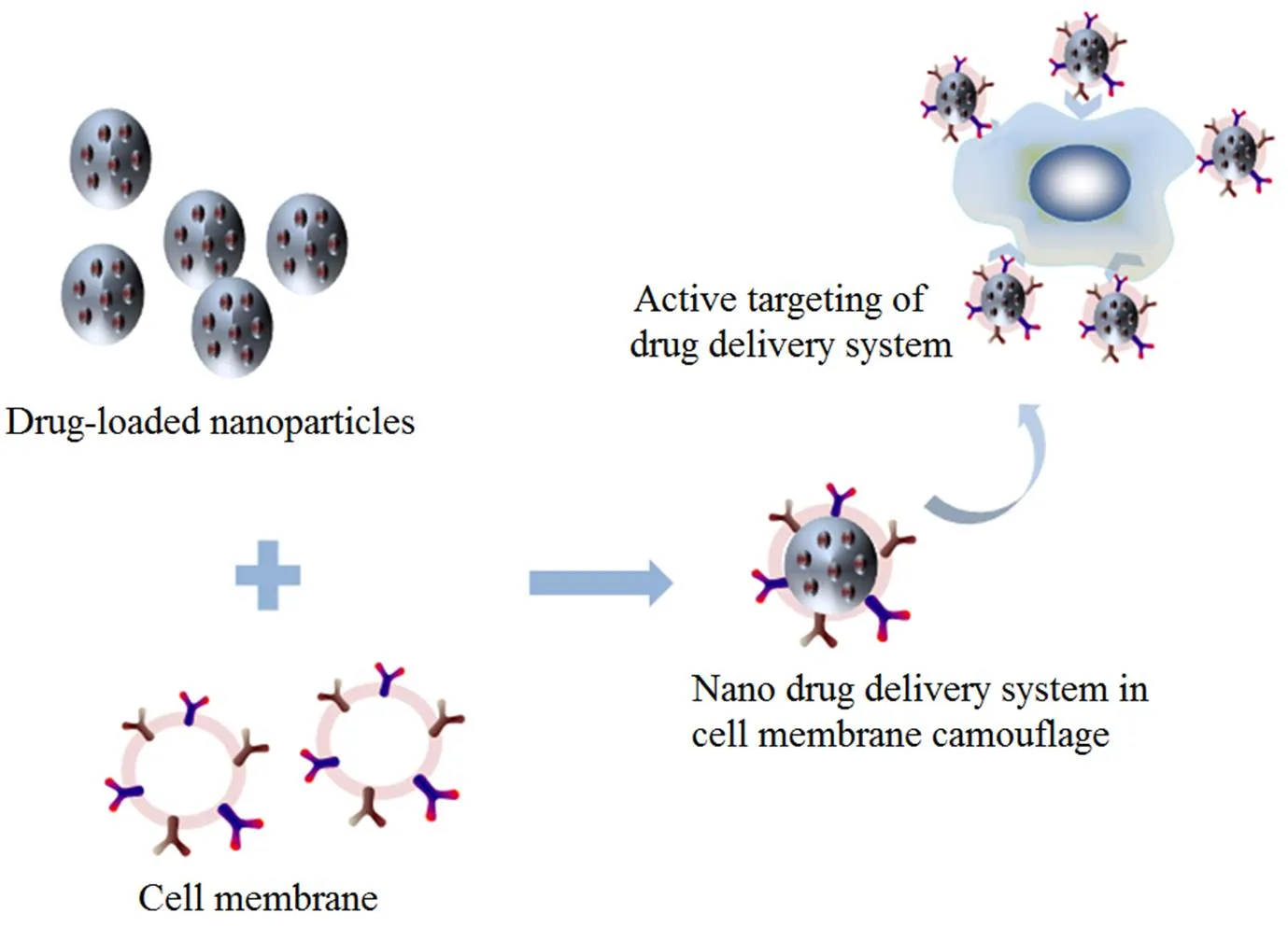
Fig. 1 Schematic map of membrane camouflage nanopharmaceuticals
作者综述了近年来国内外运用细胞膜伪装的纳米载药系统的研究进展[8],介绍了作为“伪装外衣”的细胞膜的种类及优势,内层被包衣的纳米粒的种类,以及细胞膜伪装的纳米药物传递系统的制备与表征。
1 伪装纳米载体细胞膜的分类及优势
从近年的研究可以发现,已经开发为伪装纳米粒的细胞膜有红细胞外膜、白细胞外膜、血小板膜、间质干细胞外膜、癌细胞外膜和细菌外膜囊泡[9-10],其中对红细胞外膜研究时间开始的最早,现阶段的研究成果也较为成熟。如果在提取这些细胞膜的时候膜表面的特异性蛋白没有被破坏,那么在后续利用细胞膜修饰纳米载体时,这个载药体系就能够利用这种自我标记来发挥作用,红细胞外膜、白细胞外膜、间质干细胞外膜、血小板膜都可以利用自身特性逃避免疫系统的识别[11-12],而细菌外膜囊泡、癌细胞外膜反而能刺激免疫应答。除此之外,不同细胞膜的膜上有着不同的蛋白[2],也就形成了不同类型的“伪装外衣”,人们可以通过需要选择不同的外衣实现生物靶向[13],弱化了人为化学修饰,减少了操作上的不便。当整个体系到达指定部位时,发生膜破裂,药物得到释放以发挥作用,“伪装外衣”被自身免疫系统吞噬,完成载体的自身降解。
1.1 以红细胞膜作为纳米制剂伪装的优势
利用红细胞膜来修饰纳米载药系统[14],除了逃避免疫系统的识别,一个比较显著的优势是可以延长药物在体内的循环时间[7],为长循环药物提供一种新的设计思路[15]。Per-Arne Oldenborg等[16]验证了这个想法,他们制备得到红细胞膜伪装的纳米粒载药系统(RBC-Nps)后,将样品用SDS-PAGE凝胶电泳分离蛋白,利用Western-blotting技术,证明红细胞膜从红细胞提取的过程中,红细胞表面存在着能够自我标记的整合素相关蛋白CD47,通过与巨噬细胞表达的信号调整蛋白SIRPa相互作用[16-17],来降低吞噬作用。这类似于一种表达友好的信号,使免疫系统认识到这是一种体内常见细胞,而非外来侵略的物质,继而延长药物在体内的循环时间。
1.2 以白细胞膜作为纳米制剂伪装的优势
利用白细胞膜伪装的纳米载药系统可避免被免疫系统清除,且它们可通过受体-配体相互作用与内皮细胞沟通,并通过发炎的重建内皮传递和释放“药物分子”载荷。
Parodi等[18]利用白细胞膜和介孔硅纳米粒成功制备上述新型载体(LLVs),并在LLV表面和纳米内核载体表面分别用荧光做标记,用小鼠J774巨噬细胞和人THP-1吞噬细胞探究了LLV伪装的药物载体抑制颗粒内化的能力(图1)。结果表明,利用白细胞伪装的纳米载体会抑制微粒的调整素和被清除的概率,细胞膜的来源会影响内化率。
通过体外和体内实验相结合的方法,他们发现LLVs能够避免溶血性,延缓单核吞噬细胞系统的吸收,优先结合发炎的内皮细胞,促进化疗药物在内皮细胞间的运输,同时促进溶酶体途径。
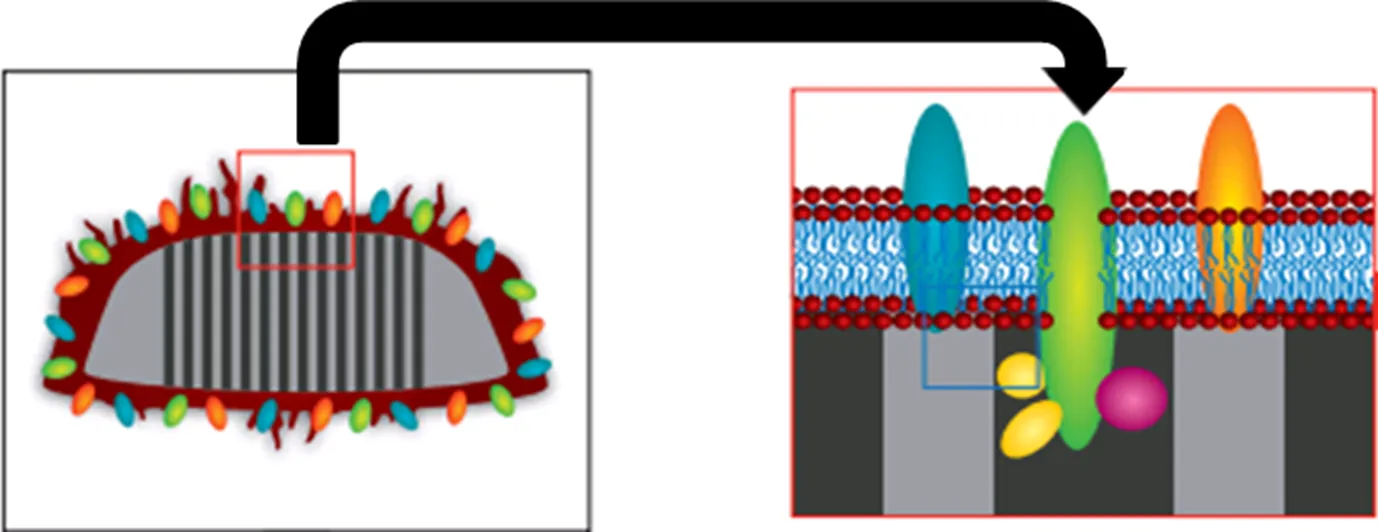
Fig. 2 A cartoon of LLV: the leukocyte-derived cell membranes fully cover the NPS and seal off its pores
1.3 以癌细胞膜作为纳米制剂伪装的优势
癌细胞所表现出的独特特性在很大程度上可归因于其膜上存在的复杂抗原特征,这种抗原特征实现了癌细胞彼此相互特异识别,使同源肿瘤细胞有了互相亲近的作用[19]。不需要繁琐的化学修饰,癌细胞膜以其自身对癌细胞的粘附与识别,实现“定位”功能[20],使整个纳米载药系统更多更好的聚集在癌细胞表面,大大减少了对机体正常细胞的伤害。
另外,膜的肿瘤抗原也被用来训练免疫系统识别和对抗癌症,Ronnie H. Fang等[21]证明,通过将颗粒与免疫佐剂偶联,得到的制剂可用于促进肿瘤特异性免疫应答,用于疫苗应用。
1.4 以细菌外膜囊泡作为纳米制剂伪装的优势
细菌外膜囊泡(outer membrane vesicles,OMVs)是一种由细菌分泌的一种20~250 nm封闭的小泡结构,是细菌外膜发生出芽形成的,具备外膜及周质的成分。因此,细菌外膜囊泡虽然没有生命活性却含有细菌膜表面大量的抗原,这种生物外膜不能逃避免疫系统的识别,反而可以有效刺激免疫系统做出应答[22]。
仅从表面进行识别的话,细菌囊泡会被机体当作细菌处理,触发免疫反应并使机体产生免疫记忆[23],并在二次被攻击时做出防御,因而将其作为疫苗的研究前景广阔。Gao等[24]制备了细菌膜包衣的金纳米粒(BM-AuNPs),给小鼠皮下注射时,BM-AuNPs能够快速引起淋巴结中树状突细胞的活化和成熟(图3)。这个研究表明,用细菌膜作为合成纳米粒药物的载体以制备抗细菌疫苗是非常有前景发展的。
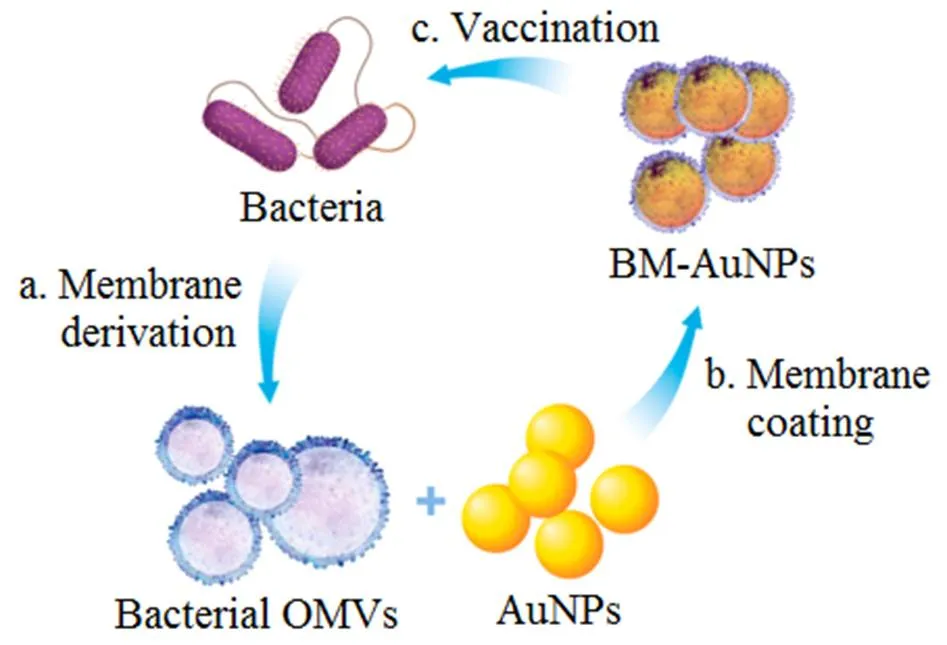
Fig. 3 The process of camouflage aurum nanoparticles with Escherichia coli outer membrane vesicles
同时他也证明了,被细菌外膜囊泡包裹的纳米载药系统的缓冲稳定性被大大增加。Gao等[24]通过对比大肠杆菌膜-载药金纳米粒构成的载药系统和无膜的载药金纳米粒从2 mmol∙L-1的柠檬酸缓冲液移到150 mmol∙L-1PBS溶液中时,发现无膜的纳米粒一组樱红色迅速褪去,这意味着金纳米粒快速聚集,而大肠杆菌外膜囊泡载药系统在同样的条件下颜色没有变化,说明菌膜-纳米粒载药系统可以提高整个系统的稳定性。图4结果表明,裸金纳米粒和细菌外膜伪装的金纳米粒在2 mmol∙L-1柠檬酸盐缓冲液中都是稳定的(图4A、B),但在150 mmol∙L-1PBS中,裸金纳米粒迅速聚集(图4C),而细菌外膜伪装的金纳米粒保持稳定(图4D)[24]。

A—AnNPs in 2 mmol∙L-1 citrate storage buffer; B—BM-AnNPs in 2 mmol∙L-1 citrate storage buffer; C—AnNPs in 150 mmol∙L-1PBS; D—BM-AnNPs in 150 mmol∙L-1PBS
1.5 以血小板膜作为纳米制剂伪装的优势
将血小板膜包裹纳米颗粒,也能逃避巨噬细胞的吞噬[25]。同时,这种经血小板细胞膜伪装的纳米粒子还可利用血小板治疗细菌感染的自然属性,对人类血管损伤区域起到靶向作用[26],可以用于与受伤的动脉结合,并释放载药纳米粒,防止恶性肿瘤增生[27]。
Diana Dehaini等[10]还创造性地融合了红细胞膜和血小板膜发展成双膜包被纳米颗粒的过程。所得到的颗粒,称为RBC-血小板混合膜包覆纳米颗粒([RBC-P]NPs),这为创造具有各种杂化功能的生物相容的、定制的仿生纳米颗粒打开了大门,这些杂化功能可用于克服当前基于纳米颗粒的治疗和成像平台的限制。
1.6 以干细胞膜作为纳米制剂伪装的优势
骨髓间充质干细胞的免疫原性,可体现在体内参与免疫调节反应[12]。细胞间互相作用能够产生细胞因子,从而抑制T细胞的增殖来减少免疫反应,达到免疫重建的目的。科研人员认为这种免疫学特性在多种疾病尤其是血液病的治疗上有着广阔的应用前景。
Rajendiran J C B等[28]制备了干细胞膜伪装纳米粒子(SHNPs),通过流式细胞术、免疫荧光分析和Western印迹证实SHNPs上存在干细胞标记。通过体外实验结果进一步证实,SHNPs的杂交结构能够避免吞噬细胞吸收的快速清除,并成功地跨重建内皮细胞移位。此外,体内动物研究表明,与裸颗粒相比,干细胞仿生功能化显著提高了SHNPs的循环时间。有关各个细胞外膜作为纳米制剂伪装的优势见表1。
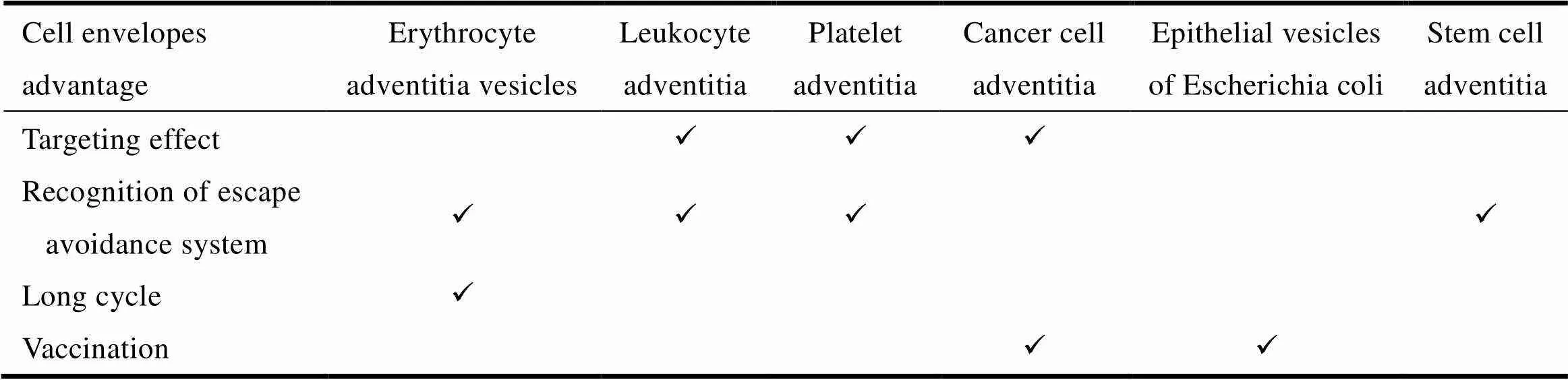
Table 1 Advantages of various types of extracellular membranes as camouflage for nano-preparations
2 纳米粒内核的选择
近年来,无机纳米粒子作为一种新型的药物传递系统用于疾病的治疗和诊断。纳米粒表面可以不断地调整适应从而带来更多的功能,可运载药物和基因,通过直接或者间接靶向机制,以提高药物对肿瘤组织的命中率[29]。另外,纳米粒自身的物理、化学特性也提供了额外的治疗功能[17]。
想要设计以纳米粒为基础的药物传递系统,需要考虑纳米粒的胶体稳定性和在血液中的循环时间。利用在肿瘤中血管上的渗漏和淋巴引流受损,长循环纳米粒可以通过增强渗透和保留效应来增加在肿瘤部位的累积时间。
2.1 高分子合成的纳米粒
最常用的高分子纳米粒是聚乳酸-羟基乙酸共聚物(PLGA)纳米粒,它是由乳酸和羟基乙酸两种单体聚合而成,是一种可被降解的高分子化合物[30]。PLGA纳米粒因其良好的生物相容性、没有毒性、优良的成囊和成膜性能等优势[31-32],被广泛应用于多种行业尤其是医药行业。PLGA已通过FDA认证,正式作为药用辅料被收录进《美国药典》。
2.2 磁性纳米粒
超顺磁性氧化铁纳米粒子(SPIO)已经在临床上有着很多应用[33]。Lai等[34]制备了一种新型的干细胞膜伪装超顺磁性氧化铁纳米粒子载药系统(STM-SPIO NPs),作为一种潜在的磁共振成像剂,STM-SPIO NPs具有良好的磁化强度和剂量。在交变磁场作用下,STM-SPIO NPs通过磁热机制成功诱导癌细胞死亡,这些结果无不意味着STM-SPIO NPs有很好的应用前景。
2.3 金属纳米粒
近年来,伴随着对纳米粒子研究的加深,金属纳米粒子如金纳米粒、银纳米粒也会广泛用于药学行业。使用含有钆的成像试剂可使黄金纳米粒子在核磁共振成像、光声成像和拉曼成像这3种成像方式可见[35],该技术可以分辨手术时残留的癌变组织,使肿瘤清除的更加彻底。
金纳米粒可以在靶向识别定位的基础上,再利用其自身光热转换效率高的特性,将外部光源的光能转化为热能来杀死癌细胞,医学上将这种方法称为光热治疗法[36],它能够减少治疗时间,也可减轻病人的痛苦。
2.4 巧妙结合纳米载体内核和细胞膜
在进行这类外膜伪装纳米载药系统的新型载体设计的时候,应该注意巧妙的结合细胞膜上天然的生物特征,以及纳米内核的载药特征,以达到更大的药物疗效。在设计药物载体的时候,先要了解患者的病情和需求,确定想要靶向的部位来选择细胞外膜“伪装外衣”,再根据药物的溶解性、剂量等因素来选择合适的纳米内核载体。同时需要考虑的问题是:选择的细胞外膜的粒径范围和膜内侧的带电性[37]。纳米内核的粒径要比细胞膜小10~50 nm,纳米内核的电性应该与膜内侧的电性相反,利用静电吸引来保证外层伪装细胞膜与内核纳米载药系统更好的组装。
3 细胞膜伪装纳米载药系统的合成方法
3.1 细胞膜的提取和收集
在进行红细胞膜、癌细胞膜、血小板膜收集时通常都会采取低渗处理法[38]。以红细胞膜为例来表述低渗法的具体操作步骤如下:从鼠眼眶中取全血,于800 g、4 ℃条件下离心5 min,弃去上清液,在10 mmol∙L-1PBS中洗涤后,置于2.5 mmol∙L-1PBS(冰浴)中低渗处理去除红细胞中的血红蛋白,再次在800 g、4 ℃条件下离心,弃去上层血红蛋白,保留底层红细胞囊泡。
而白细胞膜、干细胞膜在提取收集过程中采用了蔗糖密度梯度离心法[34]。以干细胞为例来表述蔗糖密度梯度离心法的具体操作法为:收集骨髓间充质干细胞(1×107个细胞),用PBS洗涤,再悬浮于冷的TM缓冲液(pH=7.4)中,在2.2×104r∙min-1下匀浆1 min,在质量分数5%蔗糖的条件下加入TM-缓冲液,以6 000 g离心15 min后,收集匀浆细胞,用0.15 mol∙L-1的蔗糖/TM-缓冲液(pH值7.4)冲洗2次即可得到。
也有部分细胞膜的制备比较特殊,细菌囊泡的制备需使用超速离心法。首先收集对数生长期的大肠埃希菌,在4 000 g的条件下离心10 min以去除细菌收集上清液,接着用0.45 μm滤去大分子,于1.5×104g的条件下超速离心2 h,来富集细菌外膜囊泡。
3.2 生物膜伪装纳米载药系统的制备
在制备细胞膜伪装的纳米载药系统[39-40]时,现阶段主要分为挤出法[41]和超声法两种。
以红细胞伪装纳米粒为例,挤出法具体做法是将红细胞膜和纳米粒内核混合物一起在纳米挤出仪中通过100 nm或200 nm的聚碳酸酯多孔膜多次,即得到了RBC-NPs系统。
程潜峰等[42]在用超声法制备红细胞负载的姜黄素纳米粒时,首先将制得的红细胞用生理盐水吹打,在1 300 W、37 kHz、50%功率的条件下超声5 min得到红细胞纳米小体,加入姜黄素丙酮溶液,再次超声5 min,获得红细胞负载的姜黄素纳米粒(Cur-RBC-NPs)。
4 细胞膜包载纳米粒的表征
由于细胞膜伪装的纳米载药系统结构复杂,目前还没有很成熟的表征方法,通常采用的是利用透射电镜(TEM)法[43-44]和动态光散射法(DLS)[45]测定生物膜载药系统粒径以及电位前后的变化,来确定生物膜与纳米粒是否包载成功。
Huiping Sun 等[20]采用自上而下的方法制备了癌细胞伪装的金纳米粒(CDAuNs),制得的粒径约为70.5 nm,对比单独金纳米粒粒径,癌细胞膜外层导致整个粒子的尺寸增加了10~20 nm。包衣的过程也使粒子的zeta电位发生了改变,约从-19.5 mV到-16.3 mV ,这与癌细胞外膜的zeta电位密切对应。
图5是65、120、200、340 nm粒径的纳米核被红细胞膜包衣的透射电镜(TEM)的成像[46]。这种成像方式也能很好的证明细胞膜已经作为纳米载药系统的外膜与之成为一个完整的载药系统。

Fig. 5 TEM of 65 nm,120 nm,200 nm and 340 nm nanoparticles with camouflage of erythrocyte membrane
5 展望
a. 细胞膜伪装的纳米药物传递系统作为一种新型的药物传递系统是一个前景广泛、值得探索的研究平台,现阶段的研究结果充分地证明了这类新型载体的优势及在药物传递上的开发潜力,但是还存在着一些有待深入研究的问题。
b. 就目前的文献报道,红细胞伪装纳米粒载药系统的研究较多,对于其他细胞,研究者还有很大的探索空间。比如,对于细菌外膜囊泡,目前研究多数限于大肠埃希菌的外膜囊泡研究,研究者可以尝试开发不同益生菌。
c. 细胞膜伪装的纳米药物传递系统中药物在靶向部位的释放机制、细胞膜在体内破裂时间等尚未明确。研究者在进行细胞膜伪装纳米载药系统制备的时候,一些利用包埋法载药的纳米粒可能会发生药物泄漏,造成药量的不准确。新型复合载体如何大量生产和规范定量还是一个有待研究的问题。
d. 此外,以往的研究中这类载药体系一般是在-80 ℃下冷冻保存,且储存时间不是很长,随着这类载体不断的更新和应用,希望可以发现更多的储存和运输方式,以便更好的临床应用。
[1]张元洪.细胞膜仿生微囊作为药物载体的基础研究[D]. 杭州: 浙江大学, 2014: 14-15.
[2] YOUSEFI N, WARGENAU A, TUFENKJI N. Toward more free-floating model cell membranes: Method development and application to their interaction with nanoparticles [J]. ACS Appl Mater Interfaces, 2016,8(23): 14339-14348.
[3] 陈莹, 平其能.口服载药纳米粒的研究进展[J]. 药学进展, 2004, 28(10): 451-455.
[4] 许冉达, 邵天宇, 李素梅, 等. 红细胞膜在肿瘤研究中的作用与地位[J]. 黑龙江医药, 2015, 28(6): 1192-1195.
[5] PATEL R P, PATEL M J, PATEL N A. An overview of resealed erythrocyte drug delivery[J]. Journal of Pharmacy Research, 2009, 2(6): 1008-1012.
[6] TAN S, WU T, ZHANG D, et al. Cell or cell membrane-based drug delivery systems[J].Theranostics, 2015, 5(8): 863-881.
[7] HU C M, FANG R H, ZHANG L. Erythrocyte-inspired delivery systems[J].AdvHealthc Mater, 2012, 1(5): 537-547.
[8] 顾晓彤, 李杨, 王栋, 等. 细胞膜修饰的纳米粒载药系统的研究进展[J]. 中国医药工业杂志, 2017, 48(1): 94-101.
[9] 孙雅楠, 马琳, 张彪, 等. 基于红细胞的载药系统研究进展[J. 中国药科大学学报, 2015, 46(4): 481-487.
[10] DEHAINI D, WEI X, FANG R H, et al. Erythrocyte-platelet hybrid membrane coating for enhanced nanoparticle functionalization[J]. Advanced Materials, 2017, 29(16): 1606209.
[11] FANG R H, HU C M, ZHANG L. Nanoparticles disguised as red blood cells to evade the immune system[J]. Expert OpinBiolTher, 2012, 12(4): 385-389.
[12] BIANCO P, CAO X, FRENETTE P S, et al. The meaning the sense and the significance: translating the science of mesenchymal stem cells into medicine[J]. Nature Medicine, 2013, 19(1): 35-42.
[13] GAO W, ZHANG L. Coating nanoparticles with cell membranes for targeted drug delivery [J]. J Drug Target, 2015, 23(7/8): 619-626.
[14] HAMIDI M, TAJERZADEH H. Carrier erythrocytes: an overview[J]. Drug Delivery, 2003, 10(1): 9-20.
[15] ANTONELLI A, SFARA C, WEBER O, et al. Characterization of ferucarbotran-loaded RBCs as long circulating magnetic contrast agents[J]. Nanomedicine, 2016, 11(21):2781-2795.
[16] OLDENBORG P A. Role of CD47 as a marker of self on red blood cells[J]. Science, 2000, 288(5473): 2051-2054.
[17] HU C M, FANG R H, LUK B T, et al. Polymeric nanotherapeutics: clinical development and advances in stealth functionalization strategies[J]. Nanoscale, 2014, 6(1):65-75.
[18] PARODI A, QUATTROCCHI N, VAN A D V, et al. Synthetic nanoparticles functionalized with biomimetic leukocyte membranes possess cell-like functions[J]. Nature Nanotechnology, 2013, 8(1): 61-68.
[19] RAO L, BU L L, CAI B, et al. Cancer cell membrane-coated upconversion nanoprobes for highly specific tumor imaging[J]. Advanced Materials, 2016, 28(18):3460-3466.
[20] SUN H, SU J, MENG Q, et al. Cancer cell membrane-coated gold nanocages with hyperthermia-triggered drug release and homotypic target inhibit growth and metastasis of breast cancer [J]. Advanced Functional Materials, 2017, 27(3): 1604300.
[21] FANG R H, HU C M, LUK B T, et al. Cancer cell membrane-coated nanoparticles for anticancer vaccination and drug delivery [J]. Nano Lett, 2014, 14(4): 2181-2188.
[22] JON S, BRIJMOHA V, KIM S H, et al. Bacterial outer membrane vesicles as drug delivery vehicles for cancer therapy[J].한국생물공학회학술대회, 2012, 4: 91-91.
[21] GUJRATI V, KIM S, KIM S H, et al. Bioengineered bacterial outer membrane vesicles as cell-specific drug-delivery vehicles for cancer therapy[J]. ACS Nano, 2014, 8(2): 1525-1537.
[23] ACEVEDO R, FERNANDEZ S, ZAYAS C, et al. Bacterial outer membrane vesicles and vaccine applications[J]. Front Immunol, 2014, 5:121.
[24] GAO W, FANG R H, THAMPHIWATANA S, et al. Modulating antibacterial immunity via bacterial membrane-coated nanoparticles[J]. Nano Lett, 2015, 15(2): 1403-1409.
[25] WEI X, GAO J, FANG R H, et al. Nanoparticles camouflaged in platelet membrane coating as an antibody decoy for the treatment of immune thrombocytopenia[J]. Biomaterials, 2016, 111:116-123.
[26] KIEFFER N, PHILLIPS D R. Platelet membrane glycoproteins: functions in cellular interactions [J]. Annual Review of Cell Biology, 1990, 6(1): 329-357.
[27] HU C M J, FANG R H, WANG K C, et al. Nanoparticle biointerfacing via platelet membrane cloaking [J]. Nature, 2015, 526: 118-121.
[28] BOSE R J C, JU K B, LEE S H, et al. Surface modification of polymeric nanoparticles with human adipose derived stem cell membranes AdMSCs; proceedings of the World Biomaterials Congress, F, 2016 [C].
[29] PETROS R A, DESIMONE J M. Strategies in the design of nanoparticles for therapeutic applications [J]. Nat Rev Drug Discov, 2010, 9(8): 615-627.
[30] 徐元龙. 5-氟尿嘧啶—PLGA纳米粒的制备及其药物动力学研究[D]. 南京: 南京工业大学, 2006: 19-20.
[31] 寇龙发, 高利芳, 姚情, 等. 乳化溶剂挥发法制备紫杉醇PLGA纳米粒及其体外评价[J].中国药剂学杂志:网络版, 2014, 12(2): 33-42.
[32] BOSE R J C, LEE S H, PRAK H. Fabrication of PLGA hybrid nanoparticles coated with reconstructed membrane of human-adipose derived mesenchymal stem cell; proceedings of the Global Controls in Stem Cells, F, 2014 [C].
[33] 张灵敏, 蔡继业. 磁性氧化铁纳米药物载体的研究进展[J]. 现代生物医学进展, 2011, 11(17): 3386-3389.
[34] LAI PY, HUANG RY, LIN SY, et al. Biomimetic stem cell membrane-camouflaged iron oxide nanoparticles for theranostic applications[J]. RSC Adv, 2015, 5(119): 98222-98230.
[35] 高友志, 王猛, 颜范勇, 等. 水凝胶/金属纳米粒子复合物的制备及其在催化反应中的应用[J].化学进展, 2014, 26(4): 626-637.
[36] ARYAL S, NGUYEN T D T, PITCHAIMANI A, et al. Membrane fusion-mediated gold nanoplating of red blood cell: A bioengineered CT-contrast agent[J]. ACS Biomaterials Science & Engineering, 2017, 3(1): 36-41.
[37] 程潜峰, 钱汉清, 张定虎, 等. 基于红细胞膜的纳米药物投递系统研究进展[J]. 中国药房, 2016, 27(16): 2279-2282.
[38] GAR N M, L PEZ R M, SANZ S, et al. Erythrocytes as carriers for recombinant human erythropoietin[J]. Pharmaceutical Research, 1996, 13(6): 869-874.
[39] FANG R H, JIANG Y, FANG J C, et al. Cell membrane-derived nanomaterials for biomedical applications[J]. Biomaterials, 2017, 128:69-83.
[40] ZHOU H, FAN Z, LEMONS P K, et al. A facile approach to functionalize cell membrane-coated nanoparticles[J]. Theranostics, 2016, 6(7): 1012-1022.
[41] 蒋宫平, 杨强, 邓意辉.脂质体制备方法的里程碑-挤出法[J].沈阳药科大学学报,2013, 30(8):646-652.
[42] 程潜峰, 钱汉清, 张定虎, 等.红细胞膜载药纳米粒子的制备及体外抗肿瘤作用评价[J]. 中国中药杂志, 2016, 41(11): 2093-2097.
[43] 肖仲斌, 张伯兰. 纳米材料透射电镜样品制备方法的探索[J]. 化工技术与开发, 2000(S1):27-39.
[44] 徐信兰, 胡晓颖, 卢乃弟.纳米乳液的透射电镜样品制备及图像分析[J]. 电子显微学报, 2002, 21(5): 786-787.
[45] 刘桂强, 杨冠玲, 何振江, 等. 动态光散射在颗粒检测中的应用[J]. 中国粉体技术, 2005, 11(z1): 76-80.
[46] DESAI N. Challenges in development of nanoparticle-based therapeutics[J]. AAPS J, 2012, 14(2): 282-295.
Research process of the nano drug delivery system based on cell membrane camouflaging
MA Zhiwei, LUO Fuyao, NING Baoru, CHEN Lijiang*
(,,110036,)
In recent years, with the continuous in-depth study of nano-drug delivery system, it has been found that nano-preparations are easy to be swallowed by macrophages of reticuloendothelial system, difficult to reach specific target sites, thus having great damages to liver and spleen. The emergence of a new type of composite carriers has greatly solved these problems. These carriers are formed by a combination of safe and friendly endogenous cell membranes and nano-drug delivery systems, which can have the common advantages of both carriers. By choosing different cell membrane such as erythrocyte membrane, cancer cell erythrocyte membrane and platelet erythrocyte membrane, it can also have the functions of evading the identification of immune system, targeting the tumor sites, and efficiently performing drug delivery. In this review, we summarized the types, advantages, preparation process and development of the outer cell membrane and the core of composite carriers, in order to promote the clinical application of the new type of composite carriers in drug delivery. Evading the identification of the immune system, targeting the tumor site, and efficiently performing drug delivery.
pharmaceutics; nano drug delivery system; summary; composite carrier; cell membrane
2019-01-28
马徵薇(1993-), 女(汉族), 辽宁沈阳人, 硕士研究生, E-mail 843038003@qq.com;
陈立江(1969-), 女(汉族), 山西太原人, 教授, 博士, 主要从事药物新剂型和新技术、计算机辅助药物设计及其与药物新剂型和新技术结合的相关新药研制与开发, Tel. 024-62202303, E- mailchlj16@163.com。
(2019)03–0058–11
10.14146/j.cnki.cjp.2019.03.004
R94
A
(本篇责任编辑:赵桂芝)
