三种方法气管灌注博来霉素诱导小鼠肺纤维化的比较
2019-06-05王志超冯凡超周贤梅
王志超,冯凡超,武 琦,顾 诚,徐 泳,周贤梅
(南京中医药大学附属医院,江苏省中医院呼吸科,南京 210029)
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是特发性间质性肺炎的最常见形式,是一种慢性的、进行性的、不可逆性的和致命性的肺部疾病,主要发生在中老年人(诊断中位年龄为66岁,范围为55~75岁),局限于肺部,具有典型间质性肺炎的病理学或放射学改变[1]。但目前IPF患者人数较少,且很难获得患者的肺组织样本,因此建立稳定可靠的动物模型对于研究IPF及其他肺纤维化疾病具有重要意义。
目前常用的肺纤维化模型主要是啮齿类动物,主要包括小鼠、大鼠、仓鼠和兔等[2-5],主要用于诱导肺纤维化的诱导剂包括博莱霉素(bleomycin,BLM)、胺碘酮、石棉、二氧化硅、呼吸道肠道病毒等,其中使用最广泛的是BLM[6]。BLM是轮生链霉菌中提取的一种抗肿瘤药物,肺纤维化是其主要毒副作用之一,用BLM制作的肺纤维化模型,其组织病理学和生理学改变与人类肺纤维化相似,因此成为肺纤维化的经典模型[7]。且最新研究表明,BLM多次给药比单次给药形成的肺纤维化模型更接近临床IPF患者,但目前应用仍较少[8]。常用的造模方式有经气管给药、气管灌注、雾化吸入、经鼻给药、腹腔注射、尾静脉注射等[9],又以经气管给药的运用最为广泛[10]。
我们在长期的IPF研究中,常常运用BLM气管内给药建立小鼠肺纤维化模型,造模的方法从最经典的气管切开造模法逐渐改良为腰穿针气管插管造模法和留置针气管插管造模法,但从未比较过这三种方法的优缺点。本次实验同时运用三种方法进行造模,以期提供一种最稳定可靠的BLM气管内给药的造模方法,供实验研究。
1 材料和方法
1.1 实验动物
SPF级雄性C57BL/6J小鼠,25~27 g,10周龄,购于北京唯尚立拓科技有限公司[SCXK(京)2016-0009]。动物实验均在南京中医药大学实验动物中心[SYXK(苏)2018-0049]完成。动物实验经由实验动物管理委员会批准(伦理审批号:201810A031),所有操作均符合动物伦理学要求,并按实验动物使用的3R原则给予人道的关怀。
1.2 主要试剂与仪器
注射用盐酸博莱霉素(BLM,海正辉瑞),多聚甲醛(Macklin),磷酸缓冲盐溶液(PBS,Gibco),羟脯氨酸ELISA试剂盒(上海西唐),75%酒精,液氮,一次性1 mL注射器,滤纸,棉球。7号腰穿针,一次性留置针(见图1),眼科剪,眼科镊,手术刀柄,手术刀片,缝合针,缝合线,小型手电筒,移液器,多功能酶标仪(Infinite 200 pro,Tecan)。

图1 腰穿针和留置针Figure 1 Lumbar spinal needle and indwelling needle
1.3 实验方法
将120只C57BL/6 J小鼠随机分为4组,分别为空白组、腰穿针气管插管模型组、留置针气管插管模型组和气管切开模型组,每组30只;每组又随机分为3组,分别为14 d组,21 d组和28 d组,每组10只;空白组常规饲养,腰穿针气管插管模型组利用腰穿针气管插管造模法气管插管注射BLM,留置针气管插管模型组利用留置针气管插管造模法气管插管注射BLM,气管切开模型组利用气管切开造模法注射BLM。观察小鼠的一般情况(体重变化和存活率),并分别于造模后14 d、21 d、28 d处死小鼠,每次5~6只,取左右肺各一叶置于多聚甲醛中固定,其余肺组织置于液氮中速冻,-80℃保存;观察组织病理学改变(HE染色和Masson染色),并检测羟脯氨酸水平。

表1 肺组织肺泡炎及肺纤维化程度判定标准
1.3.1 腰穿针/留置针气管插管造模法
小鼠麻醉后将其固定,腹部朝上,头部稍抬高与水平面约成15°角,用眼科镊将小鼠舌尖夹住向外向上拉出,并用小型手电筒垂直照射小鼠颈部,通过小鼠口腔观察小鼠咽喉部,可以在红色光亮处观察到声门开合;a)将磨钝的腰穿针针头紧贴舌根中央,向光亮处缓缓进针,进针深度约2.8 cm,若进针有明显阻力,应调整位置和角度重新进针,切勿强行进针导致气道损伤或穿孔;b)将留置针穿刺针尖头退至软导管中,确保针头柔软而针体坚硬,将留置针紧贴舌根中央,向光亮处缓缓进针,留置针长约2.1 cm,可全部插入气管,若进针有明显阻力,应调整位置和角度重新进针,切勿强行进针;向腰穿针/留置针中注入BLM(5 U/kg),并注入1 mL空气以助BLM在肺部分散;将小鼠直立左右前后轻轻摇晃,以助BLM在肺部均匀分布,避免液体堵塞气道致小鼠窒息死亡(见图2)。
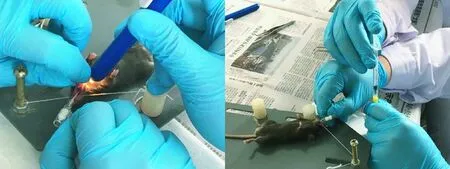
图2 留置针气管插管造模法操作示意图Figure 2 Schematic diagrams of tracheal intubation by an indwelling needle
1.3.2 气管切开造模法
麻醉并固定小鼠(方法同1.3.1),修剪颈部鼠毛,乙醇消毒,切开颈部皮肤和肌肉,切口长约5 mm,并延甲状腺中央轻轻切开,分离甲状腺,钝性分离气管周围组织粘膜,暴露气管;用留置针从甲状软骨刺入气管中,抽出穿刺针,注入BLM(5 U/kg),将小鼠直立左右前后轻轻摇晃,以助BLM在肺部均匀分布,避免液体堵塞气道致小鼠窒息死亡,缝合肌肉皮肤,酒精消毒手术切口及周围皮肤。
1.3.3 肺组织肺泡炎及肺纤维化程度判定标准
按Szapiel等[11]的方法评价肺组织病理变化严重程度(见表1)。
1.4 统计学方法
2 结果
2.1 一般情况
2.1.1 体重变化
除空白组,三组模型组小鼠在造模后第0~6天,体重均有明显下降,其中气管切开模型组体重下降最明显;造模后大约在第10~12天,三组模型组小鼠再次出现体重下降,持续约2~4 d;造模后大约在第20~22天,三组模型组小鼠第三次出现体重下降,持续约2~4 d;其余时间各组小鼠体重均缓慢增长;通过独立样本t检验,发现除空白组和留置针气管插管模型组间外,其余各组间小鼠第28天体重均具有统计学差异(见图3)。

注:B:空白组;L:腰穿针气管插管模型组;I:留置针气管插管模型组;T:气管切开模型组。ns:差异无显著性;*P< 0.05,**P< 0.01,***P< 0.001。图3 四组小鼠造模后体重变化曲线Note. B, Blank group. L, Lumbar spinal needle group. I, Indwelling needle group. T, Tracheotomy group. ns: non-significance;*P< 0.05,**P< 0.01,***P< 0.001.Figure 3 Weight change curve of the four groups of mice after modeling
2.1.2 存活率
留置针气管插管模型组小鼠存活率最高,为90%;腰穿针气管插管模型组小鼠存活率其次,为80%;气管切开模型组小鼠存活率最低,仅为60%;Fisher精确检验显示,空白组与腰穿针气管插管模型组、留置针气管插管模型组比较,无显著性差异(P=0.237、P=0.500),与气管切开模型组分别比较,有显著性差异(P=0.043);腰穿针气管插管模型组与留置针气管插管模型组比较,无显著性差异(P>0.999);气管切开模型组与腰穿针气管插管模型组比较,无显著性差异(P=0.628);气管切开模型组与留置针气管插管模型组比较,无显著性差异(P=0.303)(见图4)。
2.2 组织病理学
通过HE染色和Masson染色我们可以发现,空白组:肺泡形态正常,肺泡壁纤细,肺间质无炎症细胞浸润;腰穿针气管插管模型组:肺泡炎及肺纤维化程度++~+++,肺组织中有较多的片状实变区,实变区间见肺泡壁增厚,间隔增宽,有较多的炎症细胞浸润和胶原沉积,第21天最明显,左右肺分布欠均匀;留置针气管插管模型组:肺泡炎及肺纤维化程度+~++,小片肺组织实变,其中有炎症细胞浸润和少量胶原沉积,第21天较明显,左右肺分布欠均匀;气管切开模型组:肺泡炎及肺纤维化程度++~+++,可见大片的肺实变,大量炎细胞浸润会和胶原沉积,第21天最明显,左右肺分布较均匀(见表2、图5、6)。
2.3 羟脯氨酸
通过羟脯氨酸ELISA试剂盒检测肺组织羟脯氨酸水平以及独立样本t检验,我们发现在第21天,三组模型组羟脯氨酸含量显著高于空白组(P<0.001、P<0.05、P<0.001),在第28天,腰穿针气管插管模型组和气管切开模型组羟脯氨酸含量显著高于空白组(P<0.01、P<0.001),而留置针气管插管模型组与空白组相比无显著性差异(见图7)。
3 讨论
BLM临床用于治疗多种肿瘤疾病,主要的不良反应是诱发严重的肺纤维化[7],其诱导的肺纤维化模型与人类肺纤维化相似,广泛运用于肺纤维化的基础研究。1974年,Adamson等[12]首次采用多次腹腔注射BLM的方法建立了鼠肺纤维化模型,此后发现对多种动物采用多种方式使用BLM均可建立肺纤维化模型,并探索了BLM的最佳造模剂量[7, 13]。虽然BLM诱导的肺纤维化模型有助于理解和研究肺纤维化的发病机制,但在研究IPF时有其局限性,比如对于IPF疾病起源的上皮细胞影响较小,造模21 d后肺纤维化逐渐缓解等。有研究表明BLM多次给药比单次给药诱导的小鼠肺纤维化模型更接近IPF患者,造模方式更接近IPF肺泡持续微损伤和修复的发病机制[8]。但由于成模时间长,小鼠存活率低,仅少数研究采用这种造模方式[14-16],多数研究仍采用单次给药的经典模型[17-19]。

注:B:空白组;L:腰穿针气管插管模型组;I:留置针气管插管模型组;T:气管切开模型组。图4 四组小鼠造模后存活率Note. B, Blank group. L, Lumbar spinal needle group. I, Indwelling needle group. T, Tracheotomy group.Figure 4 Survival rate of the four groups of mice after modeling
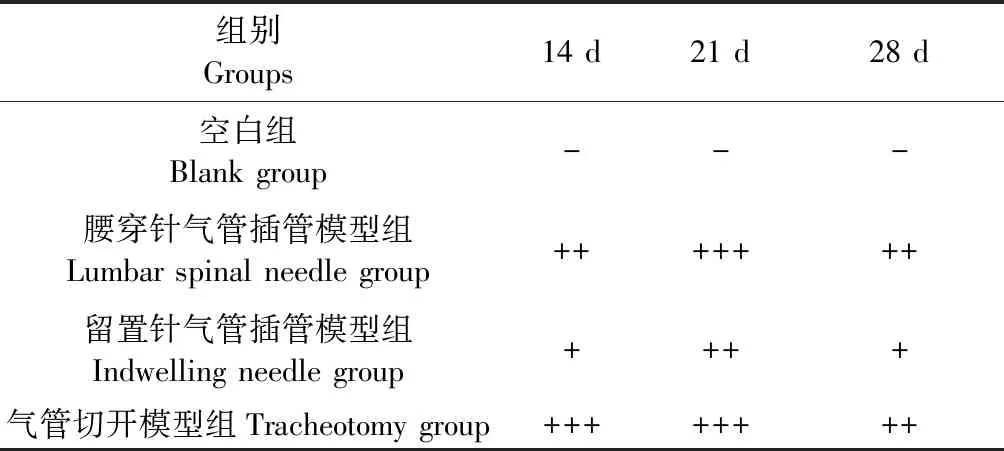
表2 肺组织肺泡炎及肺纤维化程度
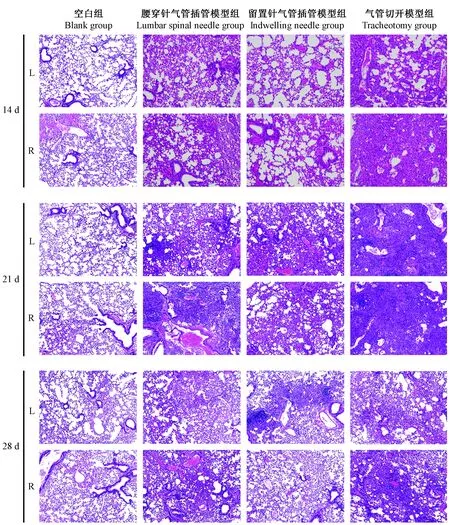
注:L:左肺;R:右肺。图6同。图5 造模后14 d、21 d和28 d肺组织HE染色(× 100)Note. L, Left lung; R, Right lung. The same in the figure 6.Figure 5 Lung tissue at 14, 21 and 28 days after modeling. HE staining

图6 造模后21 d肺组织的病理改变(Masson染色,× 200)Figure 6 Histology of the lung tissues at 21 days after modeling. Masson staining

注:B:空白组(n=6);L:腰穿针气管插管模型组(n=6);I:留置针气管插管模型组(n=6);T:气管切开模型组(n=5)。ns:差异无显著性;*P< 0.05,**P< 0.01,***P< 0.001。图7 肺组织羟脯氨酸水平Note. B, Blank group (n=6). L, Lumbar spinal needle group (n=6). I, Indwelling needle group (n=6). T, Tracheotomy group (n=5).ns: non-significance;*P< 0.05,**P< 0.01,***P< 0.001.Figure 7 Levels of hydroxyproline in the lung tissues
目前,国内外较为公认的方法是经气管给药,但对操作者技术要求较高,其他给药方法主要有气管灌注、雾化吸入[20]、经鼻给药[21]、腹腔注射[22]和尾静脉注射[23-24]。气管灌注具有动物存活率高、成模时间短、成功率高等优点,但对技术要求较高;雾化吸入可使药物在体内均匀分布,但需要特殊装置,且吸入剂量不可控,使用较少;经鼻给药所需麻醉时间短,操作快捷,对动物损伤小,但对技术熟练度要求非常高;腹腔注射可以避免因操作差异性造成的纤维化程度差异性,且操作简单,动物存活率高,病灶分布较均匀,但给药次数较多、剂量较大、成模时间较长,成本较高,因此具有一定限制性;尾静脉注射主要应用于小鼠模型,其成模时间短,但操作难度较大,成功率不高[10]。
本课题组在IPF的基础研究中尝试过多种方法制作BLM小鼠肺纤维化模型,最常用的是经气管给药法和气管灌注法。本实验系统比较了经气管给药法(气管切开造模法)和两种气管灌注法(腰穿针气管插管造模法和留置针气管插管造模法)。除了病理组织学检测,我们还检测了肺组织羟脯氨酸水平,羟脯氨酸在胶原组织中占13.4%,在弹性蛋白中含量极低,而在其他蛋白中均不存在,因此羟脯氨酸水平常用来反映胶原沉积水平,也是反映肺纤维化程度的一个较为客观的指标[25]。实验结果可见,气管切开造模法获得的小鼠肺纤维化模型肺泡炎和肺纤维化程度最高,病灶分布最均匀;腰穿针气管插管造模法获得的小鼠肺纤维化模型肺泡炎和肺纤维化程度较高,病灶分布不及气管切开造模法均匀,以气管周围为主;留置针气管插管造模法获得的小鼠肺纤维化模型肺泡炎和肺纤维化程度最低,病灶分布不均匀,以气管周围为主;各组小鼠存活率存在差异,除空白组外,气管切开模型组最低,留置针气管插管模型组最高,空白组和气管切开模型间有统计学差异,其余各组间没有统计学意义。综合各种因素,腰穿针气管插管造模法是三种造模方法中最稳定可靠的造模方法。
我们还通过实验结果得到以下观点:①模型组小鼠体重三次下降的原因可能分别是造模操作后损伤、肺泡炎基本形成和肺纤维化基本形成,因此造模后第22~24天可能是肺纤维化最严重的时期,之后会逐渐缓解;②腰穿针气管插管造模法和留置针气管插管造模法小鼠存活率均较高,但对于不熟练的操作者,存活率约为70%;又由于留置针针体柔软且长度较短,对小鼠的损伤低于腰穿针,故留置针气管插管造模法小鼠存活率略高于腰穿针气管插管造模法;③腰穿针气管插管造模法与留置针气管插管造模法原理和操作基本相同,但腰穿针气管插管造模法优势明显,可能是由于腰穿针针体坚硬且长度较长,有利于BLM在气管深处的灌注及在肺部的分散,而留置针针体柔软且长度较短,可能会被小鼠咽喉压迫而堵塞,导致BLM不能充分注入气管和肺部;④造模后小鼠死亡主要集中在第5~8天和第13~16天两个阶段,第16天后没有再出现小鼠死亡,第一阶段可能主要由造模的操作损伤所致,第二阶段可能主要由重度的肺泡炎所致;⑤部分空白组小鼠也表现出轻微的肺纤维化,可能是由于动物饲养中使用的垫料存在粉尘,粉尘吸入亦是造成肺纤维化的原因之一,因此在动物饲养中应避免使用木屑和刨花,应使用粉尘较少的玉米棒芯。
在长期实验过程中,我们还总结了以下经验:①腰穿针气管插管造模法中,腰穿针进针深度(针头至小鼠牙齿的距离)过短易引起药液回流,过长易戳穿气管,根据经验,约2.8 cm最为合适;②留置针气管插管造模法中,由于留置针不具有通气作用,气管插管后操作应迅速,避免窒息风险;③气管切开造模法中,切口不宜过长,缝合打结应不留线头,避免小鼠撕咬导致缝合线断裂,造模后一周内小鼠难以抬头进食,应在笼中添加饲料;④注射BLM时,应当严格按照小鼠体重抽取准确剂量的BLM,药液偏少易致小鼠肺纤维化程度偏低,偏多易致小鼠死亡,最大注射体积不得超过65 μL(26 g小鼠标准剂量),应用药液润洗插管器械、注射器等减少误差。
综上,腰穿针气管插管造模法、留置针气管插管造模法和气管切开造模法各有利弊,综合各种因素,腰穿针气管插管造模法是最理想的造模方法。
