犬体内唾液酸受体的组织分布及对H3N2亚型犬流感病毒的易感性研究
2019-06-05秦海斌强京宁宋珍华贺星亮包喜军宋庆平
秦海斌,强京宁,宋珍华,贺星亮,温 海,朱 骞,包喜军,宋庆平
(公安部南京警犬研究所,警犬技术公安部重点实验室,南京 210012)
唾液酸受体是人源性和禽源性流感病毒传播的分子基础[1],唾液酸受体主要有两种:唾液酸α2,3-半乳糖(SAα2,3Gal) 和唾液酸α2,6-半乳糖(SAα2,6Gal);人流感病毒主要识别末端为α2,6Gal的糖链受体,其主要存在于人类的上呼吸道;而禽流感病毒主要识别末端为α2,3Gal的糖链受体,其广泛存在于人类的下呼吸道及禽类的胃肠道[2]。A型流感病毒要跨越种属特异性,首先需要在受体结合特异性上发生改变,使其所识别的受体糖链连接形式(α2,3 或α2,6)与动物体内唾液酸残基的类型相吻合,因此,禽类和哺乳动物在流感病毒受体的类型和分布上的差异,被认为是A型流感病毒跨种属传递的主要障碍,动物唾液酸受体也成为研究流感病毒感染机制、变异机制、跨种属传播机制的重要途径。
关于犬类的流感病毒感染状况的研究表明,世界范围内可感染犬的流感病毒的种类正在不断增多,已有禽源H3N2、H5N1、H5N2、H9N2、H3N2重组的H3N1亚型、马源H3N8亚型、季节性H3N2亚型人流感和2009年甲型人流感等[3-4]自然感染犬类,表明犬对禽源、人源、马源流感病毒的具有天然易感性,犬有可能成为另一种“流感病毒基因混合器”;另一方面,犬作为伴侣动物与人、禽类及其他哺乳动物的生活环境高度重合,犬流感的公共卫生问题更需密切关注。另外,从病毒变异的角度来看,H3N2亚型犬流感病毒也是禽源H3N2流感病毒跨种属传播的结果,其内在机制与犬体内的流感病毒受体的类型存在关联。
目前虽然包括人、禽类、哺乳动物等多个物种体内的流感病毒受体的种类和分布得到了鉴定[5-7],但犬的唾液酸受体类型和分布特征的研究较少,犬类易感多种亚型A型流感病毒、易发生跨物种传播现象的分子机制尚不明确。基于上述科学问题,本文对犬体内的流感病毒受体类型组织分布和差异性进行了研究,同时结合人工感染H3N2亚型流感病毒,对比分析了受体分布与病毒定殖分布的差异,旨在探索分析犬能够感染多种亚型的A型流感病毒的分子基础,并为进一步建立犬流感病毒感染模型奠定基础。
1 材料和方法
1.1 实验材料
1.1.1 毒株
CIV地方毒株A/canine/Nanjing/11/2012(H3N2)由南京农业大学动物医学院刘永杰教授惠赠。
1.1.2 实验动物
实验用犬为普通级,英国史宾格犬,4月龄,体重8~9 kg,雄性4头,雌性2头,由公安部南京警犬研究所实验动物中心生产提供[SCXK (苏) 2018-0010]。BALB/c小鼠10只,清洁级,雌性,8周龄,18~20 g,购自扬州大学比较医学中心[SCXK (苏) 2017-0007]。实验操作在公安部南京警犬研究所实验动物中心完成[SYXK (苏) 2018-0036]。该实验研究经由公安部南京警犬研究所实验动物伦理委员会批准(IACUC号:NJJQYJS 2018-001),并遵照动物实验3R原则在饲养和实验过程中给予了恰当的人道关怀。
1.2 主要试剂与仪器
生物素-链霉亲和素封闭试剂盒、生物素标记的 MAA(MAA I与MAA II)、 FITC标记的SNA均购自美国Vector公司;DyLight 594标记的链霉亲和素购自美国Thermo Scientific公司;细胞核染色剂(4,6-diamidino-2-phenylindole,DAPI)购自美国Sigma公司,其他免疫组化常规试剂均为国产分析纯。抗CIV鼠源多克隆抗体由警犬技术公安部重点实验室制备。组织切片机Leica RM2145、展片机HI1210、烤片机HI1220均购自德国Leica公司,隔水式恒温孵育箱GNP-9080购自上海精宏实验设备有限公司,病理石蜡包埋仪(Micronm EC350)购自美国Thermo Scientific公司,全自动染色仪、激光共聚焦荧光纤维扫描系统(TCS SP5)购自德国Leica公司。
1.3 实验方法
1.3.1 实验犬人工感染H3N2亚型犬流感病毒
将病毒用无菌PBS稀释后,接种9日龄SPF鸡胚复壮,测定HA效价,选取效价大于28的尿囊液,经离心去沉淀,0.45 μm滤膜过滤后备用。史宾格犬共6头,分2组,3头作为实验组,3头作为对照组。实验组取1 mL病毒尿囊液经鼻腔、口咽部感染,对照组以PBS溶液进行对照感染。观察、记录犬的健康状况。
1.3.2 组织的采集与处理
由实验组中选择症状明显的犬,麻醉后实施安乐死,采集体内各个组织器官的组织样本,包括鼻甲、喉头、气管、支气管、肺等呼吸系统组织;食管、胃、十二指肠、空肠、回肠、结肠、盲肠、直肠消化系统组织;心、肝、脾、肾、胰、胸腺、扁桃体、肠系膜淋巴结、大脑、小脑、嗅球、睾丸、骨骼肌等其他组织。对照组按照前述方法采样。样本以4%的多聚甲醛固定,4℃保存备用。
1.3.3 鼠源CIV多克隆抗体制备
选取效价为28的尿囊液,福尔马林结合热灭活后进行病毒纯化(梯度离心法),纯化病毒分装保存于-70℃冰箱。选择6周龄雌性BALB/c小鼠,以弗氏佐剂乳化,背部皮下多点注射200 μL(100 μg病毒),三次免疫后,断尾采集血样,检测血清HI抗体效价,效价合格后取将全部小鼠处死,采集血清作为多克隆抗体。
1.3.4 组织切片的制备
石蜡包埋、组织切片、脱蜡水化、抗原修复均按照常规方法操作,切片厚度为4~7 μm。
1.3.5 免疫组织化学检测
感染组的样本切片进行免疫组织化学染色,方法如下:以0.01 mol/L PBS溶液配制的5% BSA封闭30 min,从边缘吸去封闭液,滴加稀释的抗体溶液(稀释比例:1∶50;稀释液为用PBS配制的5% BSA),空白对照组以PBS(0.01 mol/L,pH 7.4)替代抗体湿盒中4℃冰箱孵育过夜。第2天滴加二抗,室温孵育30 min。PBS洗5 min×5次。DAB显色3~5 min,显微镜下掌握显色程度,见黄褐色斑,加入双蒸水终止显色,苏木素复染3 min,自来水冲洗30 s,盐酸酒精分化5 s,自来水冲洗15 min,梯度酒精脱水:75%、85%、95%、100% I、100% II各5 min,二甲苯透明,中性树胶封片。放入60℃烘箱中烤干,显微镜下观察。
1.3.6 凝集素免疫荧光组织染色
健康犬的组织样本的切片进行凝集素免疫荧光组织染色[8],方法如下:切片按照生物素-链霉亲和素封闭试剂盒说明书进行封闭,先滴加稀释的生物素标记MAA1、MAA2抗体溶液过夜;第2天将湿盒从冰箱拿出,室温放置15 min复温,加入FITC标记SNA室温孵育2 h,PBS(0.01 mol/L,pH 7.4),洗5 min×5次;吸去多余的PBS,滴加DyLight 594标记的链霉亲和素二抗,室温避光孵育30 min,PBS洗5 min×5次,用滤纸擦去标本外的PBS;滴加DAPI 避光孵育2 min,可对标本进行显核,蓝色荧光,用PBS 1 min×3次洗去DAPI,用滤纸擦去标本外的PBS;最后用含甘油封片,并在Leica TCS SP5激光共聚焦显微镜下观察拍照(× 200)。
1.4 统计方法
按照组织系统分别对相应的切片进行定性描述;利用Image Pro Plus 6.0荧光分析软件对凝集素免疫荧光组织染色结果进行相对定量分析。文中唾液酸受体的表达量采用相对强度表示,分为不同的等级:阴 性(-);1%~20%的细胞呈阳性(+);21%~50%细胞呈阳性(++);51%~80%细胞呈阳性(+++);81%~100%细胞呈阳性(++++)。
2 结果
2.1 实验犬人工感染H3N2亚型犬流感病毒
犬流感病毒感染的典型症状包括:鼻流清涕、喷嚏咳嗽、体温升高、精神沉郁、恶寒战栗、食欲下降等,有的病犬流泪,眼结膜潮红并有轻度肿胀,不同个体的症状不同,通常表现出上述症状中的一种或数种。实验组在感染后第5天均表现出了鼻流清涕、喷嚏、体温升高、精神沉郁、食欲下降的症状,经荧光定量PCR检测感染后6 d的鼻拭子为阳性,说明人工感染成功。在感染后第7天进行了组织样本的采集。对照组在接种PBS后2 周内均未观察到可见的临床症状,经荧光定量PCR检测为阴性,在第15天采集组织样本。
2.2 呼吸系统中唾液酸受体的分布
经过凝集素免疫荧光组织染色后,SAα-2,3Gal受体被标记为红色,SAα-2,6Gal被标记为绿色,蓝色为DAPI着染细胞核后的显色。
呼吸系统中各受体标记染色后的图片见(图1),结果显示:SAα-2,3Gal、SAα-2,6Gal两种受体在呼吸系统各器官中均有表达,受体数量等级差别很大,具体表现为:SAα-2,6Gal受体在气管、支气管、肺泡上皮中高表达(50%以上),在鼻甲黏膜、喉头上皮中表达量中等(20%~50%);SAα-2,3Gal受体在鼻甲、支气管、肺泡、喉头粘膜上皮中高表达,在气管表达量低(20%以下)。组织特异性方面,SAα-2,6Gal受体主要分布在黏膜上皮、基底细胞层、皮下结缔组织等部位;SAα-2,3Gal受体主要分布在各组织器官表面的黏膜上皮。
2.3 消化系统中唾液酸受体的分布
消化系统中各受体标记染色后的图片见(图2),结果显示:SAα-2,6Gal受体在食管黏膜、肝、胃、空肠、回肠、结肠、盲肠中高表达,在咽部上皮表达量中等,在十二指肠低表达:SAα-2,3Gal受体在食管、肝、结肠、盲肠中高表达,在空肠、胃黏膜表达量中等,在咽部、十二指肠、回肠表达量低。肝中两种受体主要分布在肝血窦及静脉血管的内皮细胞中,而肝板细胞中两种受体均不存在;胰腺中两种受体几乎不表达;肠道中受体主要分布在肠绒毛固有层、消化腺上皮细胞。
2.4 其他系统中唾液酸受体的分布
其他组织器官中,两种受体的分布也存在差异,见(图3),结果显示:SAα-2,6Gal受体在扁桃体、脾、肠系膜淋巴结、心脏、肾、骨骼肌中高表达,在大脑、小脑、嗅球中表达量中等;SAα-2,3Gal受体在脾、睾丸、骨骼肌中高表达,在心脏、肾、大脑、小脑、嗅球中的表达量中等,在扁桃体、肠系膜淋巴结中低表达。其中的脾、心脏、肾、睾丸、大脑、小脑、嗅球、骨骼肌中均能同时表达两种受体,而在扁桃体、肠系膜淋巴结中主要以SAα-2,6Gal受体为主。胸腺中两种受体表达量极低。心肌内血管上皮细胞中可见两种受体的大量分布;肾中两种受体主要分布于肾小体、肾小管;睾丸中SAα-2,6Gal受体主要分布于曲精小管内膜,SAα-2,3Gal受体主要分布于睾丸间质及其中的毛细血管上皮中;大脑、小脑中两种受体主要分布于颗粒细胞层;嗅球中几乎不表达两种受体;骨骼肌中两种受体均有表达,主要分布于肌纤维束外膜、肌膜中。
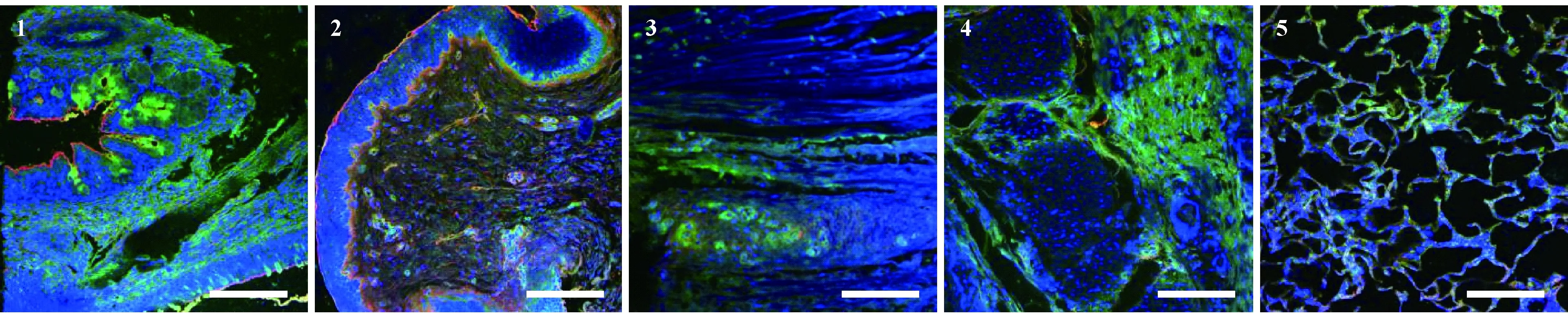
注:1:鼻甲骨;2:喉头;3:气管;4:支气管;5:肺泡。标尺=500 μm。图1 呼吸系统各组织中SAα-2,6Gal受体(绿色)和SAα-2,3Gal受体(红色)的分布(× 200)Note. 1, Turbinate; 2, Throat; 3, Trachea; 4, Bronchus; 5, Alveolar tissue. Bars=500 μm.Figure 1 The presence of SAα-2,6Gal (green) and SAα-2,3Gal (red) receptors in the tissues of the respiratory system

注:1:咽; 2:食道; 3:肝;4:胰腺; 5:胃; 6:十二指肠; 7:空肠;8:回肠; 9:盲肠;10:结肠。标尺=500 μm。图2 消化系统各组织中SAα-2,6Gal受体和SAα-2,3Gal受体的分布(× 200)Note. 1, Pharynx; 2, Esophagus; 3, Liver; 4, Pancreas; 5, Stomach; 6, Duodenum; 7, Jejunum; 8, Ileum; 9, Caecum; 10, Colon. Bars=500 μm.Figure 2 The presence of SAα-2,6Gal and SAα-2,3Gal receptors in the tissues of the alimentary system
2.5 唾液酸受体的组织特异性及荧光强度
犬体内各组织器官中2种类型唾液酸受体的相对荧光强度结果见表1。

注:1:扁桃体; 2:胸腺; 3:肠系膜淋巴结;4:脾; 5:心脏; 6:肾; 7:睾丸;8:大脑; 9:小脑;10:嗅球;11:肌肉。标尺=500 μm。图3 其他器官中SAα-2,6Gal受体和SAα-2,3Gal受体的分布(× 200)Note. 1, Tonsil; 2, Thymus; 3, Mesenteric lymph nodes; 4, Spleen; 5, Heart; 6, Kidney; 7, Testicle; 8, Cerebrum; 9, Cerebellum; 10, Bulbus olfactorius; 11, Skeletal muscle. Bars=500 μm.Figure 3 The presence of SAα-2,6Gal and SAα-2,3Gal receptors in other organs
2.6 鼠源CIV多克隆抗体制备
纯化后的CIV病毒浓度为0.93 mg/mL,多克隆抗体经HA/HI方法检测,其HI效价为212。
2.7 各系统中流感病毒的分布
实验用史宾格犬人工感染H3N2亚型犬流感病毒后,病毒在组织器官内的分布的免疫组织化学切片结果见图4。呼吸系统中,病毒的分布主要集中在上呼吸道,其中鼻甲、喉头黏膜中病毒量最大,下呼吸道中气管和支气管中有病毒分布,病毒量中等,肺中未见病毒。消化系统中:咽部粘膜中有少量病毒存在;食管粘膜未见病毒;胰腺中有少量病毒,主要分布在少量的血管内皮上;肝中有中等量病毒存在,分布于肝索细胞上;胃粘、十二指肠、回肠、结肠、盲肠黏膜上皮尤其是消化腺上皮细胞中可见大量的病毒存在,但在空肠中未见病毒。其他系统中:扁桃体的淋巴小结、弥散淋巴组织间隙的微静脉中可见有大量病毒分布于上皮细胞;胸腺中无病毒;脾中病毒大量存在,在红髓区及白髓区可见病毒弥散性分布,红髓区病毒分布较为致密;肠系膜淋巴结的皮质淋巴窦中有大量病毒;心肌细胞中无病毒存在;肾是全身器官中病毒分布量最大的器官之一,病毒几乎全部分布在肾小管上皮细胞中,在肾小体中未发现病毒存在;睾丸中未见病毒;大脑、小脑、嗅球中有微量病毒均匀散在分布;骨骼肌中有微量病毒存在,在肌纤维中未发现病毒;卵巢中有大量病毒存在,分布均匀。
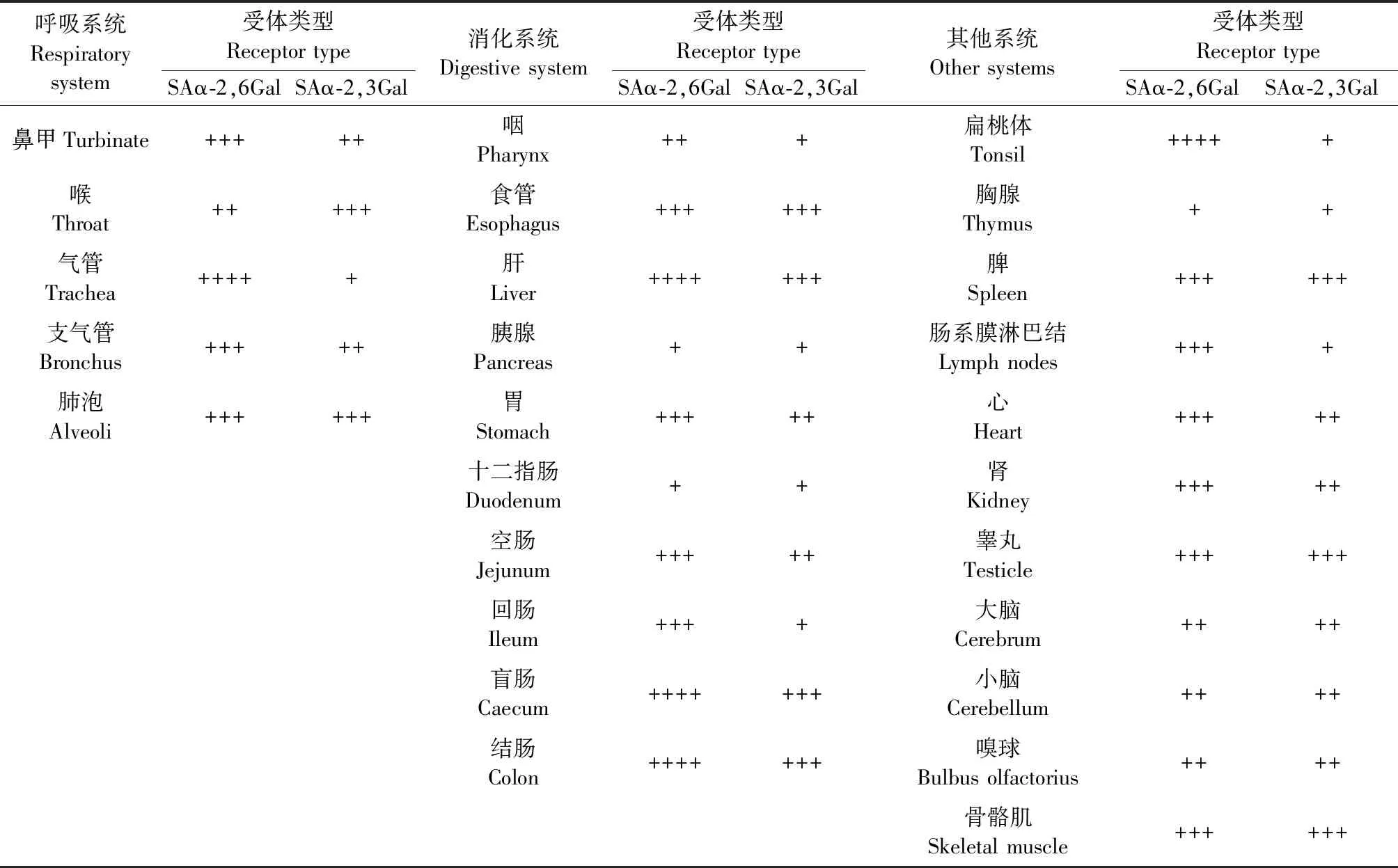
表1 犬体内各组织器官中唾液酸受体的分布强度
注:-:阴性;+:1%~20%的细胞呈阳性;++:21%~50%细胞呈阳性;+++:51%~80%细胞呈阳性;++++:81%~100%细胞呈阳性。
Note. -: Negative; +: 1%-20% positive; ++: 21%-50% positive; +++: 51%-80% positive; ++++: 81%-100% positive.
3 讨论
流感病毒受体研究方法中,国际上应用较多的是凝集素免疫荧光染色技术,其中接骨木凝集素(Sambucusnigraagglutinin,SNA)能够与SAα2,6Gal特异性结合,而山槐凝集素(Maackiaamurensisagglutinin,MAA)则能够与SAα2,3Gal特异性结合[9]。本文中凝集素免疫荧光染色实验的结果证实:SAα-2,3Gal、SAα-2,6Gal两种流感病毒受体广泛分布于史宾格犬大多数组织器官,尤其在呼吸系统、消化系统、泌尿生殖系统中均有分布;从两种受体的表达量来看,SAα-2,6Gal在多数器官中均有丰富的表达,其分布的广泛性、在同一器官内的表达量上均高于SAα-2,3Gal型受体。这种分布特征有别于禽类相关研究结果,而与哺乳类动物的受体特征更加接近[10-12],说明对犬而言人型流感病毒较禽型流感病毒感染具有更广泛的分子基础。
人工感染实验证实病毒在鼻甲、鼻中隔、胃、十二指肠、结肠、盲肠、扁桃体、脾、肠系膜淋巴结、肾、卵巢中病毒分布量最大;下呼吸道的气管、支气管病毒量次之。相对而言,消化系统是本文中病毒分布最广泛、病毒分布量最大的系统,说明犬流感病毒H3N2亚型南京地方流行株的增殖主要部位为消化系统。目前普遍认为禽流感病毒强毒株主要存在于呼吸系统,弱毒株主要在消化系统中定殖,本文结果符合该规律。研究中发现肾中存在大量病毒,印证了SAα-2,3Gal型病毒受体的在肾细胞中的高表达,并提示犬肾细胞在地方毒株的细胞分离中具有优势;犬卵巢中存在大量病毒,这在其他研究中未见报道,其相关意义有待深入研究。
唾液酸受体的类型和分布不是决定感染发生的唯一条件[13-16],有学者提出不应简单地以阳性或阴性来理解受体的作用机制,而应该充分考虑到受体分布数量的影响[17-18]。因此,本文也对受体数量进行了相对定量,并与病毒的分布量进行了研究,发现两者的整体趋势是一致的,但也有特例:比如受体分布较多的肺、食管、空肠、胰腺、小脑、嗅球、骨骼肌、睾丸等组织器官,人工感染后却没有病毒。这与水貂的相关研究结论类似[19],唾液酸受体在雪貂的主要组织脏器如心、肝、脾、肺、肾、肠、脑等组织均有分布,但是活病毒并没有在相应的各组织存在。进一步证明了唾液酸受体并不是病毒感染的单一决定因子。
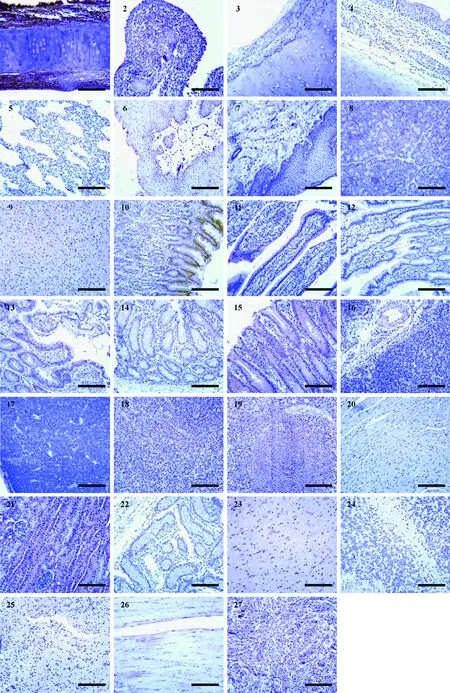
Note. 1:鼻甲骨;2:喉头;3:气管;4:支气管;5:肺;6:咽;7:食道;8:胰腺;9:肝;10:胃;11:十二指肠;12:空肠;13:回肠;14:盲肠;15:结肠;16:扁桃体;17:胸腺;18:肠系膜淋巴结;19:脾;20:心肌;21:肾;22:睾丸;23:大脑;24:小脑;25:嗅球;26:骨骼肌;27:卵巢。标尺=500 μm。图4 人工感染后流感病毒H3N2亚型在犬体内的组织分布的免疫组化图片(× 200)Note. 1, Turbinate; 2, Throat; 3, Trachea; 4, Bronchus; 5, Alveoli; 6, Pharynx; 7, Esophagus; 8, Pancreas; 9, Liver; 10, Stomach; 11, Duodenum; 12, Jejunum; 13, Ileum; 14, Caecum; 15, Colon; 16, Tonsil; 17, Thymus; 18, Mesenteric lymph nodes; 19, Spleen; 20, Heart; 21, Kidney; 22, Testicle; 23, Cerebrum; 24, Cerebellum; 25, Bulbus olfactorius; 26, Skeletal muscle; 27, Ovary. Bars=500 μm.Figure 4 Immunohistochemical images demonstrating the presence of canine influenza virus subtype H3N2 in dog tissues after artificial infection
综上,虽然国内外已经对多种“可能的流感病毒基因混合器”动物的唾液酸受体进行了研究,期望找到病毒跨种传播的原因,但多数研究仅仅停留在了消化道与呼吸道上,或者只分析了一种受体的特征,导致组织内唾液酸受体分布的研究缺乏系统性。本文应用凝集素免疫荧光染色技术,对多个组织中的两种受体同时进行了全面的对比研究,并结合人工感染后病毒分布特征,验证了受体分布与病毒感染的相互关系,为流感病毒跨物种传播机制的研究提供了参考资料,为犬流感的感染机制、嗅觉损伤、流感病毒动物模型等相关研究奠定了基础。
