Mfge8基因敲除纯合子小鼠的定向繁殖和鉴定及其与自身免疫疾病相关性分析
2019-06-05杨文强崔天盆
杨文强,黄 伟,马 威,崔天盆
(武汉市第一医院中心实验室,武汉 430022)
乳脂球表皮生长因子8(milk fat globule EGF factor Ⅷ,MFG-E8)是一种乳汁脂肪小球表面的亲脂性糖蛋白,最初在小鼠乳腺上皮细胞被发现[1],生理情况下在其他细胞也有表达,如角质形成细胞、脾细胞、单核细胞、腹腔巨噬细胞、树突状细胞、神经胶质细胞和抗原提呈细胞[2]等,未成熟的树突状细胞和未分化的巨噬细胞表达较多的MFG-E8,主要以外泌体的方式分泌,随着细胞成熟,MFG-E8的表达降低。MFG-E8主要在吞噬细胞与凋亡细胞之间起桥连作用,增强了凋亡细胞的吞噬清除[3],维持机体的内环境稳态。Uchiyama等[4]的研究证实MFG-E8可加速糖尿病伤口愈合,促进血管生成,凋亡细胞附近M2吞噬细胞的浸润,进而抑制伤口处炎性细胞因子;在结肠炎动物模型中,接受了重组人MFG-E8治疗的小鼠中性粒细胞和凋亡细胞浸润明显减少,细胞因子和趋化因子的表达也显著降低[5];MFG-E8通过控制间充质干细胞中VGEF和ET-1的表达,增强巨噬细胞向M2型极化,加速血管生成,从而促进黑色素瘤的生成[6]。MFG-E8可能作为一种新型生物标志物来治疗人类类风湿性关节炎(RA),因为Albus等人[7]发现Mfge8基因敲除小鼠关节中中性粒细胞数量增加,并伴随有破骨细胞的活化和成骨细胞的破坏,导致系统性骨质流失;MFG-E8的缺失也会导致小鼠的脾肿大,形成无数的生发中心,由于在生发中心中清除凋亡B细胞的能力下降,导致肾小球肾炎自身抗体的产生,进一步发展为自身免疫病[8];在系统性红斑狼疮(SLE)动物模型中,MFG-E8可以下调中性粒细胞表面CXCR2的表达,同时使得凋亡的中性粒细胞被吞噬,降低SLE小鼠体内早期炎症反应[9]。本课题组自主构建以C57BL/6小鼠为背景的Mfge8基因敲除小鼠并稳定繁殖鉴定,得到的纯合子小鼠旨在自身免疫性疾病中作进一步研究。
1 材料和方法
1.1 实验动物
Mfge8基因敲除杂合子小鼠在南京模式动物研究院构建[SCXK(苏)2015-0001],背景鼠为C57BL/6小鼠,其中雄性11只,雌性21只,体重16~20 g,8周龄。稳定繁殖后在武汉市第一医院SPF级动物实验室[SYXK(鄂)2014-0030]内扩群使用,取纯合子和野生型小鼠各20只,雌雄各半,其中12周龄纯合子和野生型各8只,体重20~24 g,36周龄纯合子和野生型各12只,体重24~28 g。本研究经由武汉市第一医院实验动物福利伦理委员会批准(批准号:2017010),严格按实验动物使用的3R原则给予人道的关怀。
1.2 主要试剂与仪器
Simgen动物组织DNA试剂盒、蛋白酶K(杭州新景生物试剂开发有限公司),2× Quick Taq® HS DyeMix(上海东洋纺生物科技有限公司),6× Loading buffer、DNA Marker(北京索莱宝科技有限公司),琼脂糖(美国Bio-West公司),GoldView核酸染料(上海赛百盛基因技术有限公司),罗氏TUNEL检测试剂盒(上海罗氏诊断产品有限公司),抗核抗体IgG检测试剂盒、抗内皮细胞抗体IgG检测试剂盒(欧蒙杭州医学实验诊断有限公司)。卧式灭菌器YX-600 W(上海三申器械有限公司),恒温混匀仪、低温高速离心机(德国Eppendorf公司),PCR仪(西安天隆科技有限公司),电泳仪(北京市六一仪器厂),化学发光成像仪(美国Bio-Rad公司),荧光显微镜BX51(日本Olympus公司)。
1.3 实验方法
1.3.1 小鼠的饲养与繁殖
按照SPF级动物饲养标准进行饲养,屏障环境内温度控制在20~22℃,湿度40%~70%,12 h/12 h昼夜交替,小鼠饲喂已辐照消毒的繁殖饲料(北京华阜康公司)和去离子水,实行自由采食和饮水,小鼠垫料和笼盒均经过高温高压灭菌处理,每周更换笼盒垫料两次。因引进小鼠有限,繁殖初期按1只雄鼠与1只雌鼠进行合笼,小鼠性成熟期为8周左右,母鼠妊娠期21 d左右,子代小鼠10 d左右剪尾鉴定和剪脚趾编号,仔鼠21 d断乳分笼,繁殖出F2代子鼠以后挑选合适基因型按1只雄鼠与2只雌鼠进行合笼,逐渐扩大繁殖。
1.3.2 小鼠的基因型鉴定
由于所构建的小鼠均为杂合子Mfge8基因敲除小鼠,繁殖后子代可能出现野生型(Mfge8+/+)、杂合子(Mfge8+/-)和纯合子(Mfge8-/-)3种表型,故需对子代进行基因型鉴定。
(1)抽提鼠尾基因组DNA:剪取小鼠尾尖0.5~1.0 cm,放入1.5 mL EP管中,参照Simgen动物组织DNA试剂盒说明书抽提DNA,TE溶解后测OD值,于4℃保存。
(2)PCR扩增反应及琼脂糖凝胶电泳进行基因型鉴定:①引物设计:针对Mfge8基因敲除小鼠的基因型设计引物:上游引物:P1 5’-GTGGGCAAGTG CATCTGAGTAC-3’,下游引物:P2 5’-GAGCGATCC TATCTCAAAACCAA-3’,用于检测Mfge8基因敲除小鼠中包含LoxP插入位点的等位基因片段(扩增大小 620 bp)。针对野生型小鼠设计引物:上游引物:P3 5’-TTGCCAACAGGCTTGATGGATAT-3’,下游引物:P4 5’-GACAGTACGGAACAGCGAAGGTA-3’,用于检测野生型小鼠的Mfge8等位基因的片段(扩增大小453 bp)引物由上海生工生物工程股份有限公司合成,为干粉状。②PCR扩增:10 μL反应体系:用微量移液枪依次加入DNA模板1 μL、PCR Master Mix 5 μL、上游引物1 μL、下游引物1 μL和ddH2O 2 μL,充分混匀后将PCR管置于PCR反应仪上进行扩增,扩增条件:预变性94℃、3 min;变性94℃、30 s,退火56℃、40 s,延伸68℃、40 s,循环35次;末次循环后延伸68℃、10 min。4℃保存。③琼脂糖凝胶电泳:样品孔分别取PCR扩增产物7 μL与6× Loading buffer 1 μL混匀,对照孔加Marker 5 μL作对照,在以GoldView为分子量标记物的1.5%琼脂糖凝胶中以120 V由负极向正极电泳30 min后,于凝胶成像中观察拍照。

图1 子代1日龄仔鼠Figure 1 One-day-old progeny mice
1.3.3 利用TUNEL法检测小鼠肺组织中凋亡细胞
取12周龄Mfge8-/-和野生型小鼠左肺组织,放置于4%多聚甲醛溶液中固定,石蜡包埋切片,肺组织经过脱蜡和抗原修复后,用罗氏TUNEL试剂盒显色,在荧光显微镜下观察拍照。
1.3.4 小鼠血清中抗核抗体(ANA)检测
抗核抗体是一组具有多种细胞核成分的自身抗体,由于自身免疫疾病谱型范围广和自身抗体呈多样性,ANA虽不能作为自身免疫疾病的诊断性指标,但对自身免疫病有一定的初筛作用[10]。本研究将36周龄的Mfge8-/-和野生型小鼠血清按1∶10稀释后分别与猴肝组织作为基质的生物薄片温浴,洗涤后再与异硫氰酸荧光素标记的羊抗小鼠IgG温浴,再洗涤后在荧光显微镜下观察结果。
1.3.5 小鼠血清中抗内皮细胞抗体(AECA)检测
抗内皮细胞抗体最初在系统性红斑狼疮、类风湿性关节炎等自身免疫疾病患者血清中获得,其出现在多种自身免疫性疾病中,尤其是与血管炎相关的疾病,在系统性红斑狼疮的血管炎中表现尤为突出[11]。本研究将36周龄的Mfge8-/-和野生型小鼠血清按1∶10稀释后分别与人脐静脉内皮细胞(HUVEC)作为基质的生物薄片温浴,洗涤后再与异硫氰酸荧光素标记的羊抗小鼠IgG温浴,再洗涤后荧光显微镜下观察结果。
1.4 统计学方法
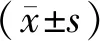
2 结果
2.1 小鼠繁殖情况
初次生产的母鼠会出现食仔现象,每胎平均产仔4~13只,如图1所示,成活率大于90%。
2.2 小鼠基因型鉴定结果
利用PCR扩增小鼠基因组DNA中因敲除而插入的loxp位点基因及Mfge8基因片段,并利用琼脂糖凝胶电泳检测扩增片段的长度,用以鉴定子代小鼠的基因型。结果如图2所示,扩增片段1、2、5、6、9、10、12、13、14号为杂合子(Mfge8+/-);3号为野生型(Mfge8+/+);4、7、8、11号为纯合子(Mfge8-/-)。
注:A:引物P1和P2扩增620 bp片段;B:引物P3和P4扩增453 bp片段。M为DNA Marker,1~14代表小鼠编号。图2 PCR及琼脂糖凝胶电泳鉴定子代小鼠基因型Note. A, Amplification of 620 bp fragment with primers P1 and P2. B, Amplification of 453 bp fragment with primers P3 and P4. M, DNA marker; 1-14, the mice number.Figure 2 Identification of progeny genotype by PCR and agarose gel electrophoresis
2.3 肺组织中凋亡细胞检测结果
利用TUNEL法检测12周龄WT和Mfge8-/-小鼠肺组织中凋亡细胞含量。在放大100倍视野下的观察结果,凋亡细胞被染绿色颗粒的数量Mfge8-/-小鼠明显比WT小鼠要多,因此12周龄Mfge8-/-小鼠肺组织中凋亡细胞数量明显多于WT小鼠,如图3所示。
2.4 小鼠血清中ANA检测结果
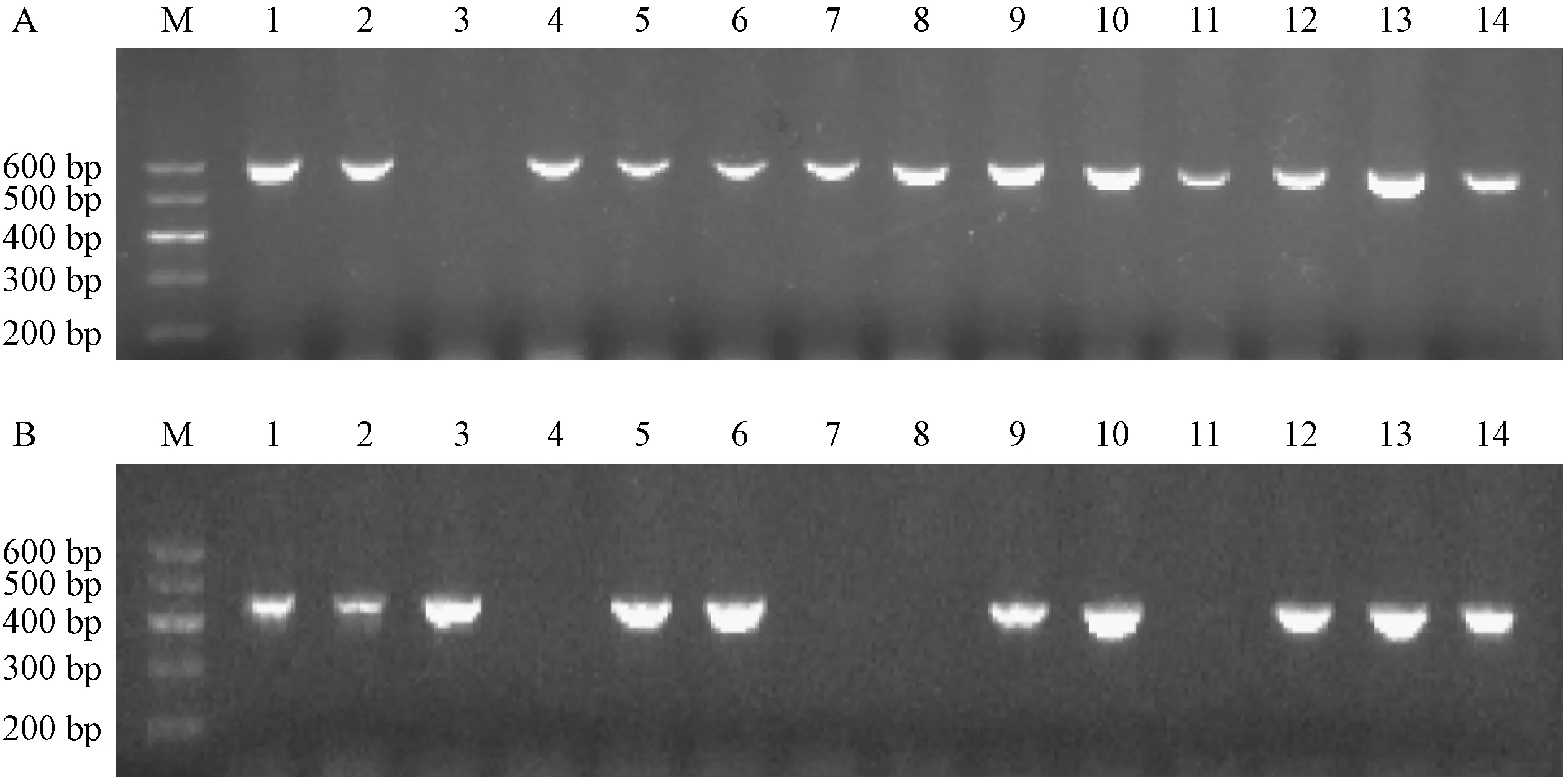
36周龄WT和Mfge8-/-小鼠血清中IgG型抗核抗体(ANA)以猴肝Hep-2细胞为基质利用间接免疫荧光法在100倍和400倍视野下观察结果,Mfge8-/-小鼠在100倍和400倍两个视野下细胞核被标记的荧光强度明显高于WT小鼠,因此36周龄Mfge8-/-小鼠血清中ANA抗体呈现阳性,而WT小鼠血清中ANA抗体呈现阴性,如图4所示。
2.5 小鼠血清中AECA检测结果
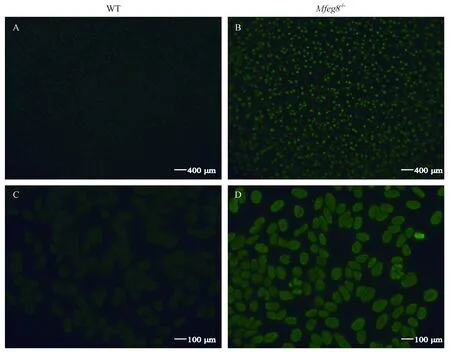
36周龄WT和Mfge8-/-小鼠血清中IgG型抗内皮细胞抗体(AECA)以人脐静脉内皮细胞(HUVEC)为基质利用间接免疫荧光法在400倍视野下观察结果,Mfge8-/-小鼠内皮细胞外周被标记的荧光强度明显高于WT小鼠,因此36周龄Mfge8-/-小鼠血清中AECA抗体呈现阳性,而WT小鼠血清中AECA抗体呈现阴性,如图5所示。
3 讨论
由于构建的Mfge8基因敲除小鼠均为杂合子,所以其子代可能出现Mfge8+/+、Mfge8+/-和Mfge8-/-三种表型,我们采用PCR用两组引物扩增小鼠DNA,然后进行琼脂糖凝胶电泳,Mfge8-/-表型的小鼠扩增产物只有一条带,即620 bp,Mfge8+/+表型的小鼠也只有一条带,即453 bp,而Mfge8+/-表型的小鼠同时会出现620 bp和453 bp两条带。

注:A:WT小鼠肺组织中凋亡细胞(× 100);B:Mfge8-/-小鼠肺组织中凋亡细胞(× 100)。箭头所指为凋亡细胞。C:随机视野下TUNEL阳性细胞个数统计(×100),与WT小鼠相比,*P<0.05。图3 TUNEL染色检测肺组织中凋亡细胞Note. A, Apoptotic cells in the lung tissue of a WT mouse (× 100). B, Apoptotic cells in the lung tissue of a Mfge8-/- mouse (× 100). Arrows indicate apoptotic cells. C, Average number of TUNEL positive cells in random view fields (×100). Compared with the WT mice,*P<0.05.Figure 3 Detection of apoptotic cells in lung tissues by TUNEL staining
注:A:WT小鼠血清中ANA(× 100);B:Mfge8-/-小鼠血清中ANA(× 100);C:WT小鼠血清中ANA(× 400);D:Mfge8-/-小鼠血清中ANA(× 400)。图4 血清中ANA检测结果Note. A, ANA in the serum of WT mice(× 100). B, ANA in the serum of Mfge8-/- mice(× 100). C, ANA in the serum of WT mice(× 400). D, ANA in the serum of MFGE8-/- mice(× 400).Figure 4 Analysis of ANA serum levels
注:A:WT小鼠血清中AECA(× 400);B:Mfge8-/-小鼠血清中AECA(× 400)。图5 血清中AECA检测结果Note. A, AECA in the serum of WT mice. B, AECA in the serum of Mfge8-/- mice.Figure 5 Analysis of AECA serum levels
Hanayama等[3]研究表明,与野生型动物相比,不能分泌MFG-E8的动物巨噬细胞对凋亡细胞的吞噬能力减弱,由于缺乏足够的清除凋亡细胞的能力,不分泌MFG-E8的成年动物更易引发自身免疫性疾病。抗核抗体(ANA)的产生细胞凋亡有两种不同的理论,一种理论认为由细胞凋亡抑制引起;另一种理论认为与细胞过度凋亡有关,在凋亡过程中产生的凋亡小体是一种重要的自身抗体来源,推测细胞凋亡增加时,吞噬细胞不能完全清除凋亡小体,未被吞噬的凋亡小体膜破裂,细胞核物质增多[12],MFG-E8在吞噬细胞与凋亡细胞中的桥梁作用,可能会推动这种进程,进而诱导Mfge8-/-小鼠机体产生ANA;正常细胞膜上的磷脂呈不对称分布,中性磷脂分布在细胞膜的外层,磷脂酰丝氨酸(PS)分布在细胞膜的内层,当细胞凋亡时,磷脂的不对称分布被破坏,PS从细胞膜内侧向外侧转移,PS的暴露是内皮细胞凋亡的最早期特征[13],MFG-E8包含两个不同的功能结构域,一个是有两个表皮生长因子样结构域的氨基端(N端),另一个是羧基端(C端)的两个与凝血因子Ⅴ和Ⅷ结构域同源的C样结构域,能结合细胞膜的阴离子磷脂双层,其中第二个C样结构域含有一个氨基的置换,可以使MFG-E8与PS膜有更强的亲和力[14],暴露PS的凋亡内皮细胞在MFG-E8的作用下更易被吞噬细胞识别并吞噬,反之,MFG-E8的缺乏不能及时清除凋亡的内皮细胞,AECA也会随即升高。血清中抗核抗体和抗内皮细胞抗体均显著增加(图4和图5),抗核抗体(ANA)对自身免疫性疾病有重要诊断价值[15],其中ANA的靶抗原为细胞死亡后释放的细胞核内不同生化成分,包括核酸、细胞核蛋白和核糖体蛋白,此外,抗内皮细胞抗体(AECA)在临床上主要用炎性疾病的判断标准,最主要的就是各种血管炎[16],在系统性红斑狼疮的活动期患者的血清中也发现高滴度的AECA,但是是否作为自身抗体还有待进一步研究,MFG-E8的缺失促进了炎症的发展,进而产生了大量的AECA。
MFG-E8是一种多结构域蛋白,能介导不同类型的细胞间相互作用,其中在介导精卵结合、附睾上皮细胞的维持[17]、肠上皮细胞的维持与修复[18]、促进乳腺分支形态发生[19]、促进血管形成[20]、促进树突状细胞外泌体功能和增强吞噬清除凋亡细胞等功能显著。系统性红斑狼疮患者体内,低水平的MFG-E8能增强吞噬作用,高水平的MFG-E8减弱吞噬作用并呈剂量依赖性,其原因可能是过量的MFG-E8分别与吞噬细胞和凋亡细胞结合,打破了两种细胞间MFG-E8的桥梁关系,从而引起吞噬障碍,引发慢性自身免疫疾病[21];文献报道女性SLE患者的内含子6发生一个少见突变,导致内含子6中的一个隐匿外显子拼接成截断的MFG-E8,其异常糖基化和唾液酸化产生C端截短的MFG-E8,导致SLE发生[22]。Mfge8基因敲除小鼠由于其生发中心内TBMs及FDCs吞噬凋亡细胞能力障碍,凋亡细胞过量积累,T细胞及B细胞过度活化,解剖Mfge8基因敲除老年小鼠呈现脾肿大;病理学检测发现脾生发中心及T淋巴细胞区域增大,且TBMs增大伴有大量凋亡细胞在胞内未被降解,因此,Mfge8基因敲除脾生发中心内TBMs不能有效清除凋亡B细胞;血清学检测老年Mfge8基因敲除小鼠体内自身抗体明显升高,表现为SLE样自身免疫性疾病[8,23]。
本文通过构建Mfge8基因敲除小鼠,检测分析自发诱导自身免疫性疾病相关重要指标,为模拟人SLE等其它自身免疫疾病的发生发展提供一个有效的动物模型,同时为进一步研究MFG-E8在自身免疫疾病中的发病机制提供了可靠的工具基础。
