Hpd基因修饰制备高酪氨酸血症III型巴马小型猪模型
2019-06-05陈傍柱邓俊成徐名衬陈恩生顾为望
顾 鹏,陈傍柱,徐 涛,刘 闻,邓俊成,徐名衬, 袁 进,陈恩生,顾为望,4*
(1. 南方医科大学比较医学研究所暨实验动物中心,广州 510515;2. 东莞松山湖明珠实验动物科技有限公司, 广东 东莞 523808;3. 南方医科大学中西医结合医院,广州 510315;4.五邑大学,广东 江门 529020)
4-羟基苯丙酮酸氧化酶(4-OH phenylpyruvate dioxygenase,4HPPD/HPD)作为一种参与大多数生物体内酪氨酸分解代谢第二步所需的酶,存在于哺乳动物的肝和肾中,能够将4-羟基苯丙酮酸转化为尿黑酸(图1)[1-2]。在III型酪氨酸血症(Mckusick 27671)中,该酶活性低甚至不存在,临床上主要表现为血清酪氨酸水平和尿液4-羟基苯丙酮酸、4-羟基苯乳酸、4-羟基苯乙酸水平显著升高。患者通常会出现神经异常、智力迟钝和轻度共济失调,但尚未确定一致的表型[3]。越来越多的人开始关注这种疾病以及HPD阻滞的后果。本研究拟通过敲除Hpd基因建立高酪氨酸血症III型巴马小型猪模型,为更好地研究该疾病的本质和治疗方法提供可靠的大动物模型。

图1 酪氨酸代谢通路及其相关疾病Figure 1 Tyrosine catabolic pathway and related diseases
1 材料和方法
1.1 实验材料
1.1.1 实验动物
6头巴马小型猪,普通级饲养,其中2头作为代孕母猪(24月龄),体重40 kg;4头作为供卵母猪(12月龄),体重30~35 kg,均由南方医科大学实验动物中心提供并饲养[SCXK (粤) 2016-0041],采卵和胚胎移植手术在南方医科大学实验动物中心大动物手术室进行[SYXK (粤) 2016-0167]。实验动物饲养和实验过程均按照实验动物使用的3R原则给予人道的关怀,所有手术操作均在麻醉状态下进行,本研究经南方医科大学伦理审查委员会审核通过(L2016088)。
1.1.2 载体
sgRNA载体pGL3-U6-gRNA-PGK-puromycin和Cas9载体pST1374-NLS-flag-linker-Cas9均购自Addgene。载体经转化后提取质粒,通过酶切鉴定并进行测序分析,均正确后用作体外转录模板。
1.2 主要试剂与仪器
sgRNA体外转录试剂MEGAshortscriptTMKit(AM1354)和Cas9体外转录试剂mMESSAGE mMACHINE®T7 Ultra Kit (AM1345)均购自Ambion;酚∶氯仿∶异戊醇=25∶24∶1(PH>7.8)(P1012)抽提试剂购自北京索莱宝科技有限公司;X5高保真DNA聚合酶 (MF003)购自聚合美生物科技有限公司; 2× Taq PCR Master Mix (DBI-2028)购自DBI Bioscience;基因组DNA提取试剂盒TIANamp Genomic DNA kit(DP304-03)购自TIANGEN BIOTECH(BEIJING);TA克隆试剂pMD19-T Vector Cloning Kit (T6013)购自大连Takara公司;四烯雌酮购自北京科益丰生物技术发展有限公司。显微操作系统TransferMan NK2购自Eppendorf公司;倒置显微镜及成像系统购自Olympus公司;体视显微镜购自Nikon公司,拉针仪、磨针仪、锻针仪毛细玻璃管均购自日本Narishige公司;细胞培养皿购自Corning公司;胚胎培养箱购自Thermo公司;胚胎移植管购自北京比威克生物公司。
1.3 实验方法
1.3.1 SgRNA-Hpd和Cas9 mRNA获取
通过GeneBank网站(https://www.ncbi.nlm.nih.gov/genbank/)查找猪Hpd基因组序列。利用CRISPR设计网页(http://crispor.tefor.net)于猪Hpd基因第6号外显子上(E6)设计20 bp的靶向序列,并合成两条互补的单链oligos。退火形成双链后连接到pGL3-U6-gRNA-PGK-puromycin载体的Bsa I位点。以上述产物为模板通过X5高保真DNA聚合酶进行PCR扩增,完成sgRNA体外转录所需的模板制备。sgRNA-Hpd正向引物:5’-TTAAT ACGACTCACTATAGAGTGAAGGACATTGCGTTCG-3’;sgRNA-Hpd反向引物;5’-AAAAGCACCGAC TCGGTGCC-3’。sgRNA模板获取PCR反应条件:98℃,5 min,98℃,30 s 60℃,30 s 72℃,30 s,37个循环,72℃,10 min,4℃保存。应用MEGAshortscriptTMKit试剂盒对上述体外转录模板进行体外转录获得sgRNA-Hpd。用限制性内切酶AgeI 对Cas9载体pST1374-NLS-flag-linker-Cas9酶切线性化,用于Cas9 mRNA体外转录模板,应用Cas9体外转录试剂盒mMESSAGE mMACHINE®T7 Ultra Kit进行体外转录获取Cas9 mRNA[4-5]。所有产物经酚氯仿抽提纯化乙醇沉淀后回收并溶于无核酸酶的水中,-80℃保存备用。
1.3.2 巴马小型猪同步发情与受精卵获取
供卵母猪和代孕母猪均拌料饲喂给药四烯雌酮20 mg/d,连续饲喂18 d诱导同步发情。停药后,每天上午和下午,均在猪采食30 min后,通过压背法和外阴观察法检测母猪的发情状态,当母猪出现“静立反射发情”时即可进行自然交配。12~14 h后通过手术冲卵方法收集巴马小型猪猪受精卵。
1.3.3 Cas9 mRNA和sgRNA的受精卵胞质内共注射
用RNase-free water(胚胎水)将Cas9 mRNA和sgRNA-Hpd分别稀释至100 ng/μL和50 ng/μL。随后将混合物注射入巴马小型猪单细胞期受精卵的胞质中,注射完成后放入培养箱培养30~60 min,挑选状态良好的受精卵行胚胎移植。
1.3.4 胚胎移植及妊娠检测
将选好的发情代孕母猪通过戊巴比妥钠静脉注射麻醉,手术切开下腹部一小口,找出一侧子宫角和输卵管伞部,将受精卵用胚胎移植管移植至一侧的输卵管中,每头代孕母猪移植10枚受精卵。移植后19~21 d,用猪早孕检测试纸检测是否妊娠。
1.3.5 基因型鉴定
每头F0代巴马小型猪分别进行耳号标记并剪取少量耳组织,用基因组提取试剂盒TIANamp Genomic DNA kit提取基因组DNA。设计相应PCR引物扩增巴马小型猪HPD基因6号外显子(表1),用TAQ酶进行PCR扩增目的片段。并将PCR产物用pMD19-T Vector Cloning Kit进行TA克隆。最后挑取10个单克隆,测序分析。
1.3.6 蛋白表达水平检测
按照标准操作提取#3和#4巴马小型猪肝组织全蛋白并进行浓度测定,取20 μg进行蛋白电泳。SDS-PAGE分离胶和浓缩胶分别按照浓度为10%和5%配置,电压为恒压80 V,30 min;120 V,60 min。电泳结束后切下目的蛋白与内参条带,转膜:恒定电流200 mA, 120 min。5% BSA溶液封闭1 h。一抗4℃孵育过夜(Anti-HPD antibody,ab232906),TBST洗膜10 min×3次,二抗室温孵育1 h,TBST洗膜10 min×3次。化学发光仪显影。
1.3.7 血液氨基酸检测
(1)样品采集:仔猪出生15 d后,将新鲜外周血采集后滴于专用采血滤纸上,自然晾干3 h,待完全干燥后放于封口塑料袋内,置于-20℃冰箱中保存待检。
(2)样品处理方法:本研究用血液氨基酸检测仪器为美国生物应用系统公司(Applied Biosystems)3200QTRAP型串联质谱仪。将干燥血液滤纸片用打孔器制成直径为3 mm的圆形滤纸血片后置于96孔聚丙烯板中(高低各1各质控)。同时,向每孔加入甲醇溶液100 μL(含有同位素内标),用Teflon膜覆盖,置于45℃环境密封震荡45 min,设置振荡频率为650 r/min。震荡完毕后室温放置20 min,转移其中75 μL至新的96孔聚丙烯板并用铝膜覆盖,随后即可上样检测[6]。
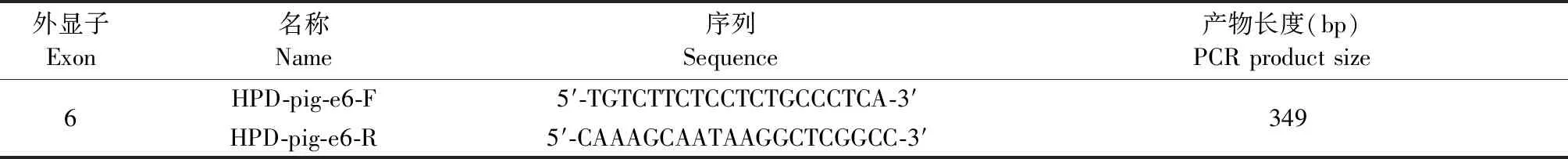
表1 巴马小型猪HPD基因6号外显子扩增引物
(3)数据分析:定量分析采用美国生物应用系统公司软件ChemoView1.2(Applied Biosystems),根据同位素内标及其相对应的离子峰强度,根据浓度已知的内标,即可自动计算出样品中所含氨基酸的浓度。
1.3.8 尿液酪氨酸代谢产物检测
(1)尿样采集和预处理:通过仔猪代谢笼收集猪尿样10 mL于15 mL离心管中,迅速置于-20℃冰箱保存待检测。尿液样本经3500 r/min离心10 min以去除杂质和蛋白质,并取上清测定尿肌酐值。
(2)样品处理方法:将预处理样品根据所测定肌酐值取0.2 mg肌酐量的尿液加入1 U/μL尿素酶共20 μL,置于37℃反应30 min后取出加入内标液和纯水补足终体积为2 mL。然后依次加入5%盐酸羟胺500 μL和2.5 mol/L 氢氧化钠溶液400 μL混匀后于室温静置1 h。待反应完成后加入6 mol/L盐酸350 μL终止反应并加入乙酸乙酯6 mL混匀,3500 r/min离心5 min取有机相至另一试管中并重复一次。加入无水硫酸钠离心吸取上清液,于60℃恒温用氮气吹干样本。向样品中加入BSTFA+10%TMCS硅烷化试剂100 μL,置于80℃恒温箱中30 min,衍生完成后待样品冷却即可取样检测。
(3)色谱及质谱条件:本研究所用气相色谱-质谱联用仪为日本岛津GCMS-QP2010 ultra分析仪。色谱柱DB25(30 m × 0.25 mm × 0.25 μm);进样口温度280℃;柱温100℃持续4 min,以4℃/min的速率升温至280℃,保持10 min,再以10℃/min升温至300℃保持10 min;载气:高纯氦气(99.999%);气体流速:43.0 cm/s,分流比20∶1;接口温度280℃;离子源温度:200℃;质谱扫面范围:50~500 amu。数据分析软件为GCMS Solution 4.11。
2 结果
2.1 sgRNA设计及Cas9 mRNA和sgRNA制备
sgRNA-Hpd设计位点如图2所示。体外转录后经RNA电泳显示其中sgRNA-Hpd片段大小为120 bp左右,Cas9 mRNA片段大小为4300 bp左右。表明成功制备了Cas9 mRNA和sgRNA-Hpd。
2.2 受精卵胞质内共注射Cas9 mRNA和sgRNA建立HPD基因修饰巴马小型猪
将20枚巴马小型猪的单细胞期受精卵予以胞质内显微共注射Cas9 mRNA和sgRNA-Hpd(图3)。移植至2只代孕母猪。2只代孕母猪怀孕,共出生2窝,获得F0代巴马小型猪共4只,公母比例为2∶2(表2)。
2.3 基因型鉴定
TA克隆的测序结果如表3所示。测序结果显示4头F0代中1只为野生型,Hpd基因未发现有突变,与野生型巴马小型猪的Hpd基因序列完全一致。其余3头F0代巴马小型猪在sgRNA-Hpd所介导定位的Hpd基因位点上出现了随机删除或插入若干个碱基(表3)。结果表明,F0代巴马小型猪Hpd基因突变位点具有长度可变或碱基对替换数目可变的特点。这些DNA序列的变化通常导致编码区域的截断或编码框架移位,从而导致Hpd基因功能障碍。

图2 sgRNA-Hpd设计位点Figure 2 The design sites of sgRNA-Hpd

表2 F0代巴马小型猪出生情况对比

表3 F0代仔猪Hpd基因突变
注:WT:野生型;“△”:碱基删除;“+”:碱基插入。
Note. WT: wild type; “△”: base deletion; “+”: base insertion.

图3 猪受精卵胞质内共注射Cas9 mRNA和sgRNA-Hpd与F0代巴马小型猪Figure 3 F0 generation of newborn Bama minipig pups with HPD gene mutations generated by CRISPR/Cas9 system zygote injection

图5 血液酪氨酸代谢水平Figure 5 Metabolic profile of the tyrosinemia type III Bama minipigs
2.4 HPD蛋白表达
Western blot检测结果如图4所示,未发生Hpd基因敲除的巴马小型猪(#4)与野生型巴马小型猪相比,肝组织HPD蛋白表达量未发生任何改变;相反,#3巴马小型猪由于Hpd基因敲除后,肝组织HPD蛋白则完全没有表达。

图4 HPD蛋白表达水平Figure 4 The relative expression of HPD protein
2.5 血液酪氨酸水平
血液酪氨酸检测结果显示,和野生巴马小型猪血液酪氨酸水平相比,#1、#2、#3巴马小型猪发生Hpd基因敲除后血液酪氨酸水平明显上升,均达到1200 μmol/L以上;相反,由于酪氨酸水平上升,苯丙氨酸处于正常水平,苯丙氨酸和酪氨酸比值(Phe/Tyr)在发生Hpd基因敲除巴马小型猪(#1、#2、#3)中显著降低。见图5。
2.6 尿液氨基酸代谢产物含量
显著升高的尿液4-羟基苯乳酸和4-羟基苯乙酸水平是高酪氨酸血症III型的重要临床特征。通过基因型鉴定我们已确认#1和#2巴马小型猪模型成功敲除Hpd基因,通过气相色谱-质谱分析检测尿液酪氨酸代谢产物水平结果显示,与野生型巴马小型猪相比,#1和 #2巴马小型猪尿液4-羟基苯乳酸和4-羟基苯乙酸水平明显上升。见图6。

图6 尿液酪氨酸代谢产物Figure 6 Urinary excretion of tyrosine metabolites
3 讨论
血液酪氨酸水平的升高和尿液4-羟苯丙酮酸及其衍生物的增加常被认为是遗传性酪氨酸血症的显著特征。本研究利用CRISPR/Cas9技术靶向编辑巴马小型猪Hpd基因成功制备了高酪氨酸血症III型巴马小型猪模型。通过基因型鉴定确认了其中3只巴马小型猪的Hpd基因发生敲除,1只未发生敲除,整体敲除效率达到75%。为检测是否存在脱靶效应,我们将外显子序列中与sgRNA-Hpd匹配达到15 bp以上基因序列作为潜在可能的脱靶位点。经PCR扩增后送样进行Sanger测序,所有检测的潜在脱靶位点均未发生突变,所以我们猜想,#4巴马小型猪未发生突变可能的原因是因为显微注射未成功或是sgRNA-Hpd未成功打靶。为进一步确认其表型,我们通过Western blot结果发现,敲除Hpd基因后巴马小型猪肝组织HPD蛋白完全不表达,通过检测巴马小型猪的血液氨基酸浓度,发现Hpd基因敲除的3只巴马小型猪酪氨酸浓度显著升高;进一步我们通过气相色谱检测尿液酪氨酸代谢产物发现Hpd基因敲除巴马小型猪的尿液4-羟基苯乳酸和4-羟基苯乙酸水平显著上升,这与人类III型酪氨酸血症的临床特征一致(Endo等人1983)[7]。而仅仅是HPD酶活性缺乏似乎不会引起肝肾功能异常[8]。
可以预料,随着串联质谱法的使用越来越多,以及在新生儿筛查项目中纳入酪氨酸测量,持续高酪氨酸水平的无症状婴儿数量将越来越多。根据本文提供的数据,巴马小型猪高酪氨酸血症III型模型可作为人类III型酪氨酸血症的理想的模型。这一新的基因敲除巴马小型猪遗传性酪氨酸血症可以用来深入了解4-羟基苯丙酮酸氧化酶在遗传性酪氨酸血症中的作用,为更好地研究和治疗酪氨酸代谢相关疾病奠定基础。
