分离培养原代树鼩角膜基质细胞
2019-06-05孙子雯李楠钰胡竹林
张 璐,李 妍,孙子雯,李楠钰,胡竹林
(昆明医科大学第四附属医院眼科,云南省第二人民医院眼科,云南省眼科研究所,云南省眼科疾病研究重点实验室,昆明 650021)
角膜移植是是治疗角膜盲的唯一方法,但供体缺乏是目前面临的主要问题,由此提出的人工角膜能很好地解决这个问题,但人工角膜排斥反应限制了其发展,组织角膜为其提供了新的研究方向。猪脱细胞角膜基质(acellular porcine corneal matrix,APCM)已进入临床应用,但其受限于无基质细胞,移植后受体会出现植片变薄及透明度下降等问题,鉴于此,角膜基质细胞植入APCM的相关研究已经成为热点。角膜基质细胞(CSCs)是角膜基质层中的主要细胞[1],对维持角膜的透明度及形态有十分重要[2]。目前,已经成功的从人、鼠、兔、猪等[3-6]角膜中分离培养出原代细胞,但是这些动物的种属与人类差异较大,且眼球的大小、解剖结构与人相比也有很大的区别,而树鼩被认为与灵长类有亲缘关系[7]。Almubrad等[8]用电子显微镜观察角膜的超微结构,发现树鼩角膜结构与人类相似,但目前关于树鼩角膜基质细胞的原代培养未见报道,因此本文探讨一种简单方便的体外分离培养树鼩角膜基质细胞的方法,以期为组织角膜工程的研究及临床应用、自体或异体的角膜基质细胞移植奠定基础。
1 材料和方法
1.1 实验动物
本实验使用的滇缅树鼩由中国科学院昆明动物研究所提供[SCXK(滇)K2017-0003],出生10~15 d的子一代清洁级树鼩6只,体质量35~40 g,雌雄不限,操作地点中国科学院昆明动物研究所[SYXK(滇)K2017-0008]。实验方案获得昆明医科大学伦理委员会通过(2014-Y02)。本实验所使用的实验动物严格遵照3R原则给予人道关怀。
1.2 主要试剂与仪器
DMEM/F12(1∶1)培养基(美国Hyclone公司);胎牛血清(美国Gibco公司);胶原酶Ⅱ(美国Sigma);Dispase-Ⅱ(美国Merck Millipore公司);0.25%胰蛋白酶-EDTA(美国Merck Millipore公司);ITS(Insulin-Transferrin-Selenium,胰岛素-转铁蛋白-硒,美国Gibco公司);波形蛋白单克隆抗体(美国Invitrogen公司);DAB免疫组化试剂盒(北京中杉);10X多聚赖氨酸(北京索莱宝生物科技有限公司);曲拉通X-100(北京索莱宝生物科技有限公司);抗荧光淬灭PVP封片液(上海碧云天生物技术有限公司);DAPI溶液(北京索莱宝生物科技有限公司);SMZl500体视显微镜及光学照相系统(日本Nikon公司)、荧光显微镜(日本Nikon公司);CO2恒温培养箱(美国Fisher Scientific公司);双目眼科手术显微镜(德国蔡司公司);TC处理6孔细胞圆形爬片(上海晶安);T25细胞培养瓶、24孔培养板(无锡耐思生物科技有限公司)。
1.3 实验方法
1.3.1 实验分组、获取树鼩角膜基质片
取6只幼龄雌性树鼩,经腹腔注射3% 的戊巴比妥1 mL处死动物后,无菌条件下在眼科手术显微镜下剪开树鼩的眼皮,露出眼球,小心摘取8只眼球,碘伏中浸泡12 min,用9 g/L生理盐水冲洗3遍。将洗净的眼球移入含双抗(青霉素100 U/mL、链霉素0.5 mg/mL)的PBS中,在超净工作台上,用15度穿刺刀沿角膜缘穿刺入前房,然后角膜剪沿角巩膜缘剪下整个角膜组织(不含角巩膜缘),放入含有双抗的PBS中。角膜片随机分为实验组A及实验组B,实验组A采用胶原酶消化法分离CSCs,实验组B采用胶原酶联合中性蛋白酶消化法进行细胞的原代培养。每组取6片角膜片进行观察。
1.3.2 胶原酶消化法提取原代细胞
在体视显微镜下用显微镊刮除角膜上皮层,完整撕下角膜后弹力层及内皮层,放入含有双抗的PBS中漂洗2次。经以上处理后,将角膜基质片放入1.5 mL的EP管中,剪碎至1 mm×1 mm大小,每个EP管中加入200 μL浓度为1%的Ⅱ型胶原酶,酶与组织充分接触。37℃避光震荡消化约60 min,加入基质细胞完全培养液终止消化。1500 r/min离心10 min,弃上清,反复吹打、洗涤、离心2次。收集细胞悬液,用含1%青霉素/链霉素、20% FBS的DMEM/F12、1% ITS为基质细胞完全培养液,细胞悬液接种于24孔板中,24孔板提前用多聚赖氨酸处理,置37℃、体积分数5% CO2饱和湿度培养箱中培养,3 d后第一次半量换液,以后每2~3 d换液1次。
1.3.3 胶原酶联合dispase-Ⅱ提取原代细胞
角膜基质片的制备同前,剪碎。加入1%的Ⅱ型胶原酶在37℃中消化30 min,用含血清的培养基终止消化、离心一次;加入1 mg/mL的dispase-Ⅱ,置于37℃温箱中避光消化2 h,用完全培养基(同上)终止消化,1500 r/min离心10 min,弃上清,反复吹打、洗涤、离心2次,置37℃、体积分数5% CO2饱和湿度培养箱中培养,换液及观察同前。
1.3.4 角膜基质细胞的传代及复苏
角膜基质细胞长满至80%~90%时,吸去剩余培养液,加入PBS缓冲液清洗细胞2次,每次30 s,用0.25%胰蛋白酶-EDTA,37℃中消化1 min,置于倒置显微镜下观察,当细胞回缩、变圆、细胞间隙增大时加入培养液终止消化。轻轻敲打培养瓶壁,使细胞完全脱落,收集细胞悬液于15 mL离心管中离心,1000 r/min,离心5 min,弃上清液,加入2~3 mL培养液(DMEM/F12+10% FBS+1%双抗)轻轻吹打,以1∶2或1∶3传代,放入T25瓶中,置于细胞培养箱中培养,隔日换液。冻存的CSCs从液氮取出后,立即放入37℃水浴箱,细胞悬液溶解后加入细胞培养基,先慢后快,1000 r/min、5 min,弃上清,加入细胞培养基,温箱中继续培养。
1.3.5 角膜基质细胞的鉴定
(1)细胞免疫组织化学法:P3代细胞复苏,2 d后胰酶消化,收集细胞悬液。6孔板的每孔中放入1张玻片,每张玻片滴加400~500 μL细胞悬液,细胞悬液的量以不溢出玻片适宜,水平置于细胞培养箱中2 h后,使其贴壁,追加细胞培养液至2 mL。取细胞长满70%-80%的玻片,PBS轻轻漂洗2次;4%的多聚甲醛或95%的酒精(即95%的酒精99份,冰醋酸1份的比例),常温固定20 min;固定后PBS漂洗3次,每次3 min;0.3%Trition X-100、透膜10 min后,用PBS漂洗3次,每次3 min;在玻片表面滴加3%过氧化氢去离子水,室温孵育10 min,灭火内源性酶;吸除过氧化氢,PBS漂洗3次,每次3 min;玻片表面滴加10%山羊血清封闭液,37℃孵育20 min,以减少抗原抗体的非特异性结合;吸去多余封闭液,切勿冲洗;将波形蛋白单克隆抗体用0.2% BSA稀释到1∶100,滴加50 μL至玻片表面,阴性对照组滴加0.2% BSA,置于湿盒内4℃反应过夜后,PBS漂洗3次,每次5 min;滴加适量反应增强剂(试剂2中杉金桥),室温20 min后,PBS洗3×3 min;玻片表面滴加适量酶标羊抗兔IgG聚合物,室温20 min,PBS洗3×3 min;上述处理后的玻片滴加DAB显色10 min、自来水充分冲洗;苏木素染色90 s;新鲜配置的0.1% 盐酸-无水乙醇分化20 s;置于自来水处冲洗返蓝;用酒精梯度脱水、二甲苯通风窗处透明、中性树胶封片、镜检。
(2)细胞免疫荧光:细胞固定同前,0.5% Trition X-100(PBS配制)、室温透膜20 min后,用PBS漂洗3次,每次3 min;滴加山羊血清,室温封闭30 min;吸出多余封闭液,勿洗;每张玻片滴加足量稀释好的一抗(1∶100),置于湿盒中4℃ 过夜孵育;次日早晨,玻片用PBS漂洗3次,每次10 min;滴加荧光二抗(1∶50),37℃中孵育1 h,PBS漂洗3次,每次10 min;滴加DAPI染核,室温10 min,PBS漂洗3次,每次3 min;吸水纸吸干玻片上残留的液体,用含抗荧光淬灭PVP封闭液封片,倒置荧光显微镜下观察。
2 结果
2.1 胶原酶消化法提取原代细胞
用胶原酶消化法获取的原代细胞生长较慢,消化下来的细胞一部分24 h后可以贴壁,随后原代细胞生长活跃, 3 d后可见细胞分散在24孔板中,细胞呈梭形,细胞核居中,胞浆清亮,形态规则(图1 A), 9 d后观察到有较多细胞集落形成(图1B),大部分细胞呈梭形。
2.2 胶原酶联合Dispase-Ⅱ提取原代细胞
取材后,第10天在高倍镜下观察,见散在分布消化下来的梭形细胞,(图2A),培养液清澈。继续培养至第20天(图2B),细胞融合成片状,分布均匀。
2.3 角膜基质细胞的传代、复苏和鉴定
胶原酶消化法培养出的基质细胞,胰酶消化时细胞较易脱落,大部分细胞为单个,聚集成团的较少,脱落下来的细胞24 h可贴壁。传代培养的细胞增殖能力强,2~3 d即可传代。传至P2细胞纯化,无上皮等杂细胞,P2/P3/P4/P5细胞生长最为活跃;随着传代次数的增加,传代细胞体积逐渐增大,细胞形态发生改变,本次实验中细胞传代至7代。波形蛋白免疫组化法显示,培养出的细胞胞浆染成棕色或深棕色(图3A/3C),细胞核为淡蓝色,提示波形蛋白表达阳性。阴性对照组的细胞胞核未见棕色(图3B/3D)。培养出的细胞有典型的成纤维细胞形态,波形蛋白表达阳性、定位于胞浆,证实培养出的细胞就是角膜基质细胞。细胞免疫荧光结果示:波形蛋白表达于胞浆,红色荧光(图4)。培养出的细胞有典型的成纤维细胞形态,波形蛋白表达阳性,定位于胞浆,证实培养出的细胞是角膜基质细胞。
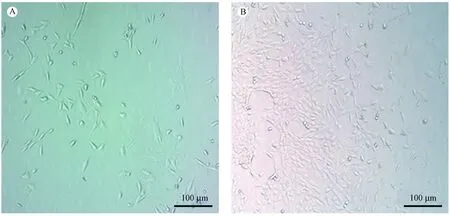
注:A:原代CSCs P0代第3天;B:原代CSCs P0代第9天。图1 胶原酶法消化获取原代细胞(× 10)Note. A, Primary CSCs P0 generation day 3. B, Primary CSCs P0 generation day 9.Figure 1 Collagease digestion to obtain primary cells

注:A:原代CSCs P0代第10天;B:原代CSCs P0代第20天。图2 双酶消化法获取原代CSCs(× 10)Note. A, Primary CSCs P0 generation day 3. B, Primary CSCs P0 generation day 9.Figure 2 Double enzyme digestion to obtain primary CSCs
3 讨论
树鼩CSCs的原代培养可以为研究其形态、生长及人工角膜组织工程提供物质基础。近年来由于角膜植片的匮乏,使得临床角膜移植应用受限,而组织工程产生的生物角膜能解决这一难题,这就促使组织工程及生物角膜的快速发展,构建组织工程角膜基质主要包括3大要素:人工材料、微环境、种子细胞。组织工程中常见的支架材料:明胶、聚合物、多种胶原蛋白、脱细胞角膜等[9-11]。目前获得的脱细胞角膜在强度、透明度、结构等方面与天然角膜相似[12],是组织工程角膜中具有前景的支撑材料,但这些支架材料缺乏生物活性,长期使用后出现生物降解等问题[13]。设想将角膜基质细胞打入脱细胞角膜后能恢复其生物活性。人角膜基质细胞是一个成熟的细胞系,在组织工程角膜上已有相应的研究[14]。考虑到种属间的排斥反应,我们选择与人类具有亲缘关系的树鼩作为实验对象,选择和人类相似的树鼩角膜基质细胞[15]替代人角膜基质细胞进行研究。
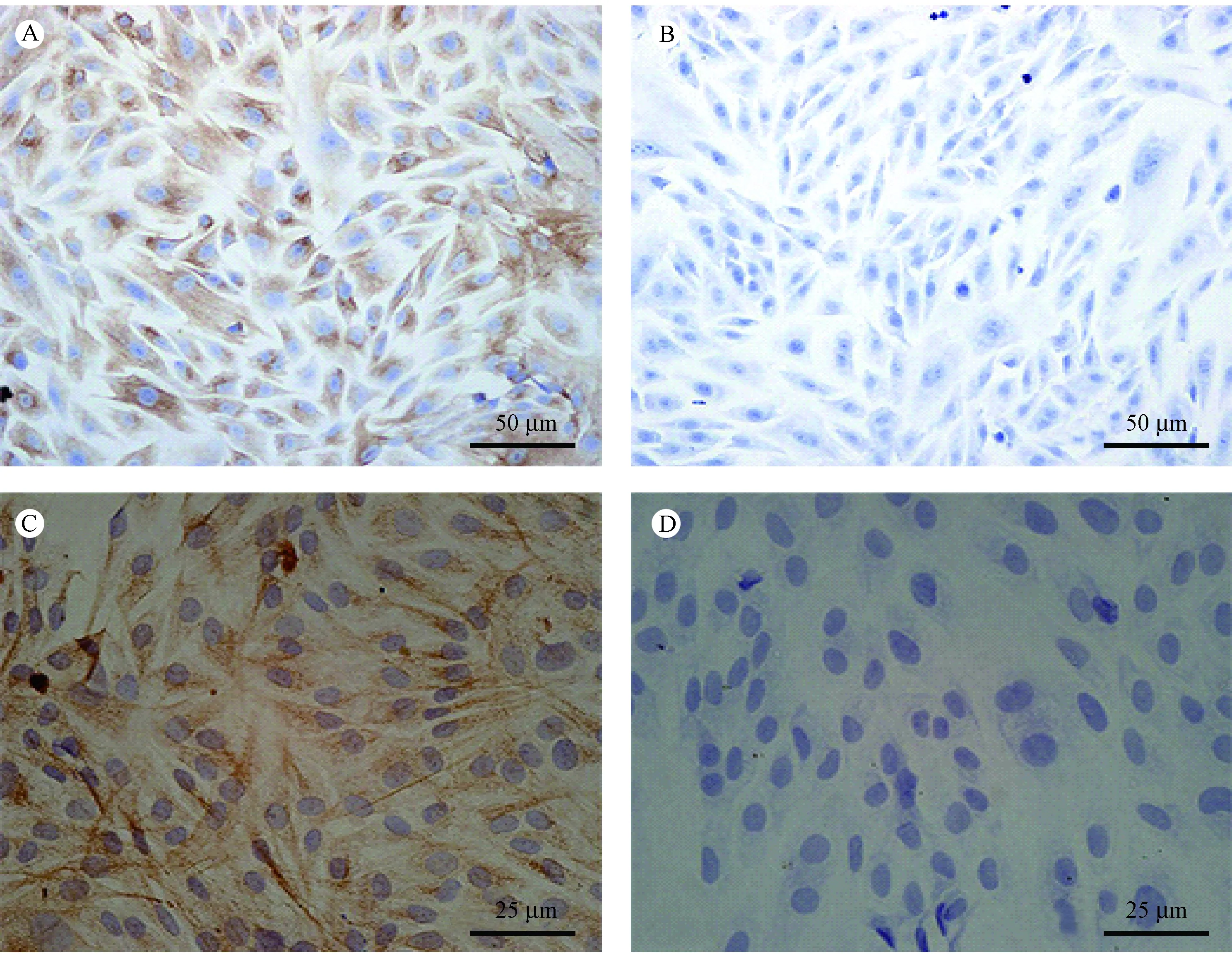
注:A:细胞胞浆棕色着色(× 20);B:细胞胞浆未见棕色着色(× 20);C:细胞胞浆棕色着色(× 40);D:细胞胞浆未见棕色着色(× 40)。图3 波形蛋白免疫组化鉴定结果Note. A, The cytoplasm is stained brown (× 20). B, The cytoplasm is not stained brown (× 20). C, The cytoplasm is stained brown (× 40). D, The cytoplasm is not stained brown (× 40).Figure 3 Immunohistochemistrycal identification of vimentin

注:A:合并后的免疫荧光结果(× 20);B:胞浆红色荧光(× 20);C:胞核蓝色(× 20);D:合并后的免疫荧光结果(× 40);E:胞浆红色荧光(× 40);F:胞核蓝色(× 40)。图4 CSCs波形蛋白免疫荧光鉴定结果Note. A, Immunofluorescence results after merging colors (× 20). B, Cytoplasmic red fluorescence (× 20). C, Nuclear blue staining (× 20). D, Immunofluorescence results after merging colors (× 40). E, Cytoplasmic red fluorescence (× 40). F, Nudear blue staining (× 40).Figure 4 Vimentin in the CSCs identified by immunofluorescence staining
树鼩角膜分为上皮层、前弹力层、基质层、后弹力层等5层。目前已经成功在体外培养出树鼩的角膜上皮细胞、角膜内皮细胞,但树鼩CSCs的原代培养国内外未见相关报道。据文献报道CSCs随着年龄的递增,每年约减少0.45%[16],即年龄越小,CSCs的数量越多,因此实验中选用出生10~15 d的树鼩为研究对象。目前国内外培养原代CSCs常利用的方法包括2大类:组织块贴壁法、酶消化等。酶消化法包括:胶原酶、胰酶、dispase-Ⅱ等将碎块组织块中的CSCs分散出来,获得细胞悬液,加入细胞所需的营养物质,在体外培养。本次实验中无菌条件下取下树鼩眼球后,置于碘伏中,2 h内取下角膜片,将角膜内皮层连同后弹力层一起撕下,撕内皮层时,沿着基质层边缘慢慢撕,动作尽量轻柔;仅保留角膜基质层,轻轻用角膜剪剪碎角膜基质层,使组织与胶原酶充分接触。胎牛血清FBS不仅可以为细胞提供必需的营养因子、激素、促进贴壁等,还能减缓、终止酶的消化。实验中细胞第一次传代前都是使用20%的FBS,因为CSCs突然从原来的微环境中分离出来,需要摄取更多的营养物质恢复细胞活力,第一次传代后改用10%的FBS即可。研究表明角膜基质细胞的表型在体外易改变,如TGF-β、NGF、EGF、PDGF、维生素等[11-19]可以显著促进CSCs的有丝分裂和迁移,提高细胞密度,加快CSCs体外培养的速度,但会不同程度的改变基质细胞的表型。但研究表明ITS[20]能维持角膜基质细胞的表型、形态以及角蛋白和醛脱氢酶(Aldehyde dehydrogenase,ALDH)的表达,同时促进其增值,因此仅添加了1%的ITS,血清、DMEM-F12、双抗组成的基础培养液。实验中使用的24孔板提前用多聚赖氨酸处理,能促进细胞的贴壁;使用Ⅱ型胶原酶分离消化在实验中探索发现,无需精确的消化时间,在实验中探索发现,用1%的Ⅱ型胶原酶消化CSCs 1~1.5 h均可,消化完在倒置显微镜下即可见圆形、透亮的细胞;在第2天即可见CSCs贴壁,长满24孔板需要5 d左右,但传代后,细胞增值快,仅需要2~3 d,且细胞纯化,无其它杂细胞。双酶消化法获取的CSCs数量较胶原酶消化法少,细胞传代需要的时间长。虽然2种方法都可培养出CSCs,但改良后的胶原酶法更为简单,节约时间及经费,且获得的P0代CSCs更多,铺满培养瓶的时间更短。对冻存的细胞进行复苏,细胞状态好,增殖能力强,2 d后即可铺满细胞培养瓶。角膜基质细胞的鉴定目前没有特异性的方法,主要是根据细胞的形态学,即由角膜基质片培养出的细胞在倒置显微镜下观察呈典型的梭形,波形蛋白阳性表达。波形蛋白是重要的细胞骨架成分[21-22],主要在来源于胚层起源的细胞中表达,如成纤维细胞、内皮细胞和白细胞等,但内皮细胞形态为多边形,因此可以排除。根据以上结果,可鉴定是角膜基质细胞。
用改良胶原酶消化法培养出的CSCs,操作相对简单,分离基质细胞容易、酶消化控制的时间易掌握,细胞消化、传代时分布均匀,细胞培养液中仅添加了ITS,不需单独添加另外的生长因子等,能节约经费,是一种快速、易行的获得树鼩CSCs的方法。 在后期的研究中,将进一步优化角膜基质细胞的培养条件,用较少的组织培养出角膜基质细胞,为角膜组织工程的研究发展做出贡献,本研究作为体外进行角膜前板层移植的前期研究,以期能争取早日解决角膜植片匮乏问题。
