microRNA-1247通过靶向CCR16抑制脂多糖诱导的小鼠急性肺炎的机制
2019-06-05丁秀秀黄琳惠黄奕江
丁秀秀,黄琳惠,黄奕江
(海南省人民医院呼吸与危重症医学科,海口 570311)
趋化因子(chemotactic cytokines,CC)可以促进白细胞移动[1],目前已经发现70多种趋化因子以及40多种趋化因子受体。趋化因子和其受体结合,可以在肺部疾病中起到重要的作用[2-3]。CC作为趋化家族中的一员[4-5],常在肺部感染中起作用[6],其主要针对的是CC单核或者巨噬细胞[7-8]。当肺部发生感染时,CC及其受体的缺乏或者过低的含量表达,可以使初级免疫细胞巨噬细胞的肺部浸润变少,从而减少其吞噬杀菌的功能[9]。在肺叶组织中,最多的细胞为肺泡巨噬细胞, 而巨噬细胞是人体固有免疫系统的初级防御[10]。有当肺组织受到炎症因子刺激以后,细胞膜上的TLR受体会被活化[11],之后通过级联信号传递,活化下游通路,最终激活核转录因子NF-κB转位入核,诱导炎症因子转录表达。但是大量炎症因子的表达,会促进炎症的级联放大,形成肺内炎症“瀑布”反应,导致ALI/ARDS的发生[12-13]。TRIF蛋白基因被敲除的小鼠,在刺激其TLR3和TLR4受体时,其NF-κB的转位入核活性会明显降低[14-15],炎症因子的分泌也会显著减少,从而得出炎症因子的分泌是通过TLR受体的激活从而激活下游的NF-κB通路。在敲除TAK1蛋白基因以后,可以能下调由脂多糖所诱导的NF-κB蛋白的活化和炎症因子表达。小RNA也可以调控炎症反应。虽然小RNA不参与编码蛋白,但是却可以抑制mRNA转录表达蛋白,互补降解掉目的基因,这在研究中非常的重要,可以通过小mRNA去除掉对实验或者生命体有影响的目的基因。研究发现,检测脂多糖(LPS)处理A549细胞前后发生显著变化的miRNAs,并验证miR-1247-3P在不同浓度LPS处理后细胞中有高表达,提示其可能在ARDS的发生发展过程中发挥作用[16]。故本研究选择microRNA-1247作为研究靶点,并且由于CC趋化因子配体16是调控炎性介质的关键因子,故推断miR-1247-3P有可能通过靶向CC趋化因子配体16而发挥作用,该推断已经在预实验中得到验证。本研究即探讨microRNA-1247通过趋化因子CC配体16抑制脂多糖诱导的急性肺炎的作用机制。
1 材料和方法
1.1 实验动物
选取雌性清洁级8周龄BALB/c小鼠30只,体重每只约22~25 g,由海南医学院实验动物中心提供[SCXK(琼)2016-0009],小鼠饲养于温度20℃~28℃清洁级鼠笼[SYXK(琼)2014-0025]。
1.2 主要试剂与仪器
脂多糖溶液(美国Sigma公司,批号:Sigma-L2880);兔抗小鼠IRAK6多克隆抗体(Abcam公司,英国);兔抗小鼠TAK多克隆抗体(Abcam公司,英国);兔抗小鼠IKK多克隆抗体(Abcam公司,英国);兔抗小鼠NF-κB p52多克隆抗体(Invitrogen公司,美国);兔抗小鼠TNF-α多克隆抗体(Abcam公司,英国);兔抗小鼠IL-1β多克隆抗体(Abcam公司,英国);小鼠IL-1β ELISA检测试剂盒(南京碧云天公司);小鼠TNF-α ELISA检测试剂盒(南京碧云天公司);兔抗小鼠CCR16多克隆抗体(Invitrogen公司,美国);兔抗小鼠TLR4多克隆抗体(Invitrogen公司,美国)。Ⅲ型显微外科手术器械(宁波医用缝针有限公司);小鼠固定架(北京吉安得尔科技有限公司); US/S5TB230型小动物手术台(北京中西远大科技有限公司); Misonix Sonicator 4000型超声波破碎仪(Misonix 公司,美国); DDB-300型多通道电子蠕动泵(浙江象山石浦海天电子仪器厂);Waters 2695型高效液相色谱系统(Waters公司,美国); Centrifuge 5810R型低温高速离心机(Eppendorf公司,德国);全自动电泳系统(Bio-Rad公司,美国); 18-ODS型色谱柱(Dima公司,美国);金盘多媒体图像处理系统(成都金盘电子科大多媒体技术有限公司)。
1.3 实验方法
1.3.1 实验动物分组
将30只8周龄小鼠随机分为3组,急性肺炎模型组(6 h)、急性肺炎模型组(12 h)和正常组,每组10只小鼠。
实验小鼠在实施实验前一夜进行饥饿处理,但水量供应。按照8 mg/kg浓度的脂多糖,以质量添加标准,将10 mL的脂多糖溶液(lipopolysaccharides,LPS)经过气管滴加到小鼠的肺部用以构建急性肺炎模型。采取小鼠股动脉血液实施血气分析,以动脉血气低于90%为LPS急性肺炎小鼠模型制作成功的标准。该实验研究经由实验动物使用与管理委员会批准的IACUC号为2017-0017。本研究实验过程中按实验动物使用的3R原则给予人道主义关怀实施具体措施。
1.3.2 样本采集
在构建急性肺炎模型6 h和12 h以后,将BALB/c小鼠麻醉处死并解剖,观察肺部损伤情况。其中左侧肺叶用肺泡灌洗,检测TNF-α和IL-1β含量;右肺叶用以检测蛋白及microRNA-1247含量。
1.3.3 血气分析及肺叶组织干湿重检测
小鼠在气管滴加脂多糖(LPS)构建急性肺炎模型6 h和12 h以后,解剖抽出腹腔中主动脉血进行血气分析。
1.3.4 qRT-PCR检测肺叶中的microRNA-1247转录水平
取200 μL右侧肺叶组织匀浆样本,应用qRT-PCR检测右侧肺叶中的microRNA-1247表达情况。PCR引物序列见表1。
1.3.5 ELISA法检测TNF-α和IL-1β蛋白含量
应用小鼠IL-1β及TNF-α的ELISA检测试剂盒,将标准品用稀释液按照要求以一定比例稀释,然后严格按照说明书要求操作。将所得到的数据以Excel绘制标准曲线,最终将结果代入标曲,计算出样品TNF-α和IL-1β含量数值,之后再乘以相应的稀释倍数,计算含量。TNF-α与IL-1β的含量根据ELISA方法,蛋白标准曲线见表2,小鼠的TNF-α蛋白标准曲线方程为:y=173x2+30x+79.8,R2=0.9927;IL-1β的标准曲线方程为:y=16x2+197x+13,R2=0.9989。由标准曲线数据可知,实验数据线性良好,且R2均超过0.99,说明数据准确,曲线可用。注:最低检测浓度为10 pg/mL。见表2。
1.3.6 Western blot法检测CCR16和TLR4受体蛋白表达情况
①膜封闭:把NC膜放入到平皿中,同时向容器中添加浓度为5%的脱脂奶粉,溶液以完全盖住膜为宜,置于水平摇床暗处封闭0.5~1.5 h。②洗膜:在除去脱脂奶粉溶液以后,取出NC膜置于TBST中洗涤3次,每次洗涤5~10 min。③加入一抗(CCR16和TLR4受体蛋白的一抗):将一抗用0.6% TBST稀释,将NC膜剪至合适的大小,使蛋白面朝上放在含有抗体的小盒中,期间不断的轻轻的晃动孵育盒,抗体与膜充分接触,在4℃下孵育一夜。④洗膜:取出NC膜,并放置于FBS溶液中洗涤3次,每次大概20 min。⑤加入二抗:二抗使用0.6% 的PBS稀释500倍以后,室温孵育1 h以上。⑥洗膜:取出NC膜,将膜放于TBST溶液中洗涤4次,每次20 min。⑦膜显色,室温晾干,拍照保存。

表1 qRT-PCR引物序列

表2 TNF-α与IL-1β蛋白标准曲线数据(n=10)
1.4 统计学方法
2 结果
2.1 两组小鼠血气分析及肺叶组织干湿重比较
BALB/c小鼠模型组的PaO2以及氧和指数(PaO2/ FiO2)与正常组相比都有统计学意义(P<0.05),且由模型组(6 h,12 h)的小鼠氧和指数不难看出模型组符合临床ALI的诊断标准,也证明建模成功。模型组的PaCO2值和正常相比无统计学意义(P>0.05)。模型组小鼠的肺组织干湿重(6 h、12 h)与正常组比较,差异均有统计学意义(P<0.05)(表3)。
2.2 各组小鼠的血浆炎症因子表达水平变化
本实验测定了TNF-α与 IL-1β的表达量。与正常对照组balb/c小鼠进行比较,模型组(6 h、12 h)的炎症因子TNF-α、IL-1β 的表达水平与正常组相比无统计学意义(P>0.05)。而肿瘤坏死因子TNF-α的表达量在造模后6 h和12 h以后略有升高,但是变化不明显。IL-1β的表达量在造模后6 h和12 h以后也略有升高,但是变化也不明显,此变化趋势与TNF-α变化趋势相似(表4)。
2.3 模型组小鼠肺组织中microRNA-1247含量与正常组的倍数关系
与正常组小鼠进行比较,模型组在造模后6 h和12 h组织中的microRNA-1247的含量差异有统计学意义(P<0.05),且模型组12 h倍数要高于6 h,说明随着造模时间的延长,microRNA-1247的生成量越来越高(表5)。
2.4 各组小鼠CCR16和TLR4受体蛋白表达情况
WB结果显示,CC趋化因子配体16(CCR16)与正常组进行比较,模型组在造模后6 h和12 h组织中的CCR16 蛋白表达量有统计学意义(P<0.05),且模型组12 h含量要高于6 h,其表达量的变化和microRNA-1247变化呈现一定正相关。而细胞表面受体蛋白TLR4与正常组进行比较,模型组在造模后6 h和12 h组织中的TLR4 蛋白表达量有统计学意义(P<0.05),且模型组12 h含量要低于6 h组和正常组,其表达量的变化和microRNA-1247变化呈现一定负相关(表6及图1)。
2.5 各组小鼠IRAK6和TAK蛋白表达量比较
模型组的IRAK6和TAK蛋白表达量与正常组相比较,模型组在造模后6 h和12 h后组织中IRAK6和TAK蛋白表达量有统计学意义(P<0.05),且模型组12 h灰度值要低于6 h(表7及图2)。
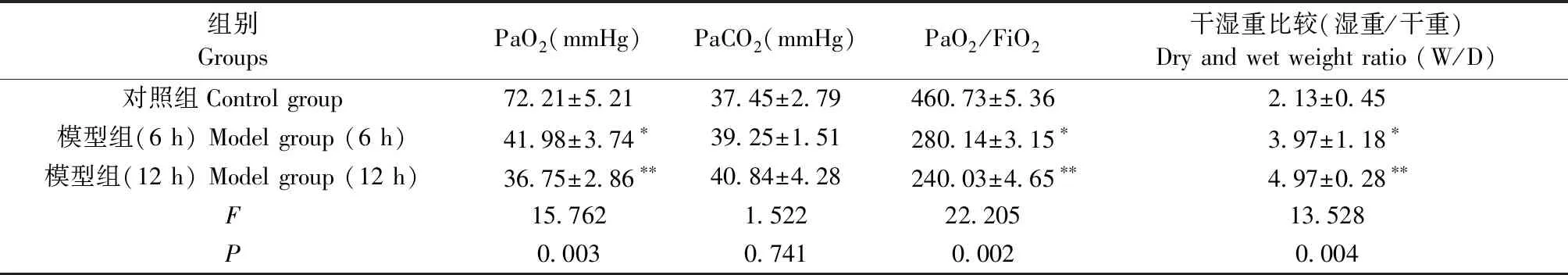
表3 各组小鼠血气值及肺组织干湿重结果(n=10)
注:与对照组比较,*P<0.05。
Note. Compared with the control group,*P<0.05.

表4 各组小鼠血浆中炎症因子含量对比结果(n=10)
注:与对照组比较,*P<0.05。
Note. Compared with the control group,*P< 0.05.

表5 不同诱导时间肺组织中microRNA-1247倍数(n=10)
注:与对照组比较,*P<0.05。
Note. Compared with the control group,*P<0.05.

表6 各组小鼠肾小管自噬体膜标志蛋白表达量比较(n=10)Table 6 Comparison of expression of autophagic membrane markers in renal tubules of the mice in each group
注:与对照组比较,*P<0.05。
Note. Compared with the control group,*P< 0.05.

图1 Western blot检测CCR16和TLR4受体蛋白表达情况Figure 1 Expression of CCR16 and TLR4 receptor proteins detected by Western blot
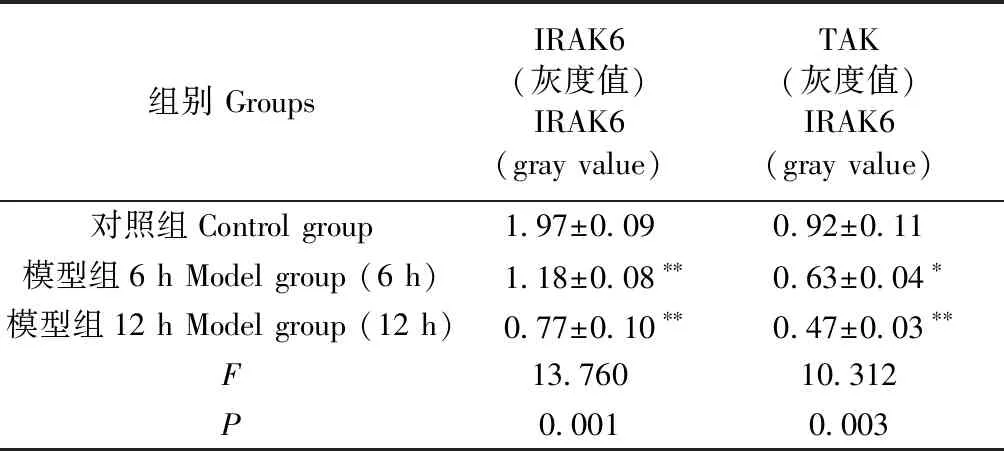
表7 各组小鼠IRAK6和TAK蛋白表达量比较(n=10)
注:与对照组比较,*P<0.05。
Note. Compared with the control group,*P< 0.05.

图2 Western blot检测IRAK6和TAK蛋白表达情况Figure 2 Expressions of IRAK6 and TAK proteins detected by Western blot
2.6 各组小鼠IKK蛋白表达量比较
模型组的IKK蛋白表达量与正常组相比较,模型组在造模后6 h和12 h后组织中IKK蛋白表达量有统计学意义(P<0.05),模型组12 h灰度值低于6 h(表8及图3)。

表8 各组小鼠IKK蛋白表达量比较(n=10)
注:与对照组比较,*P<0.05。
Note. Compared with the control group,*P<0.05.

图3 Western blot检测IKK蛋白表达情况Figure 3 Expression of IKK protein detected by Western blot
2.7 各组小鼠NF-κB p52蛋白表达量比较
WB检测结果显示,与正常组进行比较,模型组在造模后6 h和12 h组织中的细胞炎症重要的转位入核蛋白NF-κB p52表达量有统计学意义(P<0.05),且模型组12 h灰度值低于6 h低于正常组,其表达量的变化和microRNA-1247变化呈现一定负相关(表9及图4)。

表9 各组小鼠NF-κB蛋白表达量比较(n=10)
注:与对照组比较,*P<0.05。
Note. Compared with the control group,*P<0.05.

图4 Western blot检测小鼠转位入核蛋白NF-κB p52表达情况Figure 4 NF-κB p52 translocation detected by Western blot
3 讨论
肺组织是身体最大的脏器,且有很多毛细血管。它的结构和生理功能的特殊性,决定了其容易受损的特性。现已证实,TLRs识别受体在哺乳动物中广泛存在,它在调节人体免疫进程中非常的重要。目前己经发现10几种TLRs受体,他们在固有免疫中承担的作用不同,是刺激物信号转导到下游十分重要的受体蛋白。TLR4在革兰阴性细菌感染中承担重要作用。革兰氏阴性菌细胞壁成分脂多糖在释放以后,会与细胞膜表面的受体CD14形成复合物,并活化TLR4受体,进一步活化下游蛋白,促进其下游蛋白的表达,最终降解I-kB将NF-κB释放,使NF-κB发生转位入核,启动炎症基因的转录和翻译,由此引发炎症反应[16]。
在Dang等[17]的研究中显示小鼠在通过气管向肺部滴加LPS诱导的模型中检测到了miR-146a基因的上调。但是,小鼠通过雾化吸入LPS构建模型后,却没有检测到miR-146a基因的上调表达[18]。出现这一结果的原因可能是miR-146a的表达有种属之间特异性,因此本实验所证实的LPS诱导的急性肺炎模型中microRNA-1247基因的上调表达,在不同的种属小鼠, 小鼠或者不同LPS诱导方式的模型之间都可能有不同的表达。
许多文献表明LPS诱导的炎症模型导致的炎症反应会呈现瀑布式发生,这就增加了小鼠在炎症发生过程中的致死率。本文研究结果表明LPS由气管滴入到肺部诱导的模型组小鼠的PaO2以及氧和指数(PaO2/ FiO2)和肺叶组织干湿重与正常组相比差异显著。而炎症因子TNF-α、IL-1β 的mRNA表达水平差异却并不明显。后续实验结果显示模型组在造模后6 h和12 h以后组织中的microRNA-1247表达量较正常组升高的十分明显。这与以往的文献相比,小RNA含量升高的更明显,且下游蛋白的研究也更为透彻。为了探索小RNA的升高的是否与炎症因子的低表达有关,应用后续的WB实验验证。WB结果显示,与正常组相比,模型组在造模6 h和12 h后肺叶组织中的CCR16 蛋白表达量差异显著,且随着造模时间的延长逐渐升高。其表达量的升高与MICRNA-1247的含量成正相关。而细胞表面受体蛋白TLR4表达量与正常组相比,两组模型组的TLR4表达量明显降低,与MICRNA-1247的表达量呈现负相关。IRAK6、TAK、IKK蛋白与正常组相比较,蛋白表达量在造模后显著降低。转位入核蛋白NF-κB与正常组相比较,在造模后6 h和12 h后肺叶组织中NF-κB蛋白表达量也相应降低,与MICRNA-1247的表达量呈现负相关。而TLR4正是NF-κB通路的受体蛋白,而IRAK6、TAK和IKK是NF-κB蛋白的上游蛋白,它们的减少直接决定NF-κB的活化与转位入核,从而影响炎症因子的表达。由此得出炎症因子的降低与microRNA-1247的表达升高有关,通过microRNA-1247的高表达,抑制TLR4和NF-κB因LPS而引起的高表达,进而减少炎症因子的分泌,防止由于炎症因子的过量释放造成的机体损伤。且CC趋化因子配体16的明显升高也可以得出microRNA-1247抑制LPS诱导的急性肺炎的机制是通过CCR16抑制肺泡巨噬细胞的TLR4信号通路的活化,通过减少TLR4 受体的表达,级联反应的影响下游蛋白IRAK6、TAK和IKK的含量表达,从而影响NF-κB转位入核从而减少肺部炎症因子的释放,进而减轻炎症反应。本研究选择检测NF-κB p52来反应其核转位的原因是,与正常组进行比较,模型组在造模后6 h和12 h组织中的细胞炎症重要的转位入核蛋白NF-κB p52表达量差异有统计学意义,因其表达量的变化和microRNA-1247变化呈现一定负相关,故推测microRNA-1247抑制了NF-κB p52蛋白的表达量,从而减少炎症因子的表达。
综上所述,在急性肺炎模型中,microRNA-1247是通过趋化因子配体CCR16抑制因LPS诱导的急性肺炎而导致的各种细胞因子及蛋白表达量的升高。
