粗酶水相提取大豆油过程中蛋白酶解 与油脂释放状态
2019-05-13吴海波江连洲
吴海波,江连洲
(1.北部湾大学 食品工程学院,广西 钦州 535011; 2.东北农业大学 食品学院,哈尔滨 150030)
大豆是我国传统粮油作物,不仅含20%~30%油脂,还含有30%~40%蛋白质,因此也是重要的植物蛋白资源[1]。大豆蛋白不仅营养效价高,而且功能特性良好[2],被广泛应用于肉类[3]、饮料[4]、冷饮[5]及保健食品[6]中。工业制取大豆油目前主要有压榨法和溶剂浸出法。压榨法制油所得油品质好,但出油率低,动力消耗大,生产成本高;溶剂浸出法出油率高,但溶剂易残留且回收工艺烦琐,生产安全性差,环境污染大[7]。水酶法制取大豆油是一项环境友好制油技术,由于具有油品质好、环境污染小、能源消耗低、无溶剂残留、生产安全性高、同时获得油脂和蛋白质等优点[8],受到广泛关注。其原理是在机械破碎的基础上采用破坏植物细胞壁、脂蛋白或脂多糖的酶水解豆粉,使油脂从蛋白质、多糖或细胞壁的束缚中释放出来,再利用油水密度差离心得到游离油、含油的乳状液、水解液及豆粉残渣4部分,然后分别回收乳状液中的油和溶解于水解液中的蛋白,从而实现油脂和蛋白质的提取[9]。与其他酶比较,蛋白酶水相提取能获得更高的油脂得率[10],因此是目前水酶法提油工艺的常用酶。
许多学者在提高总油得率[11]、破乳方法[12]、扩大中试[13]等方面对水酶法提油工艺进行深入研究,并取得良好效果。但目前缺乏对水酶法提油期间蛋白酶解状态的系统研究,蛋白酶解状态不仅与油脂释放程度紧密相关[7],而且反映了水酶法提油工艺的过程及机理,特别是酶解期间蛋白相对分子质量的变化直接决定所得蛋白的性质和应用[14],在提高总油得率的同时,明确所得蛋白相对分子质量,有益于将来蛋白功能特性的研究,有利于水酶法提油技术经济效益的提高。
本文在前期粗酶提取大豆油取得良好实验效果基础上[1],结合不同酶解时期(1、2、4、6 h)油和蛋白得率,考察蛋白相对分子质量变化,动态监测酶解期间豆粉、水解液、乳状液超微结构,从影像角度直观观察油、蛋白在豆粉、水解液、乳状液中的分布变化,阐明粗酶提油过程中蛋白酶解状态以及油脂释放情况,并为所得蛋白性质及应用的研究提供理论参考。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
大豆,垦农22号,贮存于4℃冰箱中。
牛血清白蛋白(相对分子质量66 000 Da)、卵白蛋白(相对分子质量44 000 Da)、胰蛋白酶(相对分子质量21 000 Da)、溶菌酶(相对分子质量14 000 Da)和胰岛素(相对分子质量5 500 Da)标准品,纯度≥96%,Sigma公司;考马斯亮蓝、苏丹红Ⅲ、磷酸一氢钠、磷酸二氢钠、乙醇等,均为分析纯。
1.1.2 仪器与设备
BH-2研究级显微镜,日本OLMAPS公司;S-3400N扫描电子显微镜,日本日立公司;AKTApurifier100蛋白质纯化系统,瑞典安砝码尼亚公司;电热恒温鼓风干燥箱,上海一恒科学仪器有限公司。
1.2 实验方法
1.2.1 豆粉的挤压膨化[15]
将大豆粉碎后调节水分含量至14%,在挤压膨化机套筒温度90℃、螺杆转速100 r/min、模孔孔径18 mm条件下进行挤压膨化,所得膨化物料粉碎并过100目筛,贮存于4℃冰箱中备用。经测定,膨化豆粉中油脂含量22.1%,蛋白质含量32.3%。
1.2.2 粗酶提取大豆油过程中豆粉残渣、乳状液、水解液的收集
采用前期的研究成果[1],利用富含碱性蛋白酶和中性蛋白酶的粗酶液进行大豆油的提取,并收集不同酶解时期的豆粉残渣、乳状液、水解液。具体工艺为:在粗酶液中碱性蛋白酶酶活(2 000±200)U/mL、中性蛋白酶酶活(1 500±200)U/mL时,加入磷酸一氢钠和磷酸二氢钠配制成0.2 mol/L的缓冲酶液,将膨化豆粉倒入缓冲酶液中,使大豆粉质量与酶液体积比为1∶8,在55℃、起始pH 10时分别酶解1、2、4、6、8 h,然后90℃加热10 min灭酶,4 500 r/min离心20 min,离心管中出现豆粉残渣、水解液、乳状液、游离油4层物质,将豆粉残渣、水解液、乳状液分别从离心管中分离出来,备用。
1.2.3 水相提取大豆油工艺中水解液的制备
未加酶的水相提取大豆油工艺水解液制备参照文献[16],具体工艺为:在膨化豆粉中加入蒸馏水,使料液比达1∶10,水浴加热至料液温度50℃时,将pH调节至7并保持恒定持续搅拌1 h,然后将料液pH调至8,继续搅拌15 min后,4 500 r/min离心20 min,取中间水解液,备用。
1.2.4 酶解过程中油脂释放和蛋白提取率的测定
将1.2.2所得不同酶解时期的豆粉残渣放入电热恒温干燥箱中70℃烘干至质量恒定,豆粉残渣中的油脂含量依据GB 5009.6—2016中索氏抽提法测定,蛋白质含量依据GB 5009.5—2016中凯氏定氮法测定。酶解过程中油脂释放和蛋白提取情况分别用总油提取率和总蛋白提取率表达,具体按以下公式计算。
总油提取率=(膨化豆粉质量×油脂含量-酶解后豆粉残渣中油脂质量)/(膨化豆粉质量×油脂含量)×100%
总蛋白提取率=(膨化豆粉质量×蛋白质含量-酶解后豆粉残渣中蛋白质质量)/(膨化豆粉质量×蛋白质含量)×100%
1.2.5 酶解过程中蛋白相对分子质量的变化
将蛋白质标准品牛血清白蛋白、卵白蛋白、胰蛋白酶、溶菌酶和胰岛素分别称取10 mg溶解于3 mL pH 7.2的0.02 mol/L Tris-HCl缓冲溶液中,并振荡混合均匀,采用蛋白质纯化仪(选用SephadexG-75凝胶层析柱)进行洗脱,上样量1 mL,280 nm紫外吸收波长下检测各标准品出峰时间和吸光值,以标准品相对分子质量(M)对数(logM,y)为纵坐标,出峰时间(x)为横坐标作线性图。
将水相提取大豆油所得水解液与粗酶提油不同酶解时期(1、2、4、6、8 h)水解液分别透析脱盐后喷雾干燥制成干粉,按上述条件进行溶解,样品经0.45 μm的滤膜过滤。在上样量0.5 mL、样品流速0.5 mL/min、紫外波长280 nm下检测流出层析柱样品的吸光值及出峰时间。
1.2.6 酶解过程中豆粉超微结构变化分析
将酶解1、2、4、6 h的豆粉残渣分别用2.5%戊二醛混合液固定,磷酸缓冲液漂洗后,经50%、70%、90%和100%乙醇梯度脱水,用醋酸异戊酯置换乙醇后,再用临界点干燥法进行干燥,经离子溅射喷金,置于扫描电子显微镜下观察。
1.2.7 酶解过程中水解液微观结构变化测定
利用考马斯亮蓝对蛋白质染色,苏丹红Ⅲ对脂肪球染色的原理,将酶解1、2、4、6 h的豆粉水解液分别滴于载玻片上,并添加考马斯亮蓝、苏丹红Ⅲ混匀染色,覆盖玻片后置于研究级显微镜下观察。所有照片均为放大100倍后的影像。
1.2.8 酶解过程中乳状液微观结构测定
将不同酶解时期的乳状液按1.2.7方法进行染色,并分别置于研究级显微镜下观察。所有照片均为放大100倍后的影像。
1.2.9 数据处理
所有实验均进行3次,采用Statistix8.1软件对1.2.4实验数据进行统计分析,比较数值间差异显著性(P<0.05)。
2 结果与分析
2.1 酶解过程中油脂释放和蛋白提取率的变化(见图1)

图1 不同酶解时期的总油和总蛋白提取率
由图1可知,酶解1 h时,总油和总蛋白提取率都较低,随酶解时间延长,总油和总蛋白提取率相应提升,酶解6 h时总油和总蛋白提取率达到最高,分别为94.2%和90.1%,此后随酶解时间延长,油和蛋白提取率均变化不明显。由于包裹在油脂外围的蛋白不断被酶解,有效促进了油脂释放,导致总油提取率随蛋白提取率的增加而增加。
2.2 粗酶提取大豆油过程中蛋白相对分子质量变化
按1.2.5方法得到的5种混合蛋白质标准品的凝胶洗脱图谱见图2。

图2 蛋白质标准品的凝胶洗脱图谱
由图2可知,牛血清白蛋白、卵白蛋白、胰蛋白酶、溶菌酶、胰岛素标准品分别在10.03、11.12、12.97、14.63、16.35 min时出峰。通过对各蛋白标准品的出峰时间(x)与相对分子质量对数(logM,y)进行线性拟合,得出各标准品相对分子质量对数与出峰时间呈线性关系,线性方程为y=-0.164 6x+6.478 5(R2=0.987)。
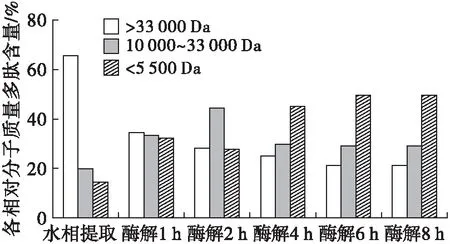
图3为酶解过程中水解液中蛋白的凝胶洗脱图谱,将各峰对应的出峰时间代入线性方程,计算相对分子质量及其分布,并进一步由洗脱图谱中各峰面积计算各组分含量,结果见图4。
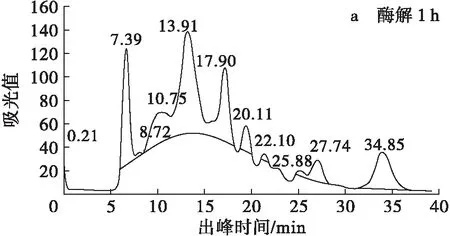


注:每个样品均重复3次,重复测定的差异不超过1%。
由图3可知,酶解1 h的水解蛋白洗脱图中7.39 min处有一较高的洗脱峰(图3a),结合图2可知,这是相对分子质量在66 000 Da以上的蛋白组分,此时蛋白中相对分子质量小于5 500 Da的短肽含量最低,而相对分子质量大于33 000 Da的多肽含量最高(图4)。酶解2 h时,相对分子质量66 000 Da 以上的蛋白组分尽管仍然存在(图3b),但含量减少,而相对分子质量10 000~33 000 Da的中肽含量明显增加(图4),在所有组分中比例最高;此后随酶解时间延长,7.39 min附近的蛋白洗脱峰消失(图3c),中肽(相对分子质量10 000~33 000 Da)含量也逐渐降低,而相对分子质量小于5 500 Da的小肽含量明显上升(图4);酶解6 h时,大分子肽及中肽含量继续降低,小肽(<5 500 Da)含量进一步上升(图3d、图4),达49.63%,成为蛋白中的主要成分;此后随酶解时间延长,蛋白中各组分含量不再变化,达到酶解终点(图3e、图4)。
水相提取大豆油工艺所得蛋白中相对分子质量大于33 000 Da的多肽含量最高,占65.63%,其中还含有部分相对分子质量大于66 000 Da的多肽,而相对分子质量小于5 500 Da的短肽含量极低,仅占14.42%(图3f、图4)。粗酶提取大豆油工艺由于酶解作用,伴随蛋白酶解程度加深,相对分子质量较大的多肽及中肽逐渐被水解生成相对分子质量较小的短肽,最终所得蛋白是以相对分子质量小于5 500 Da短肽为主(49.63%),中肽(10 000~33 000 Da)占29.22%,相对分子质量大于33 000 Da的多肽占21.15%的混合物,特别是相对分子质量大于66 000 Da的多肽已不存在。研究证实蛋白酶解物由于较小的相对分子质量从而使其具有比酶解前更好的溶解分散性[17]和消化吸收性[18],因此常被应用于酸性饮料以提高蛋白含量,用于发酵培养基中,可促进菌种生长、缩短发酵时间[19]。特别是短肽具有良好的生物活性,诸如抑制肿瘤生长[20]、抗氧化[21]、抗疲劳[22]等功能,从而被制成功能性食品。粗酶提取所得蛋白各组分可进一步进行分离纯化和性能测试,以明确所具有的功能特性。
本实验6 h为粗酶酶解豆粉终点,此时总蛋白和总油提取率最高。因此,后续实验只观察酶解1~6 h的豆粉、水解液、乳状液的微观结构。
2.3 酶解过程中豆粉的超微结构(见图5)






图5 酶解前和粗酶水相提取大豆油过程中 豆粉的超微结构电镜图
由图5可知:未膨化豆粉中细胞排列紧密,细胞壁完整,蛋白与油脂体被完整包裹在细胞中(图5a);经挤压膨化后豆粉中连接各细胞的间隙物质被破坏,细胞排列松散,而且挤压膨化造成细胞壁破裂(图5b),这为水进入细胞取代油以及酶的入侵提供了便利[11];酶解1 h时,豆粉细胞内的蛋白仅部分被酶解,大部分蛋白结合体未被酶解,因此即使在低倍数扫描电镜下仍可清晰看到细胞内残留着较完整的细胞质(图5c);伴随酶解进行,细胞内的物质逐渐减少(图5d),酶解4 h时,豆粉细胞内大部分蛋白被酶解,在高分辨率镜头下也仅观察到只有较少的蛋白体残留在细胞内(图5e);酶解6 h时,豆粉细胞内的蛋白体几乎全部被酶解,细胞结构也被进一步破坏(图5f)。
图5清晰展示了充满油脂和蛋白等物质的完整豆粉细胞由于酶解导致仅剩细胞壁的过程,伴随豆粉细胞中蛋白体的解离,总油和总蛋白提取率逐渐增加,这进一步证明蛋白酶在水相提取大豆油工艺中的有效性。
2.4 酶解期间水解液中油与蛋白的状态
为进一步揭示粗酶提油过程中蛋白酶解和油脂释放状态,采用特异性染色方法对酶解过程中的水解液进行染色并在光学显微镜下观察,结果见图6。


由图6a可知,酶解1 h时水解液中染蓝的面积及桔红色的油滴都较少,即使在放大100倍的光镜图中油滴粒径也较小。伴随酶解的进行,水解液光镜图中蓝色区域逐渐增大,意味水解液中蛋白含量增加;酶解4 h时,水解液几乎全被染成蓝色,油滴含量明显增多且粒径变大;酶解6 h时,水解液呈现更均匀的蓝色,油滴数量减少,但粒径大的油滴数量增多。
酶解1 h时,豆粉中仅有少量的蛋白被酶解,导致释放的油较少,因此残留在豆粉中的油脂和蛋白较多,而分布在水解液中的蛋白和油脂含量较低。随酶解时间延长,蛋白酶解程度加深,释放的油脂逐渐增多,特别是在酶解6 h时豆粉中的蛋白和油脂得到了极大的解离和释放,导致溶解在水解液中的蛋白和油脂含量增加,油滴粒径增大,此时蛋白得率最高,而且水解液中蛋白相对分子质量较低,导致蛋白溶解分散性能提升[17],因此水解液光镜图显示为较均匀的蓝色。
从图6可知水解液中溶有较多的油脂,这部分油脂占水酶法提油工艺总油提取率的10%~20%[7],造成水酶法实际得油率低于总油提取率。因此,如何减少或者回收溶解在水解液中的油脂,是提高水酶法提油工艺经济效益,早日实现产业化的另一重要科研课题。
2.5 酶解期间乳状液中油与蛋白的状态
由于蛋白具有良好的乳化性[9],因而在水酶法提油工艺中,释放的油脂被同时酶解的蛋白乳化,导致提取的油大部分以乳状液的形式存在[12]。图7为酶解过程中乳状液结构光镜图。


由图7可知,随酶解时间延长,乳状液中油滴数量增多且粒径不断增大。特别是酶解6 h时,乳状液中的油滴粒径大且较均匀。这与水解液中油滴数量和粒径变化趋势一致。值得注意的是,乳状液中各油滴被由考马斯亮兰染成蓝色的蛋白膜所包裹,从而使各油滴彼此分离。
酶解刚进行时,仅有少部分蛋白被解离,造成油脂释放量低,这不仅体现在水解液中油滴数量少,也体现在乳状液中油滴含量低。随酶解时间延长,油脂释放量逐渐增长,导致聚集在乳状液中的油滴数量增加。一方面乳状液中的油滴由于自身聚合作用导致油滴粒径逐渐增大[9],另一方面水相中的蛋白酶除能降解豆粉细胞以及水解液中的蛋白外,还可破坏乳状液中包裹在油滴表面的蛋白膜[23],从而释放油滴,促进油滴聚合,导致油滴随酶解时间延长粒径增大。
3 结 论
粗酶水相提取大豆油过程中,随酶解时间延长,蛋白提取率及油脂释放量上升,酶解1 h所得蛋白中相对分子质量大于33 000 Da的多肽含量最高,相对分子质量小于5 500 Da的短肽含量较低。随酶解进行,蛋白酶解程度加深,相对分子质量大的多肽含量逐渐降低,相对分子质量小的短肽含量上升,6 h时达到酶解终点,此时总油和总蛋白提取率最高,分别为94.2%和90.1%,所得蛋白是以相对分子质量小于5 500 Da的短肽(占49.63%)为主,中肽(10 000~33 000 Da)含量29.22%,相对分子质量大于33 000 Da的多肽含量较低(占21.15%)的混合物,这为所得蛋白的性能与应用提供了理论参考。
扫描电镜和光镜图显示伴随酶解进行,豆粉内蛋白和油脂逐渐被分解和释放,导致水解液中蛋白和油脂含量相应增加,而乳状液中油滴不仅数量增加且粒径增大。
