无症状期HIV感染者免疫状态与牙周指数的关系
2019-05-10郭莹夏炜高琦李维弟王潇张燕升范忠陈世璋
郭莹, 夏炜, 高琦, 李维弟, 王潇, 张燕升, 范忠, 陈世璋
(1.首都医科大学 附属北京佑安医院 口腔科, 北京 100069; 2.首都医科大学 附属北京佑安医院 感染科, 北京 100069;3.首都医科大学 公共卫生学院流行病与卫生统计学教研室,北京 100069; 4.北京市崇文口腔医院, 北京 100061)
人感染免疫缺陷病毒(human immunodeficiency virus,HIV)后机体异常免疫被激活,CD4+T细胞不断凋亡,感染者出现免疫重建障碍.在HIV感染者免疫系统逐渐衰老和耗竭的过程中,CD4+T细胞计数成为评估HIV感染者免疫状态和疾病进程的金标准[1-2].自1987年Winkler[3]提出进展性牙周炎症可能是艾滋病的口腔表达后,学者们发现HIV感染者牙周疾病的进展取决于宿主的免疫状态,不同形式的牙周病变在一定程度上也可提示HIV感染的进展[4-6].基于这些研究结果,本研究选取接受抗逆转录病毒疗法(highly active anti-retroviral therapy,HAART)治疗的无症状期HIV感染者75例,分析CD4+T淋巴计数与菌斑指数、牙龈指数和龈沟出血指数之间的关系,初探无症状期HIV感染者免疫状态与牙周炎性病变之间的内在联系.
1 对象与方法
1.1 研究对象
选取北京佑安医院感染科接受HAART治疗的无症状期HIV感染者75例,均为男性,年龄21~56岁.纳入标准:(1)接受HAART治疗并符合HIV无症状期诊断标准[7];(2)1年内无牙周治疗史;(3)无口腔黏膜病变.排除标准:凝血功能异常.
用流式细胞仪检测受试者外周血CD4+T淋巴细胞计数.根据CD4+T 淋巴细胞数的正常值[8-9]范围将受试者分为两组,轻度免疫抑制组(≥380 个/mm3,正常值范围内)和中度免疫抑制组(200~380 个/mm3,低于正常值范围).
1.2 牙周指数检查
CD4+T淋巴细胞检测后1周内进行牙周检查,选择6个牙位(16、11、26、31的唇颊面和36、46的舌面)的菌斑指数(plaque index, PLI)、牙龈指数(gingival index, GI)和龈沟出血指数(sulcus bleeding index, SBI)[10].临床医生检查前经过一致性校对.
1.3 统计学分析
使用SPSS statistics 22.0统计学软件分析数据,经正态性检验,年龄与CD4计数均为非正态分布,两两比较采用秩和检验,以P<0.05为有统计学差异.对两组HIV感染者的牙周指数进行相关性分析,并应用Logistic 回归分析免疫状态变化的危险因素.
2 结果
2.1 无症状期HIV感染者的基本情况
轻度免疫抑制组29人,中度免疫抑制组46人.不同免疫状态组的CD4计数和年龄分布情况,见表1.
表1 无症状期HIV感染者的年龄、CD4的分布
Table 1 The distribution of age and CD4 in asymptomatic HIV infected patients

分组年龄/岁CD4 轻度免疫抑制组27.00(51~21)523.00(1 177~382)中度免疫抑制组29.00(56~22)299.00(357~213)
2.2 不同免疫状态下牙周指数的比较
对轻、中度免疫抑制组的无症状期HIV感染者牙周指数在两组之间差异进行比较,结果见表2.秩和检验分析PLI、GI、SBI等指标之间均无统计学差异(P>0.05).
2.3 CD4+T淋巴细胞计数与牙周指数之间的相关性分析
将不同的CD4淋巴细胞计数与牙周指数进行相关系数分析,见表3.结果显示:PLI、GI、SBI指数均与CD4计数之间不存在相关性.
表2 年龄、牙周指数在不同免疫抑制组间的差异
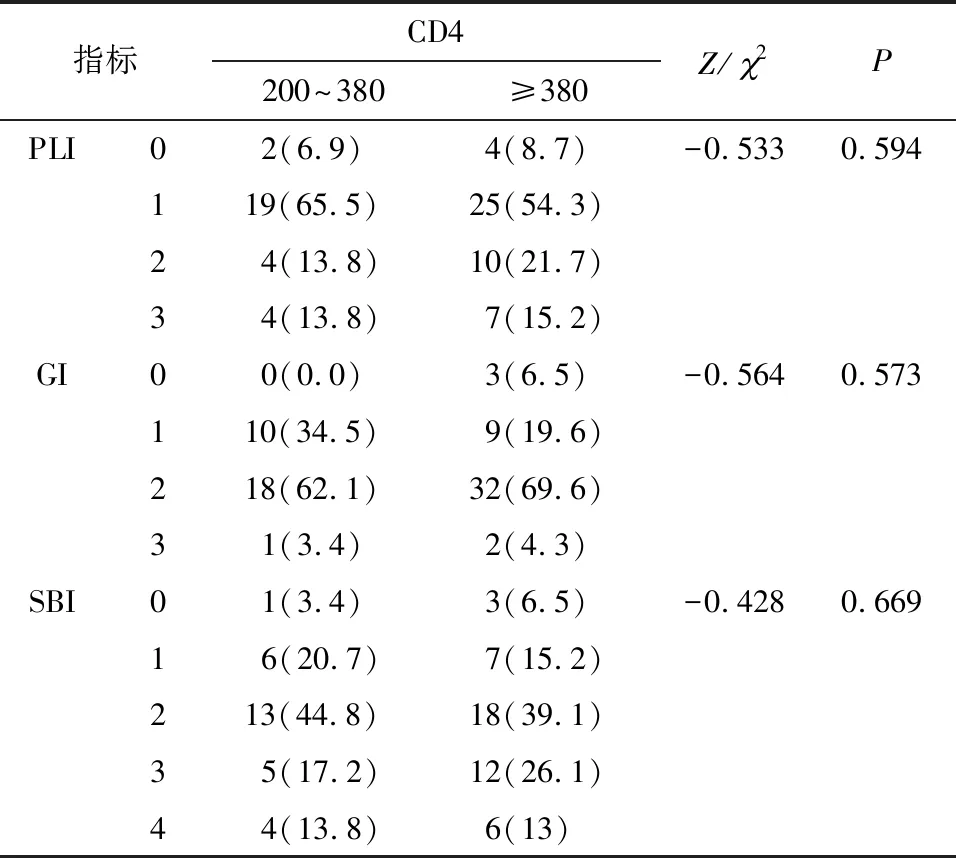
Table 2 Comparison of age and periodontal index in different immunosuppressive groupsn(%)
表3 牙周指数与CD4计数之间的相关系数
Table 3 Correlation coefficient between periodontal index and CD4 count

指标CD4rPPLI0.0330.781GI-0.0230.842SBI0.0130.912
2.4 Logistic回归分析
以CD4计数(0=轻度免疫抑制组,1=中度免疫抑制组)作为因变量,将其他因素作为自变量纳入logistic回归模型进行分析,结果见表4,各变量的系数均无统计学差异(P<0.05).但通过logistic回归分析发现,随着SBI评分增加,HIV感染者免疫抑制加重可能性增加.
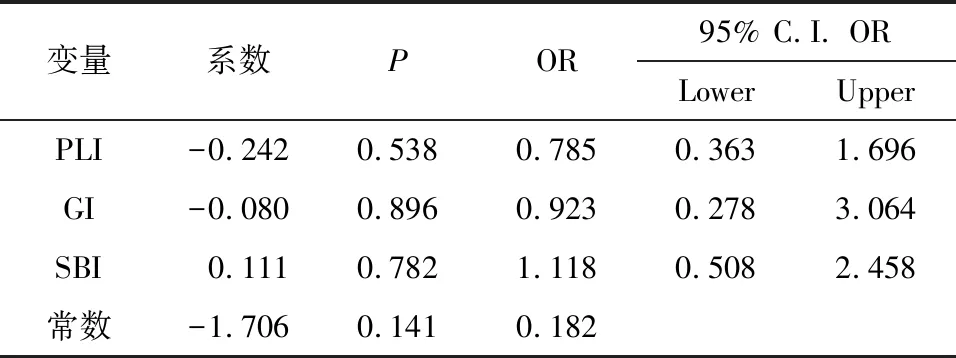
表4 Logistic回归分析表Table 4 Logistic regression analysis table
3 讨论
健康人在初次感染HIV后4周便进入了无症状期[7].在整个疾病的发展过程中,HIV感染者约80%的时间都在无症状期中度过,病毒在体内不断复制,CD4+T淋巴细胞计数逐渐下降.及时有效的HAART可将绝大部分的病毒基因组限制于宿主细胞内而不产生感染性的病毒颗粒,从而提高CD4+T淋巴细胞计数,延长患者寿命.2015年WHO更新了最佳治疗时间,不论CD4细胞数量多少,一旦确诊HIV感染即刻进行抗病毒治疗[11],越来越多的HIV感染者成为长期处于无症状期、具有传染性的慢性病群体.
免疫功能的缺陷能够促进牙周疾病的进展.HIV感染者免疫抑制加重,淋巴细胞数量减少,致病菌侵入牙龈组织,激活宿主反应,牙周及支持组织将出现不同程度的破坏.HAART的广泛应用,无症状期的HIV感染者体内的病毒被有效遏制,免疫状态得到改善,口腔内的龈缘红线、坏死性龈口炎等非典型牙周病明显减少;牙龈炎症、附着丧失等典型的炎性病变逐渐成为HIV感染者最为常见的临床表征[12-14].本文将选取的75例HIV感染者,根据免疫状态分为两组,收集PLI、GI、SBI 3个指数进行分析发现:大多数感染者的牙周均呈现轻、中度的炎性病变,指数所代表的炎症程度在轻、中度免疫抑制组间对比并无差异.以牙龈出血为主要表现的牙周炎性病变,在不同CD4分组状态下并未表现出高度的特异性.因此,本研究认为在HAART治疗下的HIV感染者牙周病变依然很常见,其牙周损害为慢性炎症表现.Barr[15]牙周探查后发现,HAART治疗下的HIV感染者牙周呈现轻度至中度炎症改变.
牙周的慢性炎症与机体免疫状态之间的关系仍存在争议.有研究认为无论HIV感染处于哪一期,牙周状态均与健康人无异,也有研究认为尽管HAART治疗可以降低牙周病损的严重程度,但HIV感染者仍表现出严重而广泛的牙周炎症[16-18].本文将HAART治疗下无症状期HIV感染者的牙周指数和CD4+T淋巴细胞计数进行分析后认为:感染者的CD4计数与牙周指数之间没有相关性.这与HAART治疗后龈下菌群中牙龈卟啉单胞菌明显减少有关.HIV病毒进入口腔黏膜后,就被限制在牙龈卟啉单胞菌的表面,当牙龈卟啉单胞菌侵入牙龈上皮后,HIV病毒也随之进入,两者与组织内的CD4+T淋巴细胞结合,聚集到牙周感染部位,产生破坏性或保护性的免疫应答[19-21].由于牙龈卟啉单胞菌及HIV病毒侵入量少,牙龈上皮内的CD4+T淋巴细胞降低不显著,仍能继续参与牙周疾病的慢性表达,故无症状期感染者并未随CD4计数减少而表现出严重的牙周病损.
有效的HAART治疗可以使无症状期感染者体内潜伏期的病毒处于低水平转录状态,与CD4+T淋巴细胞形成相对稳定的制衡.然而但潜伏期是可逆的,牙龈卟啉单胞菌增值与促炎细胞因子均能重新激活HIV,加重免疫抑制[22-24].尽管牙周指数与免疫状态之间没有相关性,但通过Logistic回归分析,发现随着SBI评分的增加,HIV感染者免疫抑制加重的可能性增加.如前所证,无症状期感染者牙周呈现轻度至中度炎症的改变,牙龈结缔组织下方血管扩张、增生,龈沟内促炎细胞因子增加.随着患者探诊出血加重、SBI评分提高,牙龈卟啉单胞菌无序增长,HIV感染者龈沟上皮通透性增强、Th1细胞因子大量产生,从而促使牙龈组织破坏,诱导并激活HIV病毒再次复制,使感染者的由轻、中度免疫转变为中、重度免疫抑制的可能性增加[25-27].因此在HAART治疗下HIV感染者的牙周指数中,着重观察牙龈出血情况的指标SBI较PLI、GI更加具有代表性,而定期的牙周治疗和良好的口腔卫生维护均将有助于SBI指数的下降.
HAART治疗下的无症状期HIV感染者轻、中度牙周炎性病损较为常见.牙周的损伤程度与感染者个人习惯、口腔卫生的维护密切相关,而与机体免疫状态没有相关性.尽管如此,在日常诊疗过程中,仍要重视感染者龈沟出血情况,SBI评分的升高提示无症状期感染者的免疫抑制状态可能加重.
