大鼠肠系膜与肾被膜下移植胰岛治疗糖尿病的疗效对比
2019-05-10程宇周丁华闫涛王进吕伟
程宇, 周丁华, 闫涛, 王进, 吕伟
(1.锦州医科大学 火箭军总医院 研究生培养基地, 辽宁省 锦州市 121001; 2.中国人民解放军火箭军特色医学中心 肝胆外科, 北京市 100088)
1型糖尿病(type 1 diabetes mellitus,T1DM)是一种以胰岛β细胞永久性破坏导致胰岛素生成不足、糖代谢紊乱的自身免疫性疾病[1].近年糖尿病发病率不断攀升,外源性胰岛素大量应用成为临床治疗中的常规选择,但治疗过程中出现的严重低血糖以及视网膜、神经系统病变等影响了患者的生活质量[2].现阶段,胰岛移植是针对T1DM最具前景的治疗方式[3].作为一种β细胞替代疗法,治疗的关键是选择适宜胰岛定植的部位[4].目前可供选择的定植部位主要有门静脉[5-6]、脾脏[7]以及肾被膜[8]等,但因存在诸多并发症而限制在临床中的推广.有研究结果显示,网膜组织可为胰岛定植提供稳定的定植位点[9].因此本研究对肠系膜部与肾被膜下进行胰岛移植的效果对比分析,探讨经肠系膜部移植胰岛的疗效,为临床应用提供实验依据.
1 材料与方法
1.1 实验动物
8周龄清洁级SD大鼠,体质量300~450 g,购于军事医学科学院动物实验中心,动物许可证号:SCXX-军.实验室光照12 h昼夜交替,动物饲养温度控制在25 ℃~28 ℃,相对湿度为45%~60%,自由进水及摄食.
1.2 实验试剂和仪器
链脲佐菌素(streptozotocin,STZ)、V型胶原酶、台盼蓝、Hanks液、RPMI1640培养液购自美国Sigma公司;双硫腙(diphenylthiocarbarzone,DTZ)购自北京国药集团有限公司;Ficoll400液购自美国GE Healthcare公司;水合氯醛购自济南嘉格生物科技公司.
超净台为日本Hitachi公司产品;低温离心机为美国Sigma公司产品;血糖仪及试纸购自美国强生公司;显微镜为日本Olympus公司产品;80目不锈钢过滤网及手术相关器械购自上海手术器械厂.
1.3 方法
1.3.1 大鼠糖尿病模型建立及分组
大鼠禁食24 h,不禁水.STZ溶液(质量分数为55 mg/kg)腹腔注射诱导建立1型糖尿病模型.非禁食状态下尾静脉取血,随机血糖浓度>16.70 mmol/L,维持2 d以上且出现多饮、多食、多尿及体质量下降症状时视为建模成功[10].随机将模型鼠分为肠系膜部胰岛移植组(肠系膜组)和肾被膜下胰岛移植组(肾被膜组),每组18只.
1.3.2 胰岛分离与纯化
体积分数为5%水合氯醛按每kg体质量7 mL腹腔注射麻醉供体大鼠,暴露胆总管并结扎下端与十二指肠交汇处,沿上端推注V型胶原酶(质量浓度1.00 mg/mL)4.00~5.00 mL,见胰腺充盈良好后完整切除并剪碎,38℃水浴消化20 min,Hanks液终止消化.80目不锈钢网过滤后4 ℃下1 000 r/min离心5min,弃上清;洗涤3次后加入体积分数为25%Ficoll 400 4 mL吹打混匀,次序添加质量分数为23%、20%、11%的Ficoll液各2 mL,2 000 r/min离心15 min;静置后将20%~23%和23%~25%界面的胰岛吸出,洗涤后移入RPMI1640培养基,胰岛分离完成[11].倒置显微镜下血球计数板计数每只供体可获取的胰岛数量,选取直径>150 μm的细胞为1个胰岛当量(islet equivalent,IEQ)[12];DTZ对胰岛细胞染色计算胰岛纯度(%);台盼蓝染色计算胰岛存活率(%).
胰岛纯度=DTZ阳性细胞数/细胞总数×100%
胰岛存活率=未染色细胞数/细胞总数×100%.
1.3.3 移植胰岛
肠系膜组大鼠麻醉后,腹部正中切口暴露肠系膜根部,1.00 mL注射器细针穿刺注入胰岛,每只大鼠种植800IEQ(图1A).种植完毕,轻柔按压穿刺部位,确认无出血、渗液后逐层关闭腹腔.术后连续2d肌注青霉素钠(质量浓度0.12 g/mL)1 mL抗感染治疗.肾被膜组取左肋缘下切口进入腹腔,暴露左侧肾脏,将同等量胰岛缓慢推注至肾被膜下,其余操作同肠系膜组(图1B).
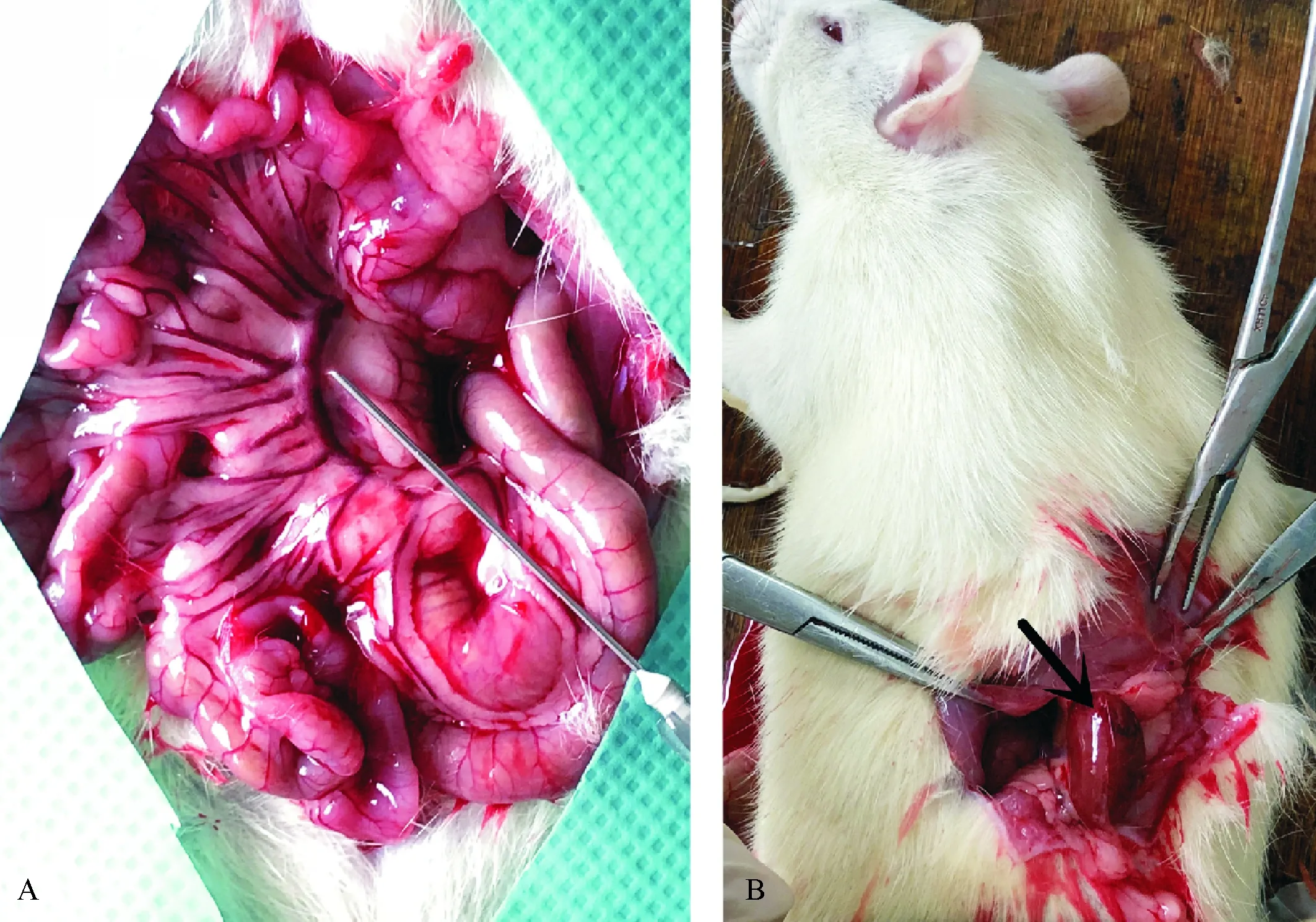
A:肠系膜根部胰岛移植部位,此处可见粗大的肠系膜动脉血管弓;B:肾被膜下胰岛移植部位.
A:The site of islet transplantation in mesenteric root, and a large mesenteric arterial arch can be seen here; B: The site of islet transplantation in renal capsule.
图1 两组大鼠胰岛移植部位
Fig.1 Sites of islet transplantation in two groups of rats
1.3.4 血糖水平检测
移植前1 d尾静脉取血监测两组大鼠血糖水平;移植后1周内每天监测血糖变化,第2~9 周内,每3 d监测1次随机血糖.连续2 d血糖浓度<11.10 mmol/L,证明血糖恢复正常,移植物存活;若随机血糖浓度>16.70 mmol/L,可视为胰岛功能丧失[13].记录每组大鼠移植物存活时间.
1.3.5 高糖刺激实验
移植后10、31 d通过放射免疫法检测两组大鼠经高糖刺激前后血清C肽水平.先将大鼠禁食12 h,尾静脉取血检测C肽水平;按每kg体质量10 mL质量分数为50%的葡萄糖溶液灌胃处理,10 min后复测.比较刺激前后血清C肽含量变化情况.
1.3.6 腹腔糖耐量功能
移植后16 d行腹腔糖耐量实验.将两组大鼠禁食12 h后,按每kg体质量腹腔注射质量分数为50%的葡萄糖溶液2 g,注射后于2、5、10、15、30、60、90、120 min测定血糖浓度,评价胰岛功能[14].
1.3.7 组织病理学
移植术后40 d,两组大鼠随机各选择1只,分别切取移植部位组织行HE染色,光镜下观察组织形态学改变.
1.4 统计学方法
2 结果
2.1 实验动物情况分析
肠系膜组1只大鼠于术后19 d死亡,肾被膜组2只分别于13、47 d死亡,最终肠系膜组17只、肾被膜组16只大鼠进入结果分析.
2.2 胰岛计数及纯度、活性测定
DTZ染色后胰岛呈猩红色,非胰岛细胞不着色(图2A);台盼蓝染色后,细胞膜破损或死亡的胰岛被染成蓝色,正常胰岛不被染色(图2B).每只供体可获取(347.08±33.22)IEQ,胰岛纯度为(88.03±4.94)%,胰岛存活率为(90.55±3.98)%.
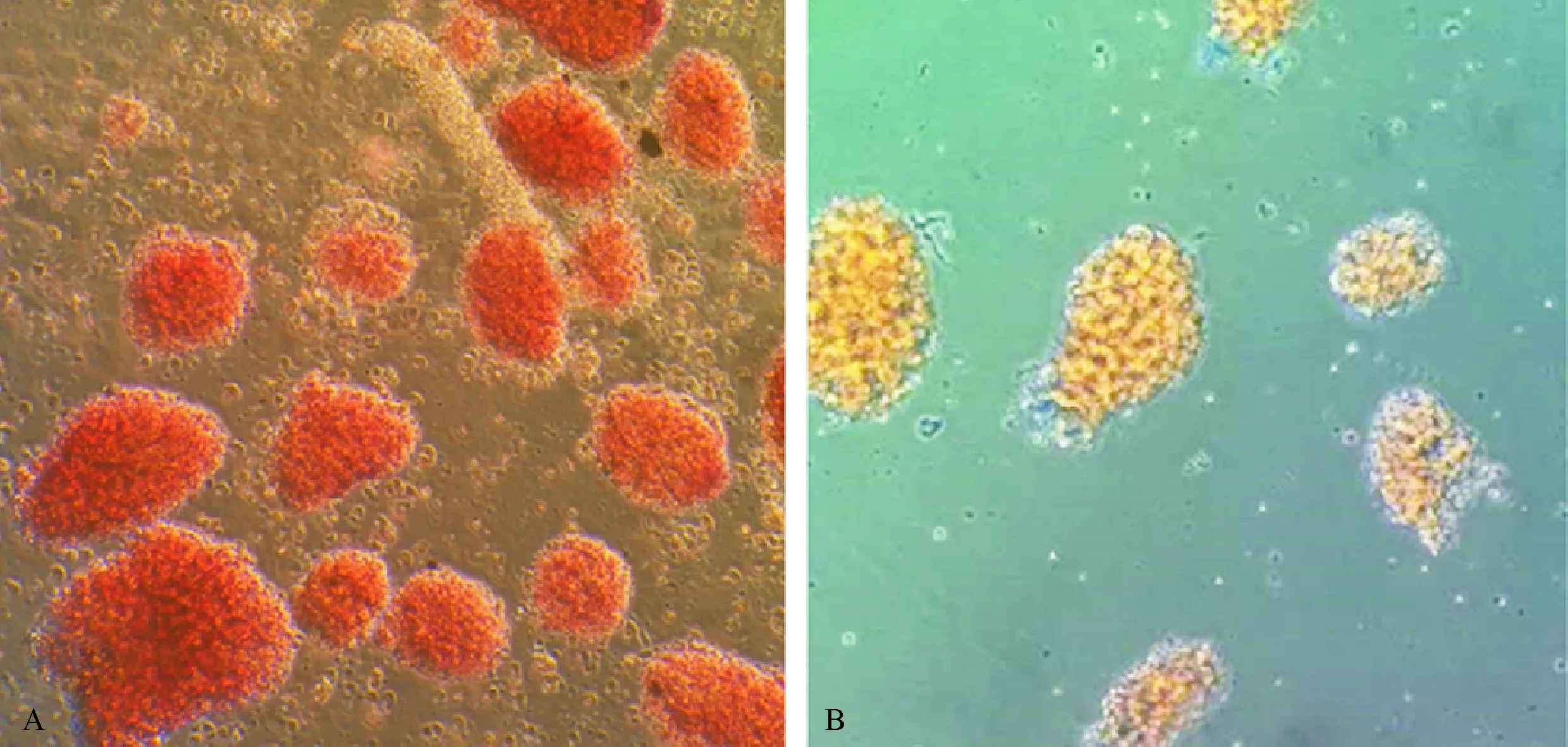
A:DTZ染色后的胰岛,镜下可见圆形或椭圆形猩红色胰岛;B:台盼蓝染色后的胰岛,形态和功能正常的胰岛不着色.
A:The scarlet islets were seen round or oval by microscope after DTZ staining; B: The islets after Trypan Blue and the normal morphology and function islets were not stained.
图2 显微镜下经DTZ和台盼蓝染色的后胰岛形态(×20)
Fig.2 Morphology of islets stained by DTZ and Trypan Blue under microscope
2.3 血糖浓度水平测定
移植前两组大鼠血糖浓度相比较,无统计学差异(t=0.203,P=0.841),均处于高血糖状态;移植后3 d,两组大鼠血糖水平均恢复正常,与术前相比均有统计学差异(t=16.245、16.642,P<0.001,表1).采用重复测量方差分析:移植后不同时间点,两组血糖相比较,有统计学差异(F=100.976,P<0.001);移植后两组间降糖疗效比较,肠系膜组血糖浓度较肾被膜下组低,差异具有明显统计学意义(F=66.421,P<0.001).
进一步选取术后10、25、40、43 d血糖浓度进行比较,其中10、25、40 d时两组大鼠血糖水平无统计学差异(P>0.05),但43 d时两组血糖浓度相比较有统计学差异(P<0.05,表1).结合移植后血糖水平波动曲线提示:肠系膜组正常血糖水平维持时间较肾被膜组长(图3).
表1 两组大鼠移植前后不同时间点血糖浓度
Table 1 Blood glucose concentration at different time points before and after transplantation in two groups of rats
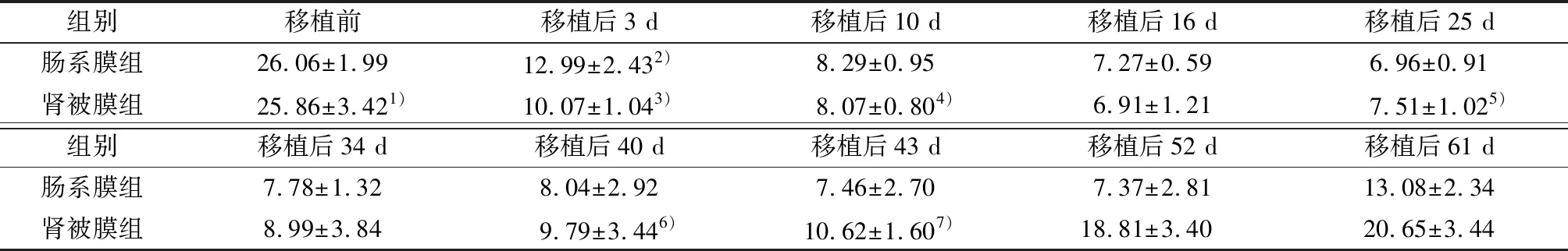
组别移植前移植后3 d移植后10 d移植后16 d移植后25 d肠系膜组26.06±1.9912.99±2.432)8.29±0.957.27±0.596.96±0.91肾被膜组25.86±3.421)10.07±1.043)8.07±0.804)6.91±1.217.51±1.025)组别移植后34 d移植后40 d移植后43 d移植后52 d移植后61 d肠系膜组7.78±1.328.04±2.927.46±2.707.37±2.8113.08±2.34肾被膜组8.99±3.849.79±3.446)10.62±1.607)18.81±3.4020.65±3.44
1)与移植前肠系膜组比较,P=0.841; 2)与移植前比较,t=16.245,P=0.000; 3)与移植前比较,t=16.642,P=0.000; 4)术后10 d两组血糖浓度比较,t=0.736,P=0.468; 5)术后25 d两组比较,t=-1.624,P=0.115; 6)术后40 d两组比较,t=-1.583,P=0.123; 7)术后43 d两组比较,t=-3.930,P=0.000.
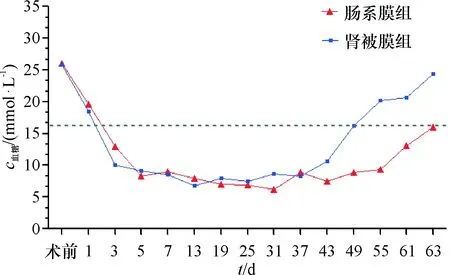
图3 两组大鼠胰岛移植前后不同时间点血糖浓度变化趋势
Fig.3 Trend of blood glucose concentration at different time points before and after islet transplantation in two groups of rats
2.4 血清C肽水平监测
术后10 d,高糖刺激前两组大鼠血清C肽相比较,无统计学差异(t=-0.762,P=0.452),刺激后两组水平相比较,无统计学差异(t=-1.635,P=0.112);分别对比各组刺激前、后C肽水平,提示两组刺激后含量均明显升高,均有统计学差异(P<0.001,表2).术后31d,刺激前两组C肽含量相比较,有统计学差异(t=4.307,P=0.000),刺激后两组水平相比较,具有统计学差异(t=5.419,P=0.000);对比两组刺激前、后结果,提示肠系膜组C肽含量明显升高,肾被膜组水平轻度升高,均具有统计学差异(P<0.001,图4).
表2 两组大鼠高糖刺激前后血清C肽质量浓度
Table 2 Serum C-peptide levels before and after hyperglycemic stimulation in two groups of rats

组别移植后10 d移植后31 d刺激前刺激后刺激前刺激后肠系膜组0.192±0.0440.766±0.0651)0.243±0.0400.726±0.1333)肾被膜组0.204±0.0470.805±0.0732)0.165±0.0600.491±0.1064)
1)移植后10 d,刺激后与刺激前C肽水平相比,t=-30.330,P=0.000; 2)刺激后与刺激前C肽水平比较,t=-27.836,P=0.000; 3)移植后31 d,与刺激前比较,t=-13.910,P=0.000; 4)与刺激前比较,t=-10.327,P=0.000.
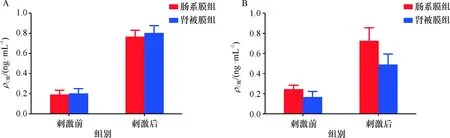
A:移植术后10 d,高糖刺激前后两组大鼠血清C肽水平变化; B:移植术后31 d,高糖刺激前后C肽变化.
A:Changes of serum C-peptide levels in rats of two groups before and after hyperglycemic stimulation 10 days after transplantation. B:Changes of C-peptide before and after hyperglycemic stimulation 31 days after transplantation.
图4 移植术后两组大鼠经高糖刺激前后血清C肽质量浓度变化趋势
Fig.4 Trend of Serum C-peptide before and after hyperglycemic stimulation in two groups of rats
2.5 腹腔糖耐量功能
术后16 d,腹腔糖耐量数据表明,不同时间点血糖浓度有统计学差异(F=176.301,P<0.001),两组大鼠血糖水平于15 min达到峰值,随后平稳下降.进一步选取30、60 min结果经t检验,血糖水平均无统计学差异(P>0.05),提示两移植组大鼠腹腔糖耐量功能良好(图5).
2.6 胰岛移植物存活时间
移植后,根据监测血糖浓度水平记录移植胰岛的存活时间.肠系膜组胰岛平均生存时间为(60.28±1.45)d,中位生存时间为61 d;肾被膜组平均生存时间为(45.99±2.38)d,中位生存时间为46 d;两组间相比较,有统计学差异(P=0.001,图6).
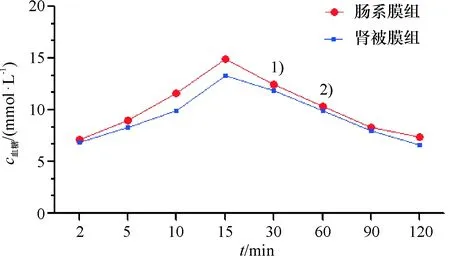
1)糖刺激30 min后,两组大鼠血糖浓度比较,t=1.365,P=0.182;2)糖刺激60 min后,两组大鼠血糖浓度比较,t=0.819,P=0.419.
1) Compare of the blood glucose between two groups of rats after 30 minutes of hyperglycemic stimulation,t=1.365,P=0.182. 2)Compare of the blood glucose between two groups after 60 minutes of hyperglycemic stimulation,t=0.819,P=0.419.
图5 移植术后16 d两组大鼠腹腔糖耐量功能变化曲线
Fig.5 The variation curve of glucose tolerance function in abdominal cavity in two groups of rats on the 16th day after transplantation
2.7 组织形态学观察
切取标本HE染色发现,光镜下肠系膜部可见数个深染、聚集成团的胰岛嵌入,周围伴生细小血管(图7A);肾脏移植部切片可见正常肾小球、小管形态,被膜下存在胞浆红色、核小深染的胰岛聚集(图7B).
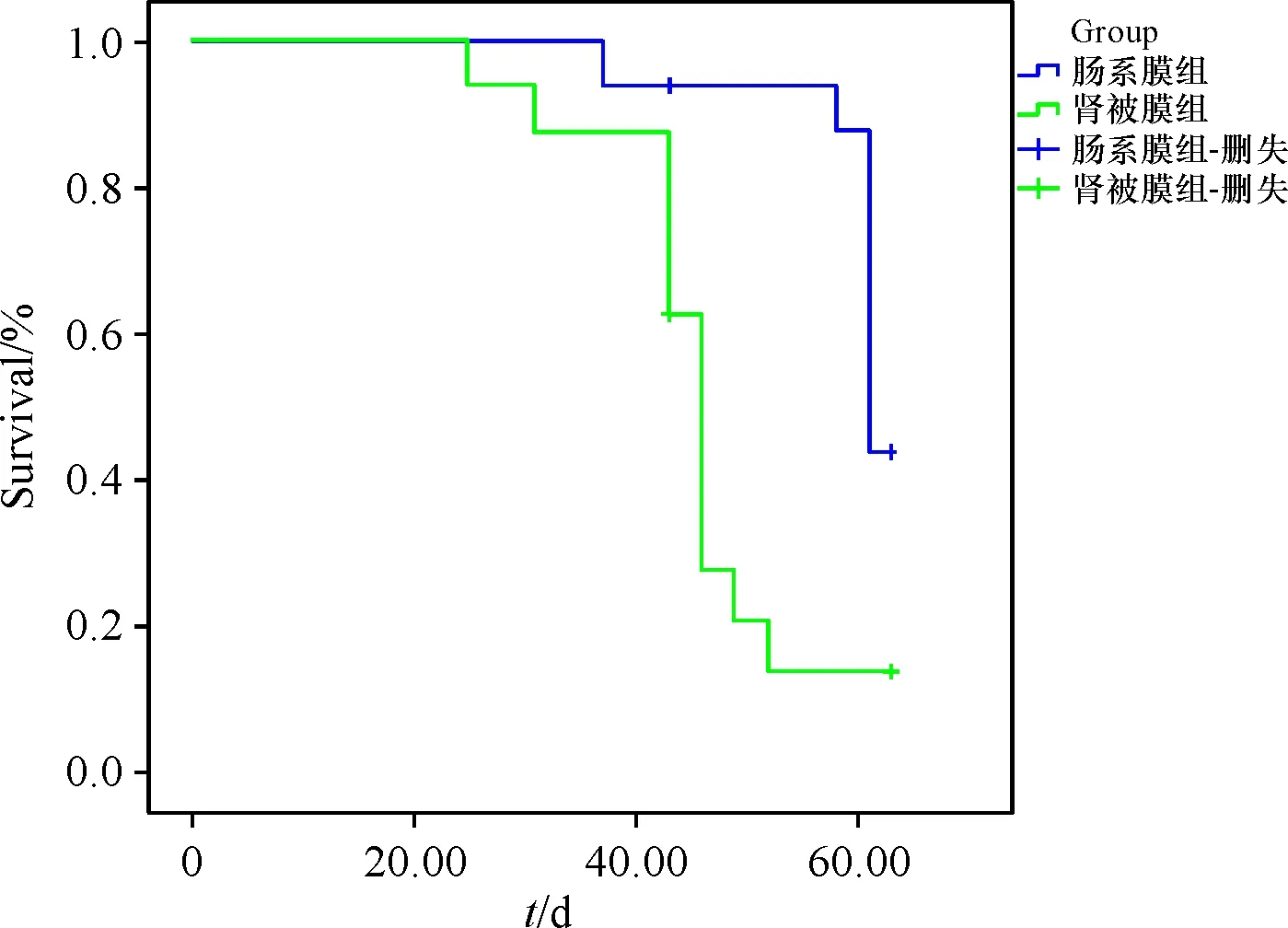
图6 两组移植胰岛Kaplan-Meier生存曲线
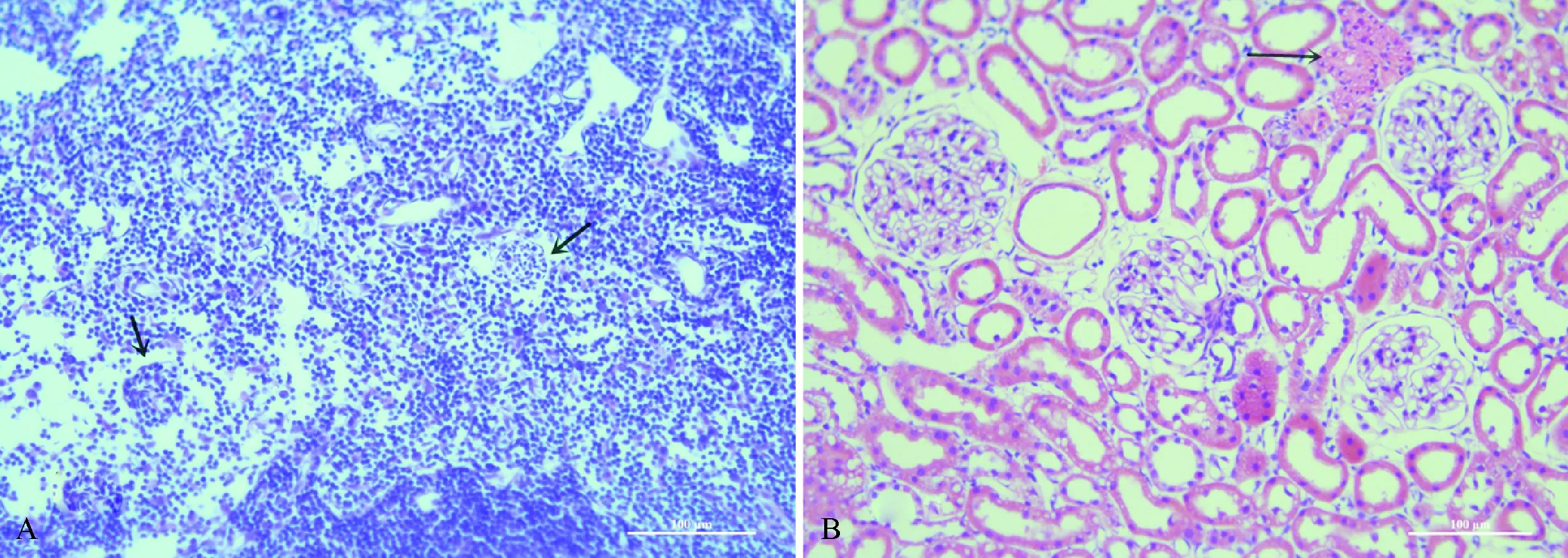
A:光镜下肠系膜部HE染色形态,箭头所示为移植后嵌入其中的存活胰岛;B:肾被膜部HE染色形态,箭头处为移植后聚集成团的胰岛.
A:HE staining of mesenteric mesentery under light microscope. The arrow shows viable islets embedded in the mesenteric mesentery after transplantation. B: HE staining of renal capsule. At the arrow were clustered islets after transplantation.
图7 两组大鼠移植部位组织标本HE染色(×20)
Fig.7 HE staining of transplanted tissue in two groups of rats(×20)
3 讨论
T1DM又称胰岛素依赖型糖尿病,内源性胰岛素分泌绝对不足和早期并发酮症酸中毒是T1DM的主要特征,患者需要终生应用外源性胰岛素模拟正常生理分泌进行血糖调控.调节过程中出现的难以控制的血糖波动一直困扰着临床医生和患者.因此,胰岛移植作为一种可稳定血糖、缓解低血糖发作和改善并发症的方式,对于T1DM的治疗具有重要意义[15].在影响移植成功的因素中,胰岛定植部位的选择尤为重要.目前经门静脉或肾脏进行胰岛移植的应用最为广泛,但门静脉高压出血和血栓、经血液介导的炎症反应(instant blood mediated inflammatory reaction,IBMIR)以及急性排斥反应并发症的风险也不容忽视[16].理想的胰岛定植部位应包含丰富的氧气和滋养血流,存在免疫特权使移植物损失最小化并且允许以最小的侵入性方法完成移植.
本研究结果显示,经肠系膜部进行移植胰岛能够降低糖尿病大鼠高血糖状态,有效恢复正常血糖水平;对于高糖刺激能促进机体C肽分泌.血清中的C肽与胰岛素均是胰岛β细胞的分泌产物,半衰期较胰岛素长且不受肝脏酶灭活,此实验表明移植后的胰岛分泌功能良好[17].有研究指出,腹腔系膜及网膜组织是有益于胰岛定植的部位.解剖学上,肠系膜为腹后壁与空肠、回肠之间的双层腹膜,内含血管、神经和淋巴结,是一个高度血管化的部位.血管化的程度决定是否可以提供充足的氧气和营养[18];其次,肠系膜组织与胰腺具有相同的胚胎源性,此处血供经门静脉引流可模拟胰岛的天然内分泌途径[19];再次,肠系膜部还可分泌多种生长因子,如血管内皮生长因子、CXC趋化因子等促进移植胰岛的存活[20-21].
Espes等[22]将胰岛定量移植到网膜内和门静脉进行对比分析,发现网膜内环境更有利于移植物再血管化和再神经化过程,在血糖调控方面更符合生理途径;Berman等[23]通过血浆和人血凝酶在糖尿病大鼠网膜内构建“生物支架”,移植大量胰岛后2 d即扭转高血糖状态,并维持正常血糖超过150 d,取得了良好的移植效果.本研究中经肠系膜部移植后,大鼠腹腔糖耐量功能与肾被膜下移植相比均表现良好.糖刺激实验显示移植早期,两移植部位的分泌功能无明显不同;但移植后期表明,肠系膜移植部位分泌功能优于肾被膜下移植.不仅如此,通过对血糖连续监测证实,移植初期肾被膜下组降糖速度较肠系膜部稍快,但肠系膜部移植胰岛的平均生存时间较肾被膜下长.Stokes等[8,24]在猪同种异体移植和鼠科移植模型中提出,胰岛定植于肾脏因早期血运丰富引发降糖作用迅速,但肾被膜下腔的弹性与致密程度导致难以进行大量移植,导致降糖能力持续时间较短.
另外,在操作过程中肠系膜部容受性较好,可摆脱移植数量的限制,允许植入较多数量的胰岛;同时规避了出血、门静脉血栓及免疫反应等风险.同样Baidal等[25]提出,将胰岛和T1DM患者的血浆蛋白共同移植到系膜组织内并取得了良好的疗效,在术后12个月里,胰岛素的用量明显减少且未发生严重的低血糖事件.
综上,本实验结果显示经肠系膜移植的胰岛能顺利存活并安全、有效地降低糖尿病大鼠的血糖浓度,疗效优于肾被膜下移植,可为胰岛移植治疗T1DM提供了一个新的替代部位,为将来在临床中应用提供了实验依据.
