高糖、低氧对大鼠心肌微血管内皮细胞新生功能影响的体外研究
2019-05-10蔡梅峰崔永生何文凯李明琰应虹柳曾国鹏
蔡梅峰, 崔永生, 何文凯, 李明琰, 应虹柳, 曾国鹏
(广州医科大学 附属第二医院 心血管内科, 广东 广州 511400)
2型糖尿病患者微血管病变发生较早,当发生缺血性损伤时,组织恢复灌注的能力明显受损,这导致冠心病的发病率和死亡率迅速上升[1-2].2型糖尿病患者微血管病变的发生可能与心脏微血管的新生功能障碍有关.大量研究表明,低氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)是细胞在低氧条件下调节血管新生的关键因子[3-4],对下游众多促进血管新生的基因,尤其是血管内皮生长因子(vascular endothelial growth factor,VEGF)有重要的调控作用[5].Dengler等[6]的研究表明,低氧可上调HIF-1α表达,进一步上调VEGF的表达,但高糖(葡萄糖)条件下、低氧合并高糖条件下HIF-1α和VEGF的表达情况及对大鼠心肌微血管内皮细胞(cardiac microvascular endothelial cells,CMEC)新生功能的影响报道尚少.本研究应用高糖及低氧条件下培养大鼠CMEC模拟2型糖尿病缺血心肌微血管的病理状态,旨在探究高糖、低氧、高糖合并低氧时CMEC的HIF-1α和VEGF的mRNA表达水平及其增殖、迁移、成管能力的变化.
1 材料和方法
1.1 材料
1.1.1 主要试剂与耗材
内皮细胞专用培养基(endothelial cell medium,ECM)(货号1001)购自美国Sciencell公司;胎牛血清(fetal bovine serum,FBS)(货号16000-044)、青链霉素混合液(货号15140-122)、胰蛋白酶(货号25200056)、无糖DMEM培养基(货号11966)购自美国Gibco公司;Ⅱ型胶原酶(货号C6885)、葡萄糖(glucose,Glu)(货号G7528)、DAPI染色液(货号S0091)购自美国Sigma公司;兔抗大鼠CD31多克隆抗体(货号77699)、FITC标记的羊抗兔IgG(货号4412)购自美国CST公司;CCK8试剂盒(货号CK04)购自日本同仁研究所;5×PrimeScript RT Master Mix(货号RR036A)、TB GreenTMPremix Ex TaqTMII(货号RR820)购自日本TaKaRa公司;transwell小室(货号3421)、Matrigel 基质胶(货号356234)、离心管(货号430791)、细胞培养板(货号3599/3524/3516)、培养皿(货号430166/430167)、200目网状过滤器(货号352340)购自美国Corning公司;水合氯醛(货号S24149)购自北京鼎国生物有限公司;质量分数为4%的多聚甲醛(货号P0099)、体积分数为1%的Triton X-100(货号ST795)购自中国碧云天公司.
1.1.2 实验动物
SPF级雄性SD大鼠10只,12周龄,体质量为250~300 g,由广州中医药大学实验动物中心提供,许可证号:SCXK(粤)20130034.
1.2 实验方法
1.2.1 SD大鼠心脏CMEC的分离培养
参考Nishida等[7]消化分离大鼠CMEC的方法.用质量分数为10%的水合氯醛0.3 mL/100 g麻醉处死SD大鼠后取其左心室,在体积分数为70%的乙醇中浸泡30 s,HBSS缓冲液清洗3遍,将心肌组织在质量分数为0.2%的Ⅱ型胶原酶中剪碎,在37 ℃振荡水浴中温育30 min,加入质量分数为0.02%的胰蛋白酶后继续水浴震荡30 min,然后终止消化,200目网状过滤器过滤消化后的液体,在25 ℃下,100 g/min离心5 min,将细胞悬浮于ECM完全培养基(ECM基础培养基+体积分数为5%的胎牛血清+体积分数为1%的内皮细胞生长添加物+体积分数为1%的青链霉素混合液)中,接种于用层粘连蛋白预处理45 min的培养皿中,37 ℃、体积分数为5%的CO2培养箱中培养4 h后,弃去未贴壁细胞,继续培养24 h后换液,之后每3 d换液,待细胞生长融合至80%后,用体积分数为0.25%的胰蛋白酶消化传代.取第3代细胞用于实验.
1.2.2 CMEC的鉴定
细胞消化传代接种于放有细胞爬片的培养皿中,待细胞生长融合至80%,弃去培养基,质量分数为4%的多聚甲醛固定10 min,体积分数为1%的Triton X-100破膜10 min,PBS洗3次后加入正常羊血清室温封闭30 min,滴加兔抗大鼠CD31抗体于湿盒内4 ℃孵育过夜,PBS洗3次,加入羊抗兔二抗后避光室温孵育50 min,用PBS洗3次,加入DAPI染色液,避光室温孵育10 min,PBS洗3次,晾干后滴上适量的抗猝灭封片剂,盖上载玻片,避免气泡,荧光显微镜观察结果并拍照.
1.2.3 CMEC的分组处理
将培养的CMEC分为4组,每组培养时均用ECM完全培养基,在加处理因素前12 h换为无血清无糖DMEM培养基,具体分组见表1:
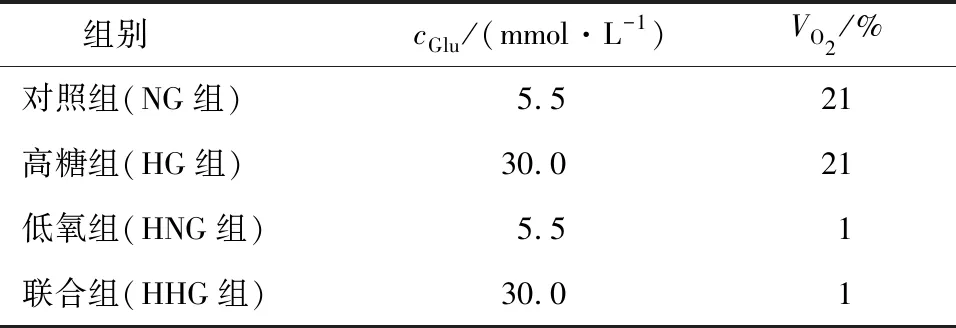
表1 分组处理情况Table 1 The process of the groups
1.2.4 Real-time PCR法检测CMEC的HIF-1α、VEGF的mRNA表达水平
每组再培养48 h后,采用Trizol法提取各组细胞总RNA,紫外分光光度计测定RNA纯度及浓度,使用TaKaRa逆转录试剂盒逆转录合成cDNA,随后使用TaKaRa扩增试剂盒进行PCR扩增.HIF-1α的上游引物为5′-ACAGCACATTCA-CAGCTCCCCA-3′,下游引物为5′-TGTGGCTACC-ATGTACTGCTGGC-3′;VEGF的上游引物为5′-GGAGTACCCCGATGAGATAGAGT-3′,下游引物为5′-CTATGTGCTGGCTTTGGTGAG-3′;内参β-actin的上游引物为5′-TCAGGTCATCACTATC-GGCAAT-3′,下游引物为5′-AAAGAAAGGGTG-TAAAACGCA-3′,在荧光定量PCR仪上的扩增条件是:95 ℃ 30 s、95 ℃ 5 s、60 ℃ 30 s、95 ℃ 15 s、60 ℃ 1 min,共循环40次.用2-ΔΔCt法计算mRNA相对表达量.
1.2.5 CCK-8法检测CMEC的增殖能力
每组加处理因素再培养48 h后,使用体积分数为0.25%的胰蛋白酶消化收集细胞制成单细胞悬液,把细胞浓度调整为 2×104个/mL.在96孔板每孔中接种100 μL的细胞悬液,37 ℃、体积分数为5%的CO2培养箱中培养24 h,然后向每孔中加入10 μL CCK8溶液,继续培养2 h,酶标仪测定450 nm处的OD值.
1.2.6 transwell小室实验检测CMEC的迁移能力
每组加处理因素再培养48 h后,使用体积分数为0.25%的胰蛋白酶消化收集细胞制成单细胞悬液,把细胞浓度调整为 5×105个/mL.按每孔5×104个细胞接种于transwell侵袭小室的上室,而在下室内加入500 μL ECM完全培养基,在37 ℃培养箱中培养12 h,然后取出小室,用棉签将上室内细胞轻轻擦拭干净,用甲醇室温固定20 min,再用质量分数为0.1%的结晶紫染色3 min,用PBS冲洗干净后晾干,在×100显微镜下观察拍照.
1.2.7 体外小管形成实验检测CMEC的成管能力
48孔培养板、200 μL枪头、基质胶4 ℃过夜预冷,用预冷的枪头加100 μL基质胶于预冷48孔培养板中,37 ℃包被30 min.每组加处理因素再培养48 h后,使用体积分数为0.25%的胰蛋白酶消化收集细胞制成单细胞悬液,把细胞浓度调整为 2×105个/mL,每孔接种200 μL单细胞溶液,继续培养12 h.在倒置显微镜下随机选取5个视野,使用Image-Pro计数由内皮细胞围成完整的毛细血管管腔的数量.
1.2.8 统计学方法
2 结果
2.1 CMEC的鉴定
DAPI(蓝色荧光)和CD31(绿色荧光)双染色后,CMEC会双阳性表达.荧光染色结果显示,所分离细胞中双阳性表达的细胞数目占总细胞数目的95%以上,可进行下一步实验(图1).
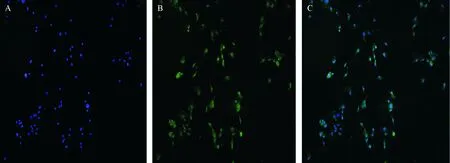
A:DAPI染色后细胞核可见蓝色荧光;B:CD31染色后细胞浆可见绿色荧光;C:A、B合成图
A:Blue fluorescence can be seen in the nucleus after DAPI staining;B:Green fluorescence can be seen in cytoplasm after CD31 staining;C:A, B Composite picture
图1 荧光染色鉴定心脏微血管内皮细胞(×100)
Fig.1 Assessment of cardiac microvascular endothelial cells with fluorescent staining (×100)
2.2 各组细胞HIF-1α和VEGF的mRNA表达
HIF-1α的mRNA表达水平在NG组与HG组之间、HNG组与HHG组之间无统计学差异(P>0.05),表明氧气的体积分数相同时,高糖对CMEC的HIF-1αmRNA表达影响不明显; HNG组HIF-1α的mRNA表达水平明显高于NG组(P<0.05),HHG组HIF-1α的mRNA表达水平明显高于HG组(P<0.05),表明糖的浓度相同时,低氧可促进CMEC的HIF-1αmRNA表达(图2).
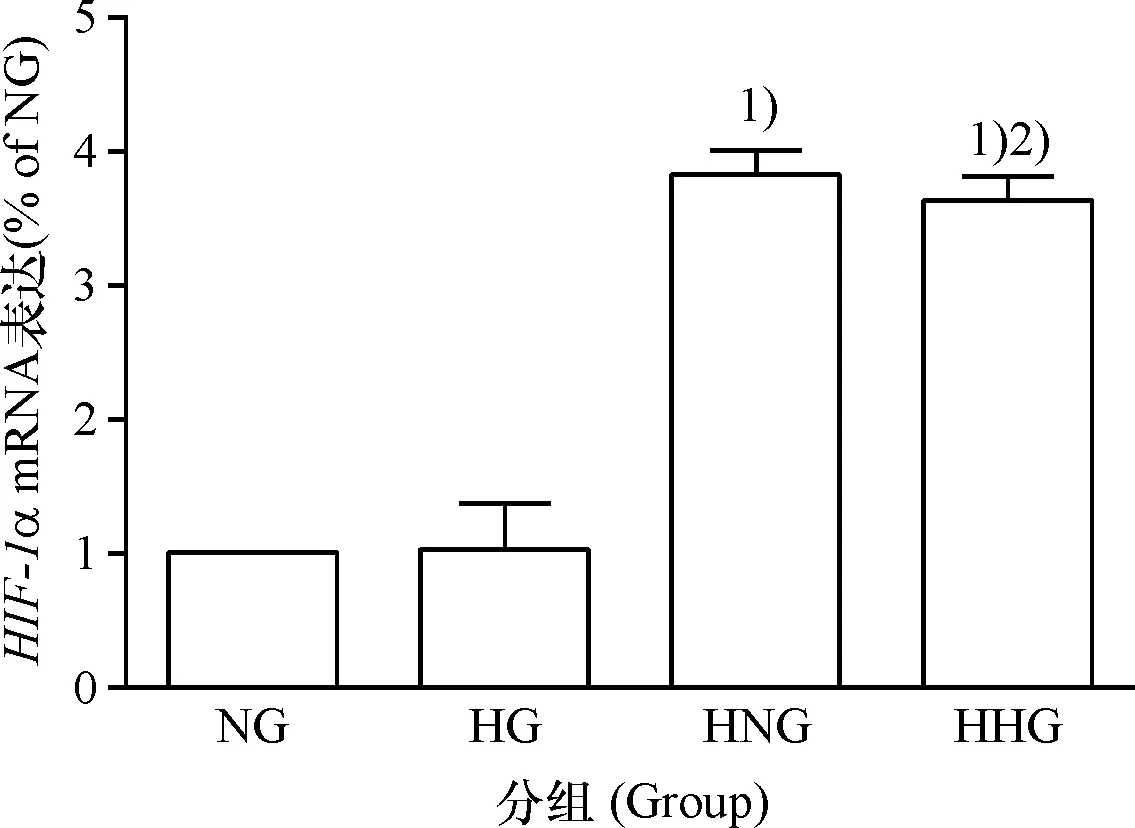
1)与NG组比较,P<0.05;2)与HG组比较,P<0.05
NG组VEGF的mRNA表达水平高于HG组,但无统计学差异(P>0.05),HNG组VEGF的mRNA表达水平明显高于HHG组(P<0.05),表明氧气的体积分数相同时,高糖可抑制CMEC的VEGFmRNA表达;HNG组VEGF的mRNA表达水平明显高于NG组(P<0.05),HHG组VEGF的mRNA表达水平明显高于HG组(P<0.05),表明糖的浓度相同时,低氧可促进CMEC的VEGFmRNA表达(图3).
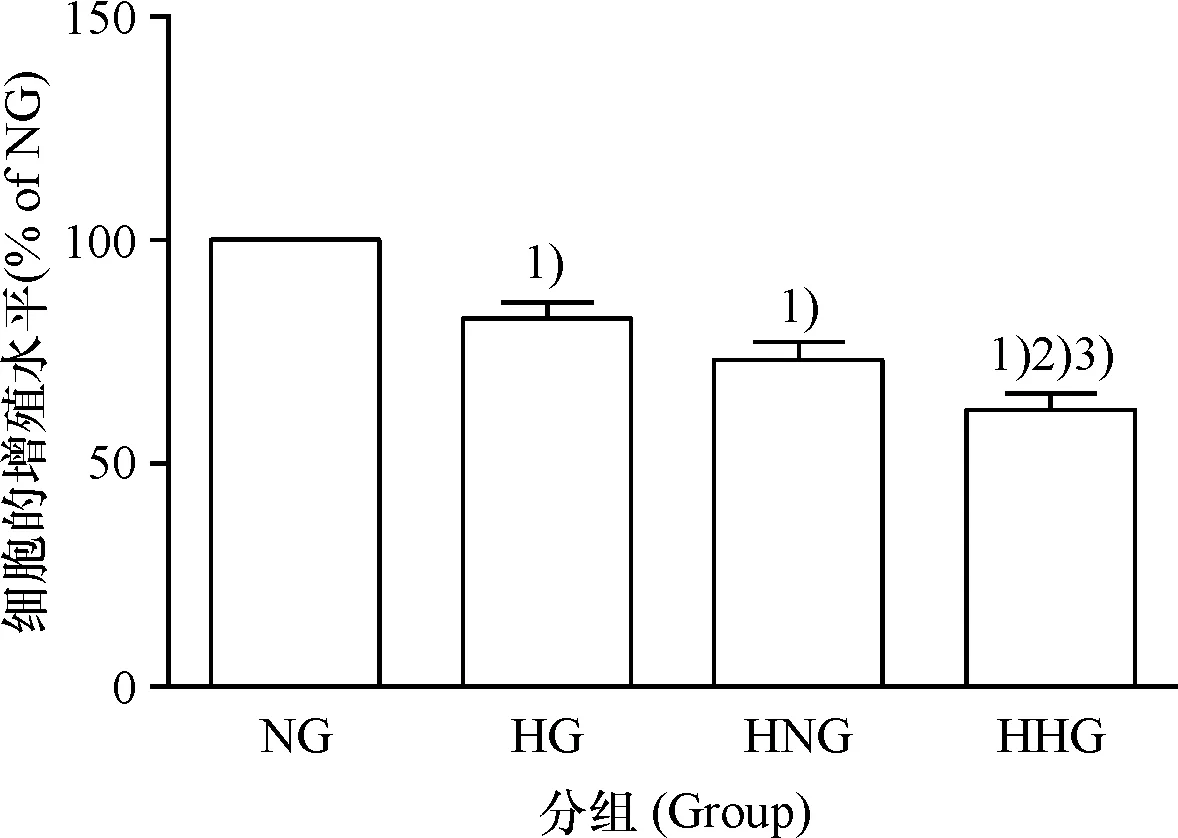
2.3 各组细胞的增殖能力
NG组细胞的增殖能力明显高于HG组(P<0.05),HNG组细胞的增殖能力明显高于HHG组(P<0.05),表明氧气的体积分数相同时,高糖可抑制CMEC增殖;NG组细胞的增殖能力明显高于HNG组(P<0.05),HG组细胞的增殖能力明显高于HHG组(P<0.05),表明糖的浓度相同时,低氧可抑制CMEC增殖(图4).
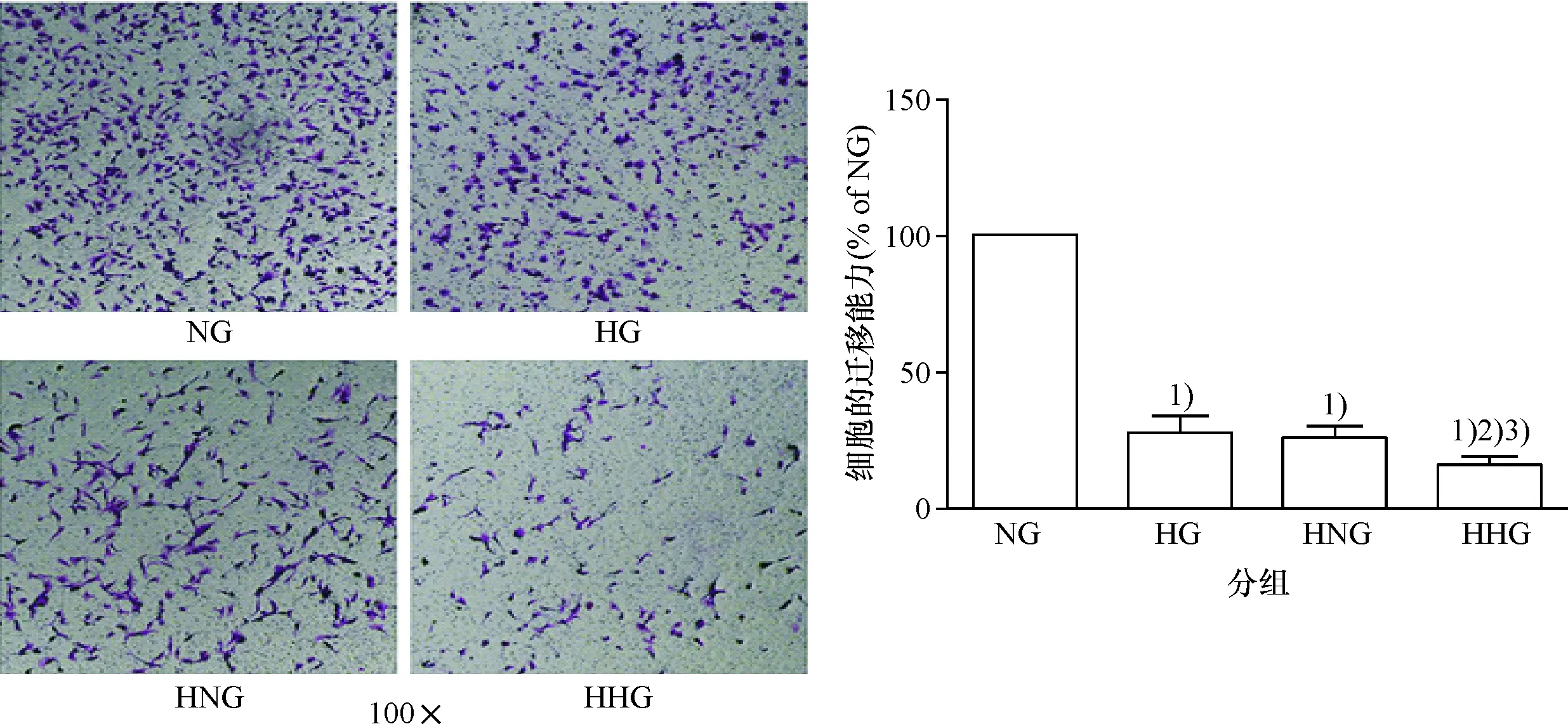
2.4 各组细胞的迁移能力
NG组细胞的迁移能力明显高于HG组(P<0.05),HNG组细胞的迁移能力明显高于HHG组(P<0.05),表明氧气的体积分数相同时,高糖可抑制CMEC迁移;NG组细胞的迁移能力明显高于HNG组(P<0.05),HG组细胞的迁移能力明显高于HHG组(P<0.05),表明糖的浓度相同时,低氧可抑制CMEC迁移(图5).
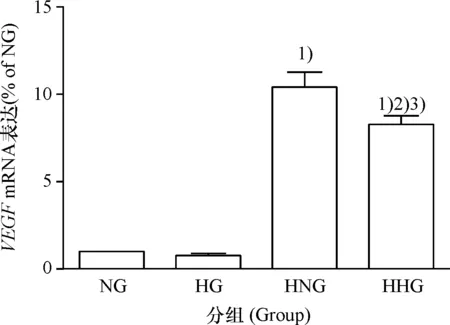
1)与NG组比较,P<0.05;2)与HG组比较,P<0.05;3)与HNG组比较,P<0.05
图3VEGF的mRNA表达水平
Fig.3 The expression level ofVEGFmRNA
1)与NG组比较,P<0.05;2)与HG组比较,P<0.05;3)与HNG组比较,P<0.05
图4 细胞的增殖能力
Fig.4 The proliferation of the cells
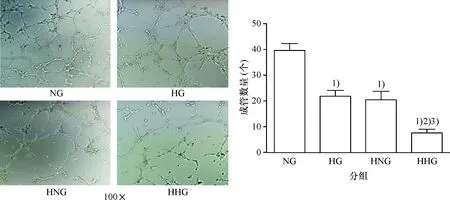
2.5 各组细胞的成管能力
NG组细胞的成管能力明显高于HG组(P<0.05),HNG组细胞的成管能力明显高于HHG组(P<0.05),表明体积分数相同时,高糖可抑制CMEC小管形成能力;NG组细胞的成管能力明显高于HNG组(P<0.05),HG组细胞的成管能力明显高于HHG组(P<0.05),表明糖的浓度相同时,低氧可抑制CMEC小管形成能力(图6).
1)与NG组比较,P<0.05;2)与HG组比较,P<0.05;3)与HNG组比较,P<0.05
1)与NG组比较,P<0.05;2)与HG组比较,P<0.05;3)与HNG组比较,P<0.05
3 讨论
CMEC对调节血管内平衡有至关重要的作用,不但可以为血管提供一个功能性屏障,还可参与血管舒缩功能的调节,对血管壁抗血小板、抗炎、抗增殖和抗氧化信号的调控也有重要作用[8].2型糖尿病会损害心肌微血管血管内皮细胞,导致血管新生障碍,心肌微血管生成不足,心脏毛细血管密度降低,侧支循环减少,心肌处于缺血缺氧状况,从而增加了心血管疾病的发生风险.Marfella等[9]研究表明,链脲佐菌素(streptozotocin,STZ)诱导的2型糖尿病大鼠结扎左冠状动脉前降支复制心肌梗死模型后,其心肌梗死面积大于非糖尿病大鼠和血糖控制良好的糖尿病大鼠,进一步研究发现,这与HIF-1α的基因表达减少有关.Catrina等[10]研究发现,糖尿病动物模型的伤口中HIF-1α和HIF-1靶基因的水平降低,导致细胞缺氧、伤口愈合时间延长.HIF-1α广泛参与多种基因转录的调控,在低氧环境下,HIF-1α与靶基因低氧反应元件结合,促进包括VEGF在内的众多血管生成因子基因的转录翻译及心肌的能量代谢[11].因此推测高糖通过影响HIF-1α的表达而引起VEGF的表达减少,可能是糖尿病患者心肌微血管新生障碍的发生机制.
本研究在不同浓度的葡萄糖和不同体积分数的氧气的条件下培养大鼠CMEC,检测促血管生成因子HIF-1α和VEGF的mRNA表达和CMEC增殖、迁移、成管能力的变化.Real-time PCR结果表明,葡萄糖的浓度相同时,低氧环境中HIF-1α和VEGF的mRNA表达水平均明显高于常氧,提示低氧是促进HIF-1αmRNA表达的重要因素,HIF-1αmRNA表达增强,促进了下游VEGF的表达.氧气的体积分数相同时,葡萄糖浓度的高低对HIF-1α的mRNA表达没有显著影响,而高糖则会降低VEGF的mRNA表达,可能的机制是,高糖不会影响HIF-1α的基因表达,但是可能会降低HIF-1α的转录活性.那么,高糖是通过什么机制降低HIF-1α的转录活性的?有研究表明,高糖的作用可以被甘露醇模拟代替[12],提示可能与渗透压升高有关;Botusan等[13]的研究认为糖尿病大鼠心肌HIF-1α与下游基因结合的活性降低,会使其目的基因如VEGF表达下降;也有研究显示,高糖条件下糖代谢异常导致细胞和血浆中甲基乙二醛(methylglyoxal,MGO)水平升高,影响了HIF-1α蛋白与P300/CBP蛋白的聚合,使得VEGF的上调受到抑制[14].
缺氧是对机体的一种损伤,组织发生缺血缺氧时能量利用会发生障碍,无氧代谢产物蓄积,细胞功能紊乱甚至导致组织坏死.但是正常机体对缺氧是有代偿作用的,比如,在发生心肌梗死时,心脏血管新生正向调节因子表达会增强,启动血管新生过程,建立侧支循环[15].然而糖尿病患者对缺氧的反应会减弱,已有临床研究和实验结果表明,伴有2型糖尿病的心肌梗死患者,心肌组织的毛细血管密度明显降低,梗死面积增加,并且更容易发生心梗后心绞痛以及充血性心力衰竭[9].高糖会促进血管内皮细胞活性氧家族(reactive oxygen species,ROS)的生成,激活蛋白激酶C通路或晚期糖基化终产物形成通路等,从而诱导CMEC损伤[16-17].这些与本实验中发现高糖和低氧环境损伤CMEC的增殖能力、迁移能力和小管形成能力是一致的.
综上所述,高糖不但降低了缺氧环境下大鼠CMEC促血管生成因子的基因表达,而且损伤了细胞的增殖、迁移和小管形成能力,提示我们,对于2型糖尿病合并心肌缺血患者,可以通过强化控制血糖及外源补充促血管生成相关因子来减轻高糖低氧对CMEC新生能力的影响,减轻临床症状、改善预后,为2型糖尿病合并缺血性心脏病的研究提供新的思路.但是,HIF-1α下游信号分子错综复杂,许多通路尚不能完全阐明,故仍有许多问题等待解决.
