ZP2蛋白在小鼠卵巢颗粒细胞中的表达
2019-05-10谢妍迟恒乜春城曹佐武
谢妍, 迟恒, 乜春城, 曹佐武
(1. 广东省中医院 生殖医学科, 广东 广州 510006; 2. 暨南大学 发育与再生生物学系, 广东 广州 510632; 3. 哈励逊国际和平医院, 河北 衡水 053000)
透明带(zona pellucida, ZP)是包裹在哺乳动物卵细胞外的一层糖蛋白外壳,在卵细胞发育和受精过程中起着重要的作用.小鼠透明带由ZP1、ZP2、ZP3等糖蛋白组成,其中小鼠ZP3是第一精子受体, ZP2是精子的第二受体,小鼠ZP2、ZP3多肽分别由定位于7号、5号染色体上的单拷贝基因编码[1-2].
起初的实验研究显示,透明带是由卵母细胞唯一表达产生的[3-4],但是后来对许多其他动物的研究发现颗粒细胞也参与透明带的发生.有实验显示,包括狗[5]、猴[6-7]和兔[8]等其他哺乳动物,卵泡颗粒细胞参与表达透明带.对于最常用的实验动物小鼠的透明带来源,目前的主流理论仍然认为,小鼠透明带由卵母细胞唯一产生[9-10],颗粒细胞不产生透明带.本研究小组早期研究结果显示,小鼠ZP2mRNA在卵泡颗粒细胞有较强的表达[11],提示小鼠卵巢颗粒细胞也可能有ZP2蛋白表达.利用基因重组的小鼠ZP2肽段,制备抗ZP2的抗体[12],本研究目的是利用小鼠ZP2 抗体探讨小鼠卵巢颗粒细胞是否表达ZP2蛋白,以确定卵透明带的生物发生来源.
1 材料与方法
1.1 实验材料
昆明小鼠(8~12周龄)购自广东省医用实验动物场,正常山羊血清购自武汉谷歌生物科技有限公司,兔抗小鼠ZP2的多克隆抗体为自制,异硫氰酸荧光素(fluorescein isothiocyanate isomer,FITC)标记的羊抗兔IgG由武汉博士德生物工程有限公司生产,包埋剂OCT(optimal cutting temperature compound)购自北京普利莱基因技术有限公司,多聚甲醛(paraformaldehyde,PFA)购自上海化学试剂厂.
1.2 实验方法
1.2.1 小鼠卵巢组织冰冻切片
快速处死正常昆明白雌鼠,冰上取卵巢组织,投入到新鲜配制的体积分数为4%PFA溶液中,4 ℃固定2 h,然后转入体积分数为30%蔗糖溶液中,4 ℃冰箱中过夜.次日取已经固定和脱水好的小鼠卵巢若干个,用包埋剂OCT包埋,按4 μm的厚度切片,依次贴片,切片在40 ℃烘箱中烤片过夜后存放于-80 ℃冰箱中.使用时先室温解冻,然后在40 ℃烤片2 h以上.
1.2.2 小鼠卵巢组织冰冻切片免疫荧光实验
取前后相邻的两张小鼠卵巢组织冰冻切片,1张作为实验组,1张作为阴性对照组,各滴加封闭液孵育10 min.然后去除实验组组织切片上的封闭液,滴加1∶100比例稀释的兔抗小鼠ZP2的抗体,37 ℃下孵育2 h,对照组切片继续在封闭液中孵育2 h.然后用TBS-Tween溶液(Tris-buffered saline-Tween 20 solution, TBST)洗涤两组切片,每次5 min,共洗涤3次.再同时向两张组织切片滴加1∶100比例稀释的FITC标记的羊抗兔IgG,37 ℃下孵育30 min.用TBST洗涤3次后在荧光倒置显微镜下观察,选定区域分别在白光和荧光下拍照,实验组与对照组切片的对应区域分别同时拍照,并选定相同条件和曝光时间拍摄荧光照片.随后对免疫荧光实验后的小鼠卵巢组织切片进行苏木精-伊红(hematoxylin-eosin, HE)复染,两组切片的对应位置拍照.
1.2.3 小鼠卵泡内的颗粒细胞荧光信号灰度计算
参照HE照片,从实验组与对照组的切片中选取对应卵泡的颗粒细胞区进行荧光信号的灰度比较.使用Photoshop CS6软件将HE照片与先前拍摄的白光照片叠合,从HE图片中选择合适的生长卵泡的颗粒细胞区,然后借助白光照片从相同位置的荧光照片上选取对应的荧光图像.同法在对应的对照组切片的HE照片上选取对应的颗粒细胞区,进一步在原先拍摄的对照组荧光图片上选取相同面积的图像,通过Image J软件计算对应的对照组和实验组的荧光图像的灰度值.通过Image J软件计算分别从7张实验组与对照组的卵巢切片中获得的45组不同卵泡区域的颗粒细胞片区的数据进行比较.
1.3 统计学处理
2 结果
2.1 抗小鼠ZP2抗体与小鼠卵巢透明带的结合
通过免疫荧光实验,检测到卵透明带信号,并验证兔抗小鼠ZP2抗体对小鼠卵泡透明带的特异反应以及ZP2在卵巢切片上的定位(图1).相邻两张卵巢切片的对应区域的卵泡结构,经过HE染色后显示出卵细胞和颗粒细胞,分别进行免疫荧光标记后实验组卵巢切片显示特异的免疫荧光信号,形态上与卵透明带区对应.结果表明兔抗小鼠ZP2抗体成功标记了小鼠卵泡透明带的ZP2成分.
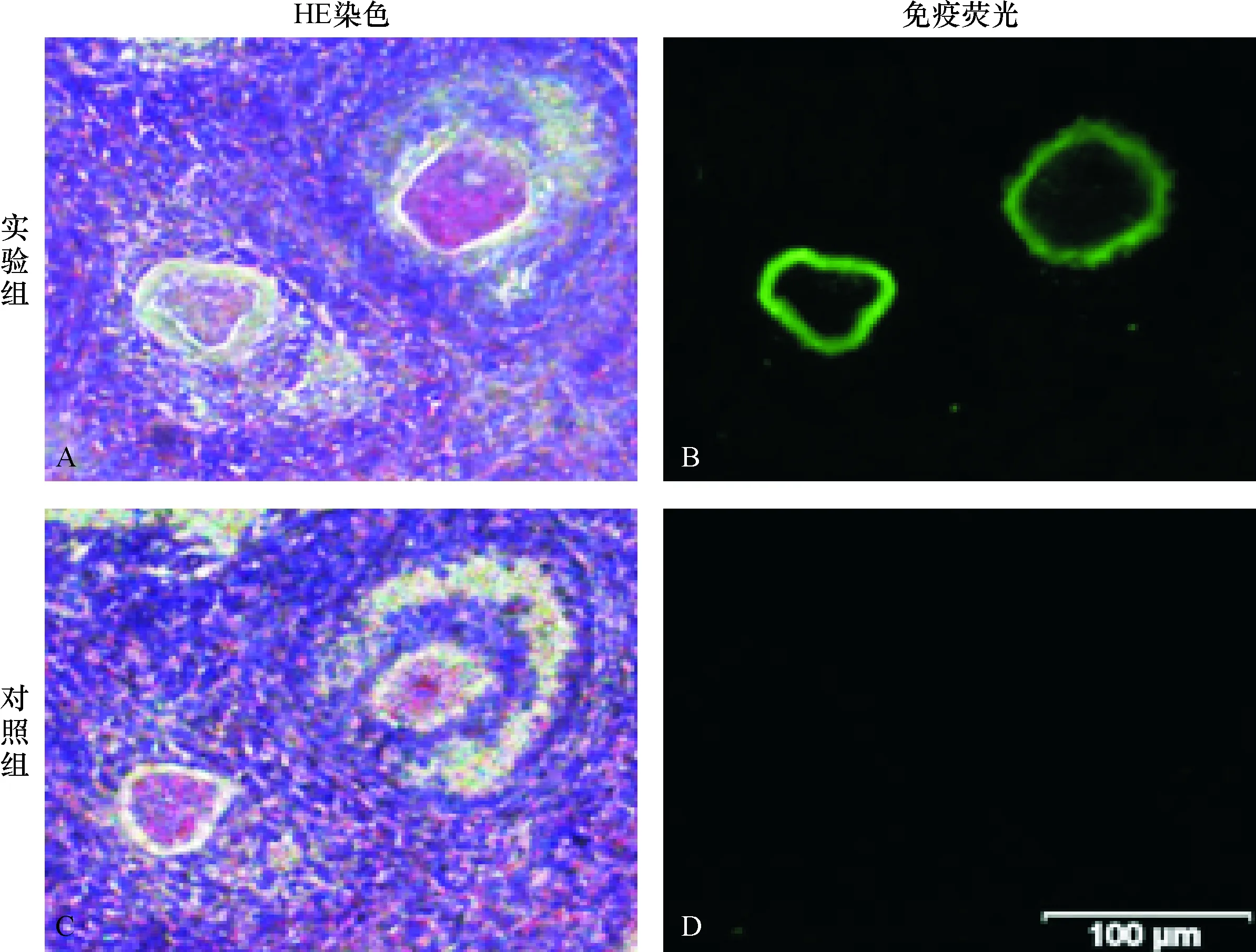
A:实验组卵巢切片的HE染色照片;B:实验组卵巢切片的荧光照片;C:对照组卵巢切片的HE染色照片;D:对照组卵巢切片的荧光照片.比例尺: 100 μm.
A: HE staining photograph of ovarian section of test group; B: Fluorescent photograph of ovarian section of test group; C: HE staining photograph of ovarian section of control group; D: Fluorescent photograph of ovarian section of control group. Scale bar: 100 μm.
图1 抗mZP2抗体与卵巢切片的免疫荧光反应
Fig.1 Fluorescent immuno-reaction of ovarian sections with antibody against mZP2
2.2 卵巢组织的颗粒细胞区ZP2信号的表达
实验组或对照组切片,除卵透明带区外的其他卵泡区域,都看不出明显的信号(图1).但是,当在高倍镜下观察,并逐步增大荧光曝光度时,发现在卵泡颗粒细胞区也出现弱荧光信号.而且当增强曝光度时,对照组也可看见一定的荧光信号,不过两组的信号强度有差异(图2).
为区分真实信号与背景信号,在实验组与对照组卵巢切片中,从HE片中分别挑选出一一对应的生长卵泡,随机选取对应颗粒细胞区,再转移到对应的免疫荧光照片中选取面积相同的(25×25像素)对应区,进行灰度计算(图3).
随机从7张卵巢切片中选取45组颗粒细胞区,分别计算其灰度值,结果显示(表1),实验组颗粒细胞区的灰度平均值为(1.88±0.57),对照组的灰度平均值为(1.20±0.11).用GraphPad Prism7软件进行配对样本t检验,两组间有显著统计学差异(P<0.000 1).实验组卵泡内的颗粒
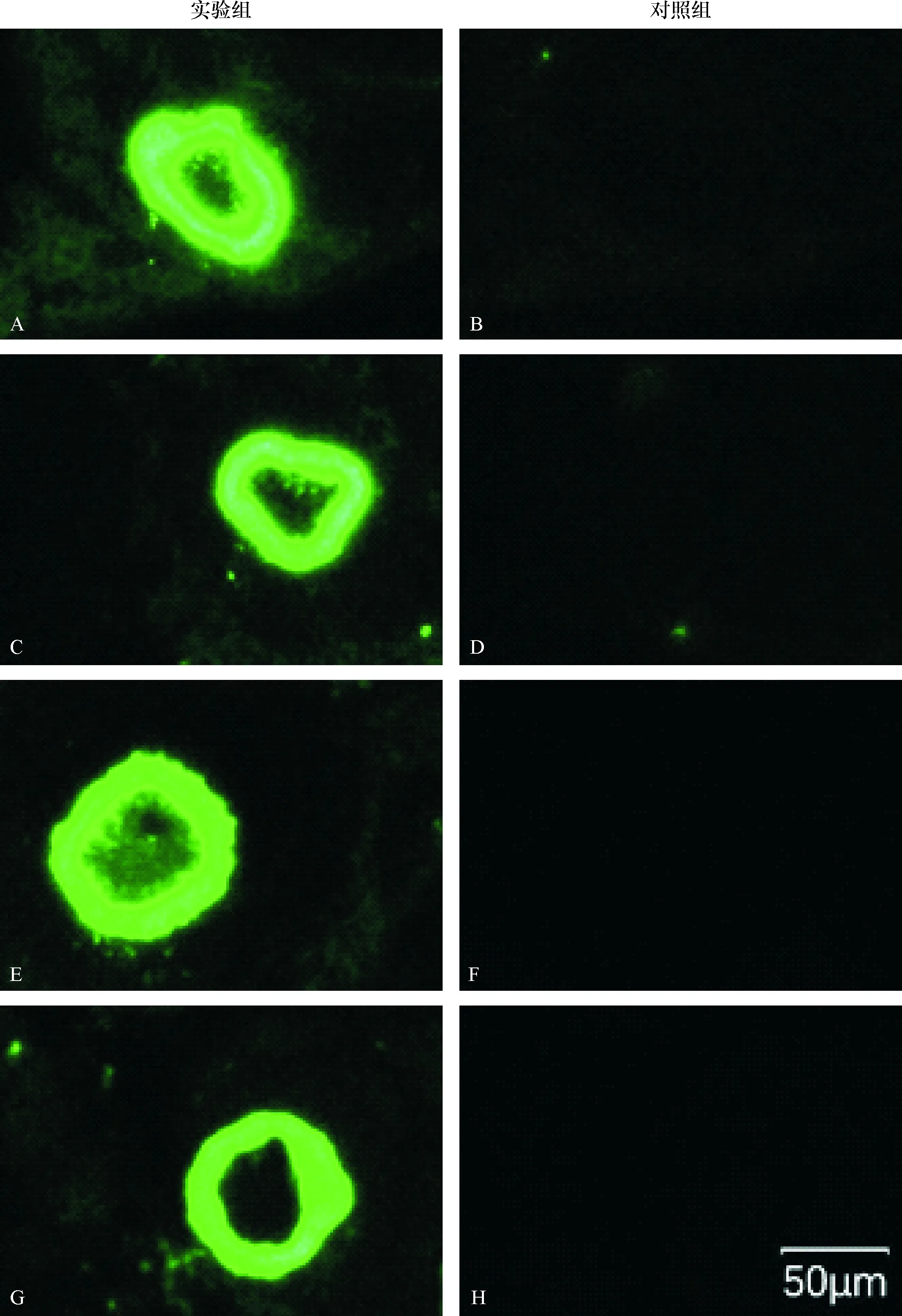
A:实验组卵巢切片1区的免疫荧光图;B:对照组卵巢切片对应1区的免疫荧光照片;C:实验组卵巢切片2区的免疫荧光图;D:对照组卵巢切片对应2区的免疫荧光照片;E:实验组卵巢切片3区的免疫荧光图;F:对照组卵巢切片对应3区的免疫荧光照片;G:实验组卵巢切片4区的免疫荧光图;H:对照组卵巢切片对应4区的免疫荧光照片.同一区的实验组和对照组的曝光量相同,比例尺: 50 μm.
A: Fluorescent photograph of zone 1 on the ovarian section of test group. B: Fluorescent photograph of zone 1 on the ovarian section of control group.C: Fluorescent photograph of zone 2 on the ovarian section of test group. D: Fluorescent photograph of zone 2 on the ovarian section of control group.E: Fluorescent photograph of zone 3 on the ovarian section of test group. F: Fluorescent photograph of zone 3 on the ovarian section of control group.G: Fluorescent photograph of zone 4 on the ovarian section of test group. H: Fluorescent photograph of zone 4 on the ovarian section of control group.Identical exposure is applied to the test group and control group of the same zone.Scale bar: 50 μm.
图2 实验组和对照组的小鼠卵巢切片的免疫荧光增强图
Fig.2 The highlighted fluorescent photographs of mouse ovarian sections following immunohistochemical assay
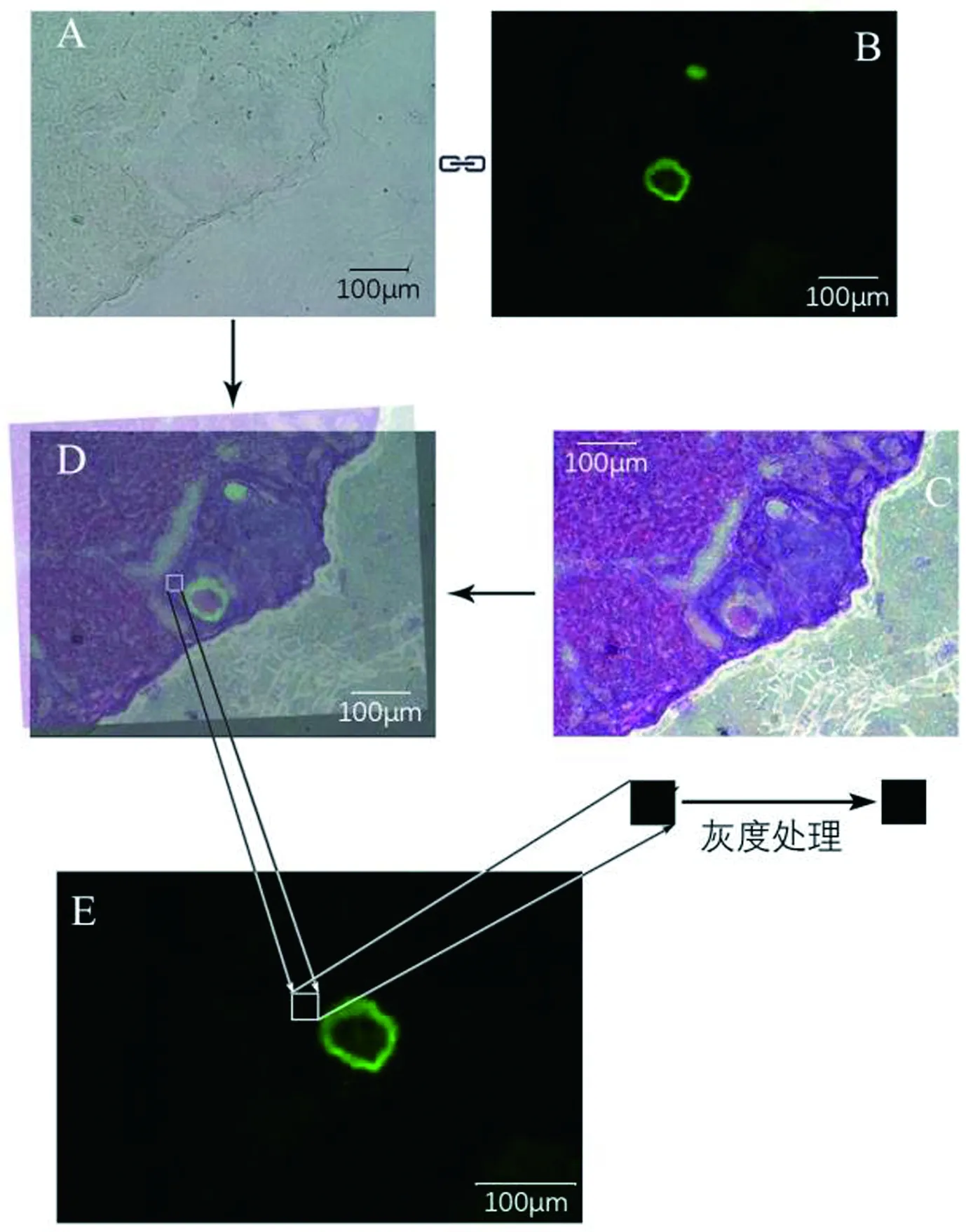
A和B分别是免疫荧光标记后的卵巢切片相同区域的白光照片和荧光照片,C:免疫荧光实验后进行HE复染后对应区拍摄的照片,D:按照卵泡结构将A、B、C叠合的复合图片,E:按照在HE照片上选取的颗粒细胞区域在对应的荧光照片上选取图像进行灰度计算.
White Light photograph (A) & Fluorescent photograph (B) of the same field on the ovarian sections following fluorescent immuno-histochemical assay. HE staining photograph (C) of the corresponding field of the ovarian section after fluorescent immunohistochemical assay. Merged picture (D) on the same field of A, B, C based on the follicle location. Sampling for gray value calculation(E) on the field of the fluorescent photograph layer of the merged picture, corresponding to the pre-selected granulosa cell zone of the HE staining photograph.
图3 灰度计算取样图
Fig.3 The flow chart of sampling for the gray value calculation
表1 实验组和对照组的荧光照片对应的颗粒细胞区的荧光信号灰度值
Table 1 The gray values of fluorescent signals in the granulosa cell zones of the fluorescent photographs of test group and control group
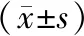

分组视野个数灰度值实验组451.88±0.57对照组451.20±0.11
细胞区的荧光信号强于对照组的卵泡颗粒细胞内的背景荧光信号,两组数据平均值的差值为0.68,实验组的灰度值比对照组的灰度值高56.67%,说明卵泡颗粒细胞表达了ZP2蛋白.根据所得的数据分析,实验组与对照组的卵泡内背景信号确实存在差异,也提示卵泡内的颗粒细胞存在ZP2蛋白的表达.
3 讨论
透明带是生长卵泡产生的一层细胞外壳,对卵细胞和早期胚胎都有重要作用,因此一直受到特别关注.近年的生殖医学研究还发现,透明带的表达还可作为卵细胞受精能力的一个预测指标[13].而透明带基因的突变与女性的卵泡发育和人类的生育能力有关[14-16].因此了解卵透明带的产生有重要的意义.
早期的研究发现,卵细胞能产生透明带[17-19],即使培养没有卵泡细胞的裸卵也能形成透明带.而通过常规的影像观察和透明带蛋白电泳分析,看不到卵巢颗粒细胞有明显的透明带成分,因此认为,小鼠卵透明带是卵细胞唯一产生的.但是卵透明带是细胞内的蛋白产物分泌到细胞外不断堆积形成的一个突出的结构,因此研究它的形成需要进行细致的量化分析和动态思考.本研究用兔抗小鼠ZP2抗体进行小鼠卵巢切片的免疫荧光反应,可显示卵巢切片的透明带区有明显的荧光信号,提示成功标记小鼠卵泡透明带的ZP2成分,但通常肉眼很难辨认颗粒细胞区的荧光信号,因此,按照常规的影像观察可能判断颗粒细胞没有透明带蛋白.但如果逐步调高曝光度,当增强至适当高时,颗粒细胞区也可显示出信号,只不过强度比透明带区弱许多.为了区分阳性信号与背景信号,随机测量对照组和实验组对应区的灰度,通过对不同区域的灰度进行统计分析后可以发现实验组颗粒细胞区的信号比对照组的信号强,显示出实验组与对照组的信号强度的差距.实验组的平均灰度值比对照组的灰度值高56.67%,证明卵泡内的颗粒细胞表达了ZP2蛋白,颗粒细胞不仅转录ZP2的mRNA,这些mRNA也能合成出蛋白质,说明颗粒细胞也是透明带的发源地.
但与通常观察到透明带区信号相比,颗粒细胞区的荧光信号还是非常弱,颗粒细胞中表达的ZP2是否是透明带成分的主要来源?基因分析显示,透明带的各种成分,ZP1、ZP2、ZP3均为分泌性蛋白[2],因此表达后将被分泌到细胞外.此外,颗粒细胞体积小、核质比大,细胞质含量少,细胞中边产生边转运透明带蛋白至胞外,留存于颗粒细胞里的透明带蛋白也较少.不过,卵泡里颗粒细胞的数量较多,产生的透明带蛋白不断转移至卵细胞外的透明带区堆积,构建卵细胞与颗粒细胞之间的外壳结构.
经典理论认为透明带是卵母细胞唯一表达[3-4],但实际上通常在卵细胞内所观察到的荧光信号也较弱.因为卵细胞产生的透明带蛋白也被转运到胞外,但由于卵母细胞体积很大、是颗粒细胞的几百倍,核质比很小,细胞质含量很高,因此卵细胞中的透明带蛋白比颗粒细胞中的含量要多,显示的荧光信号也往往更强.
透明带的形成是随着卵泡发育不断积累的.颗粒细胞也随卵泡的生长不断分裂增生、数量剧增.之前的研究显示,颗粒细胞中表达的ZP2的mRNA也随卵泡生长增加[9],因此,随着卵泡生长、颗粒细胞数量增多,表达产生的透明带蛋白也不断增多.卵泡生长后期的透明带是否更多来源于颗粒细胞,还有待进一步研究.
综上,小鼠透明带ZP2并非卵母细胞唯一表达产生,小鼠卵泡颗粒细胞和卵母细胞都参与了透明带的生物合成.
