中草药添加剂对热应激虹鳟部分生化指标及激素水平的影响
2019-05-09冯淇元线婷王荻刘红柏
冯淇元 ,线婷 ,王荻 ,刘红柏
(1.中国水产科学研究院黑龙江水产研究所,黑龙江 哈尔滨 150070;2.上海海洋大学水产与生命学院,上海 201306;3.南京农业大学无锡渔业学院,江苏 无锡 214081)
虹鳟Oncorhynchus mykiss生长适宜水温为12~18℃,最适水温为16~18℃,低于8℃或高于20℃时食欲减退、停止摄食,尤其在高温环境下耐受性低、敏感度高,为典型冷水鱼类[1,2]。
温度是影响水产生物生长、代谢和发育的重要环境因子。虹鳟作为变温动物对水温的变化较为敏感,虽然其可适应一定变温环境,但却存在承受范围,超出范围就会造成鱼体损伤甚至死亡,严重制约虹鳟养殖产业的发展[3]。当机体受到高温刺激时会产生热应激反应,非特异性免疫指标、应激蛋白和组织结构发生变化[4-11]。随着全球变暖,水产动物热应激现象频繁产生。为改善热应激阻碍虹鳟健康养殖的发展,从天然、毒副作用小、可替代抗生素的中草药入手不失为一种突破壁垒的途径[12,13]。中草药含有维生素、蛋白质、氨基酸等营养物质和生物碱、多糖以及多种免疫活性物质,可使鱼抗热应激[14-17]。管标、何福林等[18,19]研究发现,热应激可使虹鳟生理生化指标发生变化,如肝脏组织受损等。孙裔雷等[20]在饲料中添加茵陈等复方制剂,改善了虹鳟肝、脾及肾脏中酶活性,有效提高了虹鳟的抗氧化能力。但是,关于柴胡、藿香及茵陈对鱼类热应激免疫机能的研究较少。马爱敏等[21]研究了柴胡对美国红鱼Sciaenops ocellatus免疫的影响,发现投喂含有2%柴胡的配合饲料28d后,提高了美国红鱼对哈维氏弧菌的免疫保护率,即有促进美国红鱼免疫功能的作用。
鱼类非特异性免疫系统在应激环境中起重要作用[22]。鱼类的营养状况、代谢水平和疾病等与其血液有密不可分的关系,当鱼体受到温度、密度、光照等环境因子胁迫时,其生理及病理会改变,通过血液指标体现出来[23,24]。本实验所选取的柴胡、茵陈、藿香三种中草药[25]具有一定的抗应激和免疫促进作用,但其机理和药理均有不同,通过研究虹鳟热应激下相关激素、酶及组织结构的变化,可以反映中草药对虹鳟热应激过程的影响,为中草药对水产动物热应激方面的研究提供参考。
1 材料与方法
1.1 材料
试验选用健康非免疫虹鳟200尾,平均体质量(30±5)g,来自辽宁省本溪市某虹鳟养殖场。实验用中草药均购自黑龙江省哈尔滨市宝丰医药,研磨充分后备用;皮质醇(COR)酶联免疫检测试剂盒、鱼肾上腺素(E)酶联免疫检测试剂盒、酸性磷酸酶(ACP)试剂盒和碱性磷酸酶(ALP)试剂盒购自南京建成生物工程研究所。
1.2 方法
1.2.1 实验分组
实验分为常温对照组、变温对照组、变温柴胡组、变温藿香组及变温茵陈组。在基础饲料中分别添加柴胡、藿香和茵陈。每组20尾鱼,设两个平行。
1.2.2 药饵的制备
实验用中草药添加剂量参照中药大辞典等医药书籍给出的剂量[25],换算成鱼体质量的添加剂量:茵陈(高浓度组30g/50kg体质量,低浓度组20g/50kg体质量)、藿香(高浓度组15g/50kg体质量,低浓度组9g/50kg体质量)、柴胡(高浓度组18g/50kg体质量,低浓度组12g/50kg体质量)。
准确称取三种中草药放入各砂锅中,参照王荻等[17]的方法制备药汁,按各自添加量均匀喷洒药汁于饲料表面后阴干,将制备好的饲料存放于4℃冰箱备用。
1.2.3 热应激处理及样品采集
虹鳟在室内循环水族箱(0.90m×0.50m×0.45m)中暂养15d,期间按照鱼体质量的3%日投喂全价基础饲料。暂养后,柴胡组、藿香组及茵陈组按照3%的日投饵率投喂药饵,常温对照组及升温对照组投喂基础饲料。
样本一:在15℃水温下连续投喂7d,停食1d后采集样。
样本二:从样本一时间点缓慢升温至20℃,采集样本。
样本三:持续投喂5d,停食1d,采集样本。
样本四:从样本三的时间点缓慢升温至25℃,采集样本。
样本五:持续投喂3d(期间试验鱼已开始出现死亡),停食1d,采集样本。
用经0.3g/100mL的肝素钠润洗的2.5mL注射器采集实验鱼尾静脉血液。血样转移至离心管,在4℃下3 500r/min离心10min,吸取上层即为血浆,存于-20℃冰箱中备用。采集的虹鳟肝脏置于冻存管中,-20℃保存备用。另采集虹鳟的肝脏在波恩试液中固定,以用于制作组织切片。
1.2.4 各项指标的测定
将实验鱼的组织样本与预冷的生理盐水混合,按不同检测指标和试剂盒说明书要求,在冰上用高速分散匀浆机充分匀浆,取上清液进行检测。-20℃保存的血浆水浴融化即可检测。
按照南京建成生物工程研究所鱼皮质醇(Cortisol)酶联免疫检测试剂盒、鱼肾上腺素(E)酶联免疫检测试剂盒的说明书测定各项指标。
1.3 切片的制作与镜检观察
取经波恩试液固定后的组织,在梯度酒精和二甲苯中脱水透明后包埋、切片,苏木精-伊红染色(H&E),中性树胶封片,用生物显微镜(Leica DM 4000 B型)进行观察、拍照。
1.4 数据处理
数据采用SPSS 19.0软件中的单因素方差分析(One-Way ANOVA)进行统计,通过邓肯氏法多重比较分析组间差异显著性,以P<0.05为显著性判断标准。
2 结果与分析
2.1 柴胡、藿香及茵陈对热应激下虹鳟血浆中皮质醇(COR)和肾上腺素(E)含量的影响
由图1可知,在15℃正常水温时,三种中药组虹鳟血浆中COR含量均高于对照组;升至20℃初时,柴胡组鱼血浆中COR含量高于对照组,茵陈组鱼血浆中COR含量低于对照组,而藿香高、低浓度组鱼血浆COR含量均显著高于对照组(P<0.05)。20℃持续热应激后,柴胡高浓度组、藿香低浓度组及茵陈低浓度组鱼血浆COR含量明显高于对照组。升温至25℃初时,柴胡组和藿香组鱼血浆COR含量明显高于对照组,茵陈组与对照组无明显差异(P>0.05)。25℃持续热应激后,藿香低浓度及茵陈组鱼血浆COR含量明显高于对照组。在整个热应激期间,各中药组鱼血浆COR含量先上升后下降,但藿香及茵陈组COR含量的降幅小于柴胡组。
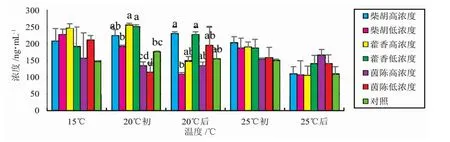
图1 中草药对热应激虹鳟血浆中皮质醇(COR)含量的影响Fig.1 The effects of Chinese herbalmedicines on cortisol levels in the plasma of rainbow trout exposed to heat stress
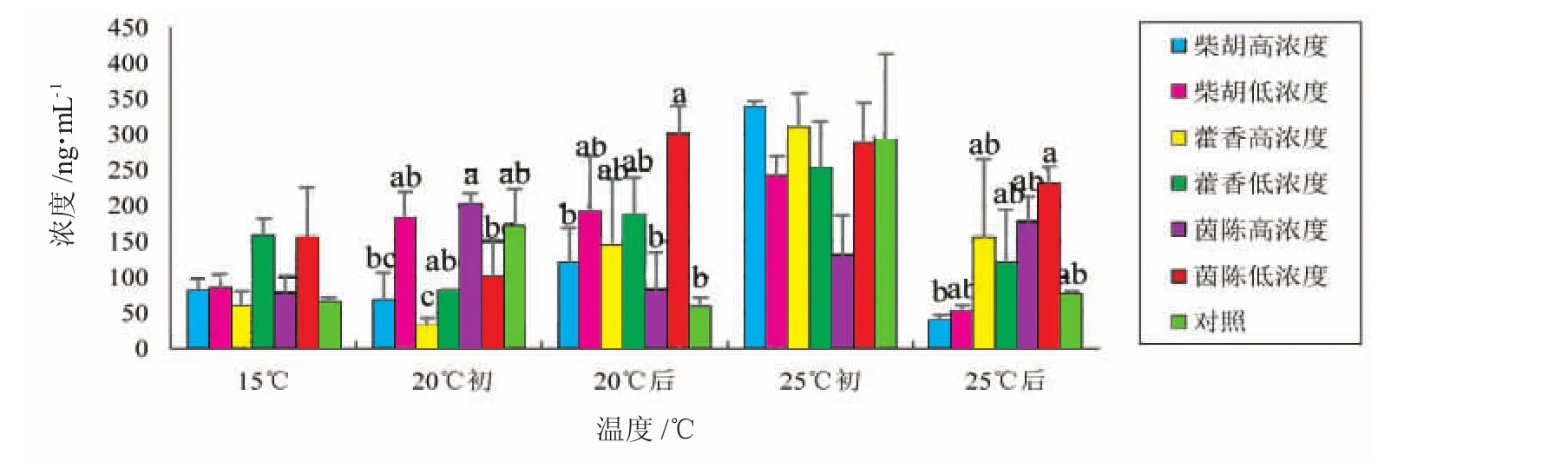
图2 中草药对热应激虹鳟血浆中肾上腺素(E)含量的影响Fig.2 The effects of Chinese herbalmedicine on epinephrine levels in the plasma of rainbow trout exposed to heat stress
由图2可知,在15℃正常水温时,柴胡组、藿香低浓度组及茵陈组虹鳟血浆E含量高于对照组;升温至20℃初时,柴胡低浓度组、茵陈高浓度组及对照组鱼血浆E含量有所升高,但柴胡低浓度组和茵陈高浓度组鱼血浆E含量均高于对照组。20℃持续热应激后,藿香组鱼血浆E含量呈上升趋势,茵陈低浓度组鱼血浆E含量明显升高,对照组鱼血浆E含量呈下降趋势。升温至25℃初时,各组鱼血浆E含量均有所升高,其中柴胡组及藿香组鱼血浆E含量上升幅度明显,且均高于同时期对照组。25℃持续热应激后,各组鱼血浆中E含量均下降,其中柴胡组鱼血浆E含量下降幅度最大,而藿香组和茵陈组鱼血浆E含量仍高于对照组。
2.2 柴胡、藿香及茵陈对热应激下虹鳟肝脏中酸性磷酸酶(ACP)和碱性磷酸酶(ALP)活性的影响
由图3可知,15℃正常水温组和升温至20℃组相比,肝脏中ACP活性没有明显变化。20℃持续热应激后,除茵陈高浓度组外,各组肝脏ACP活性有所升高外,其余呈下降趋势,且对照组的下降幅度最大。升温至15℃初时,柴胡组肝脏ACP活性有所升高,茵陈高浓度组肝脏ACP活性明显降低。25℃持续热应激后,柴胡组肝脏ACP活性降低,而藿香组及茵陈组肝脏ACP活性有所升高,均高于同时期对照组。
由图4可知,15℃正常水温组与升温至20℃初相比,各组肝脏中ALP活性均有所降低,各组间无明显差异。20℃持续热应激后,中草药组和对照组肝脏中ALP活性均有所升高,且柴胡组和对照组升高较明显。升温至25℃初时,各组肝脏中ALP活性有所下降,且对照组的下降幅度最大。25℃持续热应激后,茵陈高浓度组肝脏ALP活性显著高于其余各组(P<0.05)。
2.3 柴胡、藿香及茵陈对热应激下虹鳟肝脏组织变化的影响
由图5可知,随着温度的升高,对照组和实验组出现不同程度的受损,具体表现如下。
正常水温15℃时:对照组和茵陈组鱼肝细胞的肝索及肝血窦分布规则(图5A,图5D)。柴胡组和藿香组鱼肝细胞、细胞核清晰完整,窦间隙分布规则(图5B,图5C)。各实验组及对照组均无实质性肝损害。
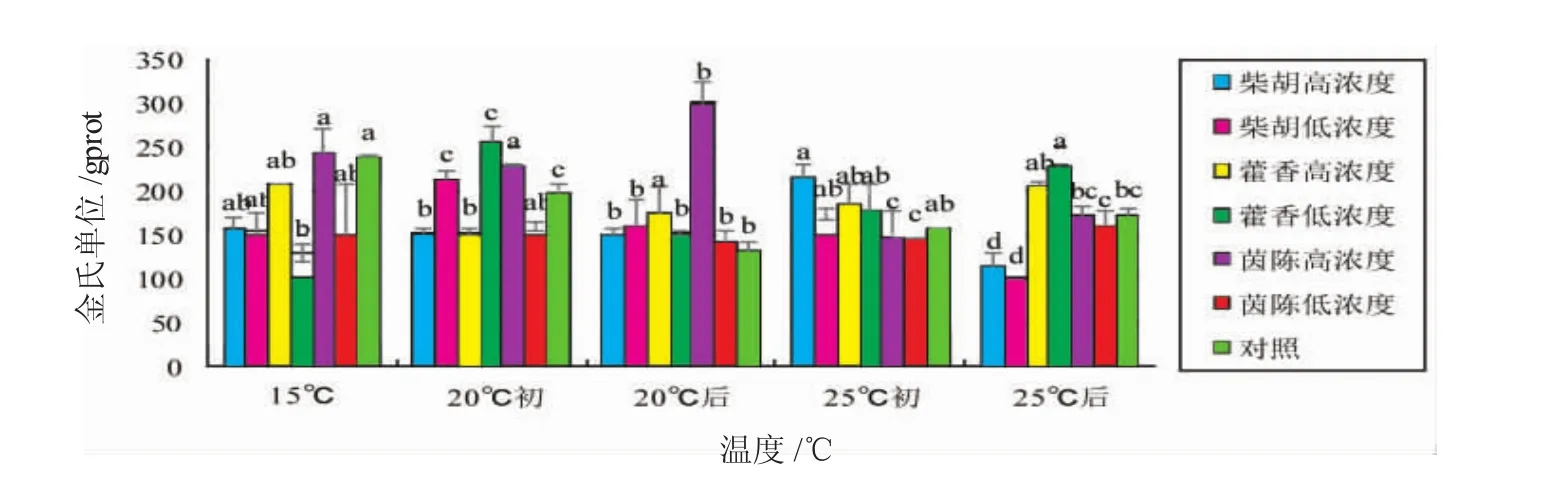
图3 中草药对热应激虹鳟肝脏中酸性磷酸酶(ACP)活性的影响Fig.3 The effects of Chinese herbalmedicines on acid phosphatase activity in the liver of rainbow trout exposed to heat stress
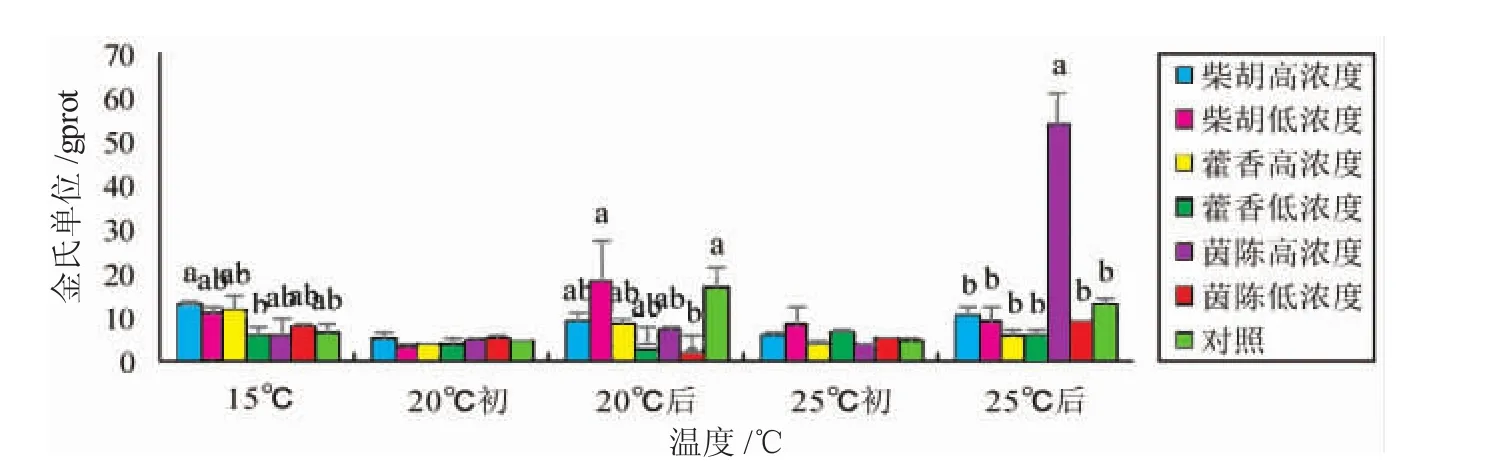
图4 中草药对热应激虹鳟肝脏中碱性磷酸酶(ALP)活性的影响Fig.4 The effects of Chinese herbalmedicine on alkaline phosphatase activity in the liver of rainbow trout exposed to heat stress
初升温到20℃时:对照组鱼肝细胞排列无序,呈明显空泡化,肝细胞萎缩,核偏移。同时,肝血窦扩张,血细胞数目增加(图5E)。柴胡组肝细胞结构完整清晰,核略偏移而消失(图5F)。藿香组鱼肝细胞呈明显空泡化,肝细胞排列无序,细胞核融合,肝血窦拥堵(图5G)。茵陈组肝细胞结构完整且清晰,部分肝细胞核偏移,无明显病变(图5H)。
持续20℃热应激后:对照组鱼肝细胞空泡化严重,肝细胞排列无序,肝血窦扩展伴随炎性细胞浸润(图5I)。柴胡组窦间隙扩大,肝细胞结构模糊(图5J)。藿香组肝细胞结构完整,部分肝细胞核偏移,伴有炎性细胞浸润(图5K)。茵陈组肝细胞结构较完整,肝血窦堵塞,部分肝细胞融合(图5L)。
持续25℃热应激后:对照组空泡化严重,伴有炎性细胞浸润,肝细胞核溶解、消失(图5M)。柴胡组呈现空泡化,细胞排列紊乱,部分肝细胞融合(图5N)。藿香组肝血窦扩张,部分肝细胞融合(图5O)。茵陈组空泡化严重、肝细胞溶解,炎性细胞浸润(图5P)。
3 讨论
3.1 柴胡、藿香及茵陈对热应激下虹鳟皮质醇(COR)、肾上腺素(E)含量的影响

图5 中草药对热应激虹鳟肝脏组织形态的影响Fig.5 The effects of Chinese herbal medicines on liver morphology of rainbow trout under heat stress
虹鳟为典型的变温水生动物,水温升高影响虹鳟血浆中皮质醇(COR)的含量。COR为应激反应中产生的一种类固醇激素,可以促进糖原、脂质及蛋白质的分解,为机体提供更多能量,以维持正常生理机能[26,27]。研究发现,细胞内不是储存COR的主要场所,当热应激时会促使机体向血液中释放大量COR,加快机体代谢来抵抗热应激。血液中COR浓度是反映鱼体应激强度的重要指标[28-30]。
本研究结果显示,在15℃正常水温时,三种中草药均可提高虹鳟血浆中COR含量,这为机体抵抗热应激提供了良好的基础。水温初升温到20℃时,藿香促进了机体向血浆中释放COR的量来抵抗热应激,而柴胡组的作用效果次之,茵陈组血浆中COR含量低于对照。这说明此热应激阶段藿香组的抗应激效果要好于柴胡组,而茵陈没有发挥药效。20℃持续热应激后,柴胡高浓度组、藿香低浓度组及茵陈低浓度组血浆中COR含量高于对照组,起到了稳定虹鳟生理机能的作用[27]。而持续25℃热刺激后,柴胡组、藿香高浓度组与对照组COR含量趋于一致,而藿香低浓度组、茵陈组COR含量明显高于柴胡组和对照组,这说明藿香低浓度组及茵陈组在25℃持续热应激期间仍能发挥良好的抵抗热应激的作用。
肾上腺素(E)作为一种激素和神经传送体,通过抑制蛋白质降解间接起到增多蛋白质合成量的作用[31],供给机体更多的能量。有报道称,当鱼类受到热应激刺激后,鱼体第一时间出现交感-嗜铬组织系统反应,血液中肾上腺素含量升高[32]。
本研究表明,在升温至20℃初的过程中,柴胡低浓度组及茵陈高浓度组均提高了机体E含量,供给机体更多的能量来参与抵抗热应激,维持机体正常的生命活动。当20℃的水温持续刺激后,对照组鱼的E含量显著降低(P<0.05),而各中草药组鱼仍可维持E含量稳中有升;藿香组及茵陈低浓度组鱼血浆中E含量上升幅度更大。说明机体自身合成的肾上腺素含量不足以供给机体抵抗20℃的热应激,而藿香和茵陈组能有效促进机体生成更多的肾上腺素来提供能量。25℃持续热刺激后,机体激素水平趋于稳定,藿香组和茵陈组鱼血浆中E含量均高于对照组,说明藿香和茵陈比对照组仍能保持机体肾上腺素的较高水平,有助于机体在热应激环境中维持稳定。本实验中藿香、茵陈能提高肾上腺素含量。
3.2 柴胡、藿香及茵陈对热应激下虹鳟酸性磷酸酶(ACP)、碱性磷酸酶(ALP)活性的影响
鱼类处于应激状态下会改变一些酶活性,调节机体新陈代谢,以抵抗应激对机体的损伤。酶活性高低与组织器官的代谢水平及功能相关,而机体适应应激环境的能力取决于各组织器官的健康水平,其中酸性磷酸酶(ACP)、碱性磷酸酶(ALP)即为两种重要的调节酶。ACP活性高低与核酸和蛋白质的组织退变代谢有关,ACP活性增强时机体核酸和蛋白质代谢活动也增强[33]。ACP还可以参与磷酸酯的代谢、神经递质的释放,在疾病免疫、细胞损伤与修复等具有一定作用[34]。因此,ACP活性高低可以反应鱼类抵抗应激能力的强弱。
本研究中,在15℃正常水温下,除茵陈高浓度组外,三种中草药组虹鳟肝脏中ACP活性均低于对照组,初升温至20℃时,柴胡低浓度组、藿香低浓度组、茵陈低浓度组ACP呈上升趋势,而对照组肝脏中ACP活性下降明显。这说明温度的升高导致对照组不能够维持机体正常酶活性,而各中草药组起到了稳定机体酶活性的作用。20℃持续热刺激后,茵陈高浓度组ACP活性与其余各组明显不同。但升温至25℃初时,茵陈高浓度组ACP活性有所降低,而柴胡组和藿香组呈上升趋势,且25℃持续热应激后,藿香组肝脏中ACP仍保持较高活性,说明藿香提高虹鳟肝脏中ACP活性的效果较好。
ALP为溶酶体的重要组成部分,不仅参与鱼类的生长发育,加速物质的吸收和利用,还可以为ADP磷酸化为ATP提供更多的无机磷,为抵抗不利环境提供机体所需能量。因此鱼类应对热应激时其ALP可以作为重要的考察指标。本研究中,在15℃至升温到25℃初期,对照组和各实验组ALP活性基本维持在较低水平,在持续20℃热刺激后有小幅度升高,但没有明显的变化规律。而持续25℃热应激一段时间后,茵陈高浓度组ALP活性与其余各组形成显著性差异(P<0.05),而其余中草药组鱼肝脏中ALP活性仍无明显变化。这可能是由于ALP活性偏低有助于组织细胞生理活动处于较低水平,以适应应激环境[34]。热应激期间,藿香组相比其余各组肝脏中ALP活性更稳定。
3.3 柴胡、藿香及茵陈对热应激下虹鳟肝脏组织结构的影响
本研究中,对照组鱼肝脏随水温升高受损严重,而中草药对肝脏损伤起到一定的缓解作用。15℃正常水温时,各实验组虹鳟肝细胞分布均匀,肝板排列整齐,虹鳟在此水温下代谢正常、生存状况良好;对照组和中草药组均未出现病理现象,其中藿香组15℃正常水温下的肝细胞相比其余各组结构更清晰完整。而本实验中,对照组及茵陈组在15℃条件下肝脏组织中肝小叶结构模糊,这与黄步敏等[35]得到的结构相似,虹鳟肝小叶间结缔组织与哺乳动物不同,故肝小叶分界不明显。之前的研究结果显示,热应激可导致虹鳟肝脏组织结构受损[10,36]。周彦静等[11]对虹鳟进行持续热应激,其肝脏组织结构变化;当水温达到21℃时,肝脏轻微淤血,肝细胞轻度变性,但肝脏结构仍然完整清晰。这与本实验结果相似,20℃持续热应激一段时间后,对照组肝血窦拥堵,肝板排列紊乱,肝细胞空泡化,各中草药组出现轻微病变,如轻微淤血,细胞变性等。说明机体对水温升高做出了反应,但20℃的水温并未对中草药组肝脏组织造成严重损伤,说明中草药组可以维持机体肝脏部分结构稳定,起到一定程度抗热应激作用。崔彦婷[37]研究了不同浓度大黄素对热应激草鱼肝细胞活力的影响,发现0.04μg/mL大黄素浓度组细胞活力显著高于高温应激组(P<0.05),保护免受氧自由基的损伤,抑制肝细胞凋亡,对热应激起到一定抵抗作用。本研究中,25℃热应激情况下,对照组空泡化现象严重,肝细胞变性程度不断加深,肝细胞坏死凋亡,肝细胞结构紊乱等。茵陈组鱼大面积肝细胞凋亡坏死,肝细胞空泡化严重。而柴胡组和藿香组出现轻微肝细胞空泡化,肝血窦扩张、拥堵,肝细胞融合,细胞核溶解等现象。这与周彦静在高温应激时的结果相吻合[11]。整体而言,藿香组鱼肝脏在25℃持续热应激时的破坏程度最小,说明饲料中添加藿香能提高虹鳟抗热应激损伤的能力。
3.4 小结
鱼用中草药的剂量选择是根据中药药典中各药物的常用量,因药物和复方不同而异。目前没有鱼的常用量,以人的常用量为标准,除以平均体质量,得到的适宜应用量[25,38]。在水产中的应用和试验研究证明,基本适用于部分鱼类,包括虹鳟[20]。
本研究中,在热应激期间,藿香和茵陈组的激素和酶活性整体高于对照组,而柴胡组虽能提高机体抗热应激能力,但作用效果不理想,其剂量有待进一步研究。结合组织学结果表明,藿香组缓解热应激的肝损伤的效果更好,可作为虹鳟抗热应激中草药的备选药物。
