哈尔滨地区养殖池塘中除草剂类农药残留及分布特征
2019-05-09黄晓丽高磊黄丽吴松汤施展王鹏陈中祥覃东立
黄晓丽 ,高磊 ,黄丽 ,吴松 ,汤施展 ,王鹏 ,陈中祥 ,覃东立 ,2
(1.中国水产科学研究院黑龙江水产研究所,黑龙江 哈尔滨 150070;2.农业农村部水产品质量安全控制重点实验室,北京 100141)
现代农业发展过程中农药的广泛使用,在保障粮食高产、稳产的同时,导致了大量有毒物质进入环境中,污染土壤、水体和农产品。我国农药使用量逐年增加,已经由2000年的128.0万t增长到2014年的180.7万t,而农药的平均施用量也由8.2kg/ha增长到10.9kg/ha(根据农作物总播种面积计算)[1]。据农业农村部统计,目前我国农药的有效利用率仅约为30%,农药的不合理使用导致了农业面源污染问题日益突出[2]。除草剂(herbicide)是目前使用较为广泛的农药类型,约占国际农药市场比重的50%,可用于选择性地消灭或抑制植物生长。大量研究表明,除草剂的有效物质在生产和使用过程中可残留在土壤中,或通过大气传输、地表径流等方式迁移至大气、地表水等外界环境[3-7]。现已证实,如利谷隆、除草醚、草甘膦等部分除草剂具有环境雌激素活性,具有致畸、致突变、致癌作用,极大地威胁生态环境和人类健康[8-10]。除草醚等高毒除草剂类已被多数国家禁止生产、使用,我国也在2001年停止生产、销售、使用该农药[11]。目前,尽管农业生产中常用的除草剂具有低毒性、半衰期短的特点[12],但其使用量大而频繁,也导致了在环境中的“持续性”存在,而其对生态环境的长期影响还不明确。因此,这类化合物在环境中残留、分布、迁移和归趋等问题亟待解决。
目前,除草剂残留污染物已成为全球最普遍的有机污染物之一,已在不同区域的土壤、地表水、地下水中检测到了除草剂的存在[13-15]。地表水体中的除草剂主要来自于农田退水、地表径流、降水、生产除草剂的工厂废水排放等,除草剂残留污染物在世界范围内地表水中分布广泛。目前有关水体中除草剂的研究多集中于自然水体和地下水,而对人工构筑的淡水养殖池塘研究较少。池塘养殖是我国主要的淡水养殖方式和人们获得鱼类等淡水水产品的主要途径。淡水养殖池塘基本上属于静止水体,水源一般来自于临近地表水体或地下水,水源中的污染物质、降水及周边农业生产活动的干扰,可能会导致除草剂等农药污染物在淡水养殖池塘中累积、蓄存。养殖池塘的水质与环境健康关系着水产品的质量,威胁到人类的健康,有必要深入研究养殖池塘环境中的除草剂残留。
东北地区农药使用总量和单位面积用药量增长速度快,莠去津、丙草胺、丁草胺、乙草胺、2,4-D丁酯和恶草酮等是东北地区常用的除草剂,适用于防除水稻、玉米、高粱、大豆、马铃薯等多种一年生单子叶和双子叶杂草,常单一或混合使用。丁草胺、恶草酮等对斑马鱼Brachydanio rerio、罗非鱼Oreochromis spp、鲫 Carassius aumtus、麦穗鱼 Pseudorasbora parva等鱼类具有高毒或剧毒;恶草酮对斜生栅藻 Scenedesmus obliquus、大型溞 Daphnia magna、斑马鱼、鲤Cyprinus carpio等水生生物具有高毒或中毒[16]。养殖池塘多与农田距离较近,其水体水质易受到农业生产活动的影响。养殖池塘水面较小,水体中的除草剂等有机污染物问题易被忽略,但养殖水产品与人们的饮食健康息息相关,水体环境质量会严重威胁人类和生态系统的健康。因此,本研究选择位于黑龙江省哈尔滨市郊区的淡水养殖池塘为研究对象,通过检测养殖池塘的水体、底泥和周边土壤中除草剂的浓度和种类,分析其在不同环境介质中的残留水平和时间变化,为深入理解淡水养殖水体中除草剂的分布及污染水平提供科学依据与参考。
1 材料与方法
1.1 研究区域与样品采集
采样的池塘位于黑龙江省哈尔滨市宾县,坐标为东经 127°05'08",北纬 46°03'22"。三个土基养殖池塘的塘龄均超过20年,每个池塘面积为6.67×103~1×104m2,水深均为 0.8~1.5m,每个池塘投放鱼种5 000~7 000尾,投放种类主要为鲤、鲢Hypophthalmichthys molitrix和鳙Aristichthys nobilis。三个池塘位于同一区域且相互紧邻,周边为旱田或水稻田,水源均为地下水,定时曝气充氧与投饵。2016年5—10月,选择晴朗天气的上午9:00—11:00采样,每月1~2次。每个池塘设置2~3个采样点,利用采水器采集0~0.5m的池塘表层水,注入洁净的聚乙烯瓶中,密封后运回实验室,在24 h内测定除草剂的浓度,共采集水样品65个。利用柱状沉积物采集器,采集池塘0~10cm表层底泥,每个池塘设置3~5个采样点,共采集底泥样品89个。在池塘与稻田或旱田中间位置采集土壤样品各2kg,每个池塘设置3~5个采样点,装入聚四氟塑料袋中带回实验室尽快测定,共采集土壤样品80个。
1.2 仪器与试剂
Agilent7890A-5975C气相色谱-质谱联用仪(美国Agilent公司);N-EVAPTM 112氮吹仪(美国Organomation公司);Allegra X-30R台式高速离心机(美国Beckman公司);PB 602-N电子天平(瑞士梅特乐-托利多公司);KQ 700E超声波清洗器(昆山市超声仪器有限公司);BUCHIsyncore多样品定量浓缩/平行蒸发仪(瑞士BUCHI公司)。液相色谱-串联三重四级杆质谱仪Waters UPLC,Waters TQ-S(美国Waters公司),配有ESI离子源;液质专用氮气发生器PEAK(毕克科技仪器有限公司);加速溶剂萃取仪ASE350(美国赛默飞世尔公司);全自动凝胶渗透色谱仪Accu Prep MPS(美国J2 scientific公司);涡旋混匀器MS1(德国IKA公司);24位负压SPE装置(天津博纳艾杰尔科技有限公司);纯水器(美国Millipore公司)。
2,4-D丁酯、乙氧氟草醚、嗪草酮、嗪草酮标准品溶液,浓度均为100μg/mL(农业农村部环境保护科研监测所);标准品莠去津、丙草胺、丁草胺和乙草胺购自国家标准物质研究中心。二氯甲烷、乙腈、丙酮和正己烷为色谱纯试剂,环己烷、乙酸乙酯、乙腈、甲醇、二氯甲烷均为色谱纯(上海安谱实验科技股份有限公司);氯化钠和无水硫酸钠(650℃烘烤2 h)为分析纯(国药化学试剂有限公司)。CleanertPEP固相萃取小柱:150mg/6mL(天津博纳艾杰尔科技);Cleanert Florisil固相萃取小柱:1g/6mL(天津博纳艾杰尔科技)。试验用水为Milli-Q高纯水。HLB固相萃取柱(50mg,3mL)和0.22μm有机相微孔滤膜购自上海安谱公司;超纯水(电阻率≥18.2MΩ·cm);氩气纯度高于99.999%。
1.3 样品处理
1.3.1 气相色谱-质谱测定样品
底泥与土壤样品在室内风干,去除石块、植物残体后,研磨,过60目筛,装进样品袋中。称取制备后的样品5.0g,装入快速溶剂萃取仪ASE萃取池,加入内标溶液(环氧七氯:100ng/mL)0.1mL,用正己烷-二氯甲烷(1+1)混合溶剂50mL,提取ASE条件:温度100℃;压力10.34MPa;静态萃取5min;循环3次。得到提取液用多样品定量浓缩/平行蒸发仪BUCHIsyncore浓缩至近干,以环已烷-乙酸乙酯(体积比1∶1)复溶,经0.22μm的有机相滤膜过滤后,定容至10mL,以Bio-Bead S-X3凝胶作为柱填料,环已烷-乙酸乙酯(体积比1∶1)作为流动相,柱流速4.7mL/min,样品定量环5mL,收集8.0~18.5 min的流出液,在线浓缩后,用正已烷定容1.0mL,待测。量取500mL水样于1000mL分液漏斗中,加入10μg/L的内标溶液0.1mL,加入环已烷:乙酸乙酯(体积比为 1∶1)50mL,振摇 2min,静止分层,弃水相,取上层有机相于100mL定量浓缩管中,用多样品定量浓缩/平行蒸发仪BUCHIsyncore浓缩近干,加入1mL正已烷溶解残渣,用0.22μm有机相微孔滤膜过滤于1mL进样瓶中,待测[16]。
1.3.2 液相色谱-质谱测定样品
称取制备后的底泥样品5.0g装入快速溶剂萃取仪ASE萃取池,加入内标溶液(氘代莠去津:100ng/mL)0.1mL,用正己烷 - 二氯甲烷(1+1)混合溶剂50mL提取,ASE条件:温度100℃;压力10.34MPa;静态萃取5min;循环3次。得到提取液用多样品定量浓缩/平行蒸发仪BUCH Isyncore浓缩至近干,以环已烷-乙酸乙酯(体积比1∶1)复溶,经0.22μm的有机相滤膜过滤后定容至10mL,待净化。以Bio-BeadS-X3凝胶作为柱填料,环已烷-乙酸乙酯(体积比1∶1)作为流动相,柱流速4.7mL/min,样品定量环5mL,收集8.0~18.5min的流出液,在线浓缩,用乙腈水溶液(V水∶V乙腈∶V甲酸 =95∶5∶0.1)定容1.0mL,待测。HLB固相萃取柱先用5mL甲醇、5mL水活化,然后量取200mL水样过柱(不加压,自然滴落),水样完全过柱后,抽真空吹干,加入2mL乙腈洗脱,洗脱样用0.22μm有机相微孔滤膜过滤于1mL进样瓶中,待测[16]。
1.4 仪器分析条件
1.4.1 气相色谱-质谱分析条件
色谱柱:DB-5MS(30m×0.25mm×0.25μm);进样口温度250℃;色谱柱升温程序:60℃保持1min,以20℃/min的速度升至180℃,以5℃/min的速度升至220℃,保持3min,以30℃/min的速度升至280℃保持10min,共计30min。载气:氦气,纯度99.999%,流速 1.0mL/min;进样量:1μL;进样方式:无分流进样,1.5min后打开分流阀和隔垫,吹扫阀。质谱的条件:EI电离方式,电离能70eV;传输线温度280℃;离子源温度:230℃;溶液延迟8.0min[16]。
1.4.2 液相色谱-质谱分析条件
色谱柱:ACQUITY-UPLC BEH C18色谱柱(50mm×2.1mm×1.7μm)。流动相A为0.1%甲酸水溶液,B为0.1%甲酸乙腈溶液;梯度洗脱:0~2.0min,95%A;2.0~4.2min,95% ~5%A;4.2~6.4min,5%A;6.4~6.5min,5%~95%A;6.5~8.5min,95%A。流速0.3mL/min,柱温30℃,进样体积10μL。质谱条件:ESI+电离方式,毛细管电压3.0kV,去溶剂温度450℃,脱溶剂流速800L/Hr[16]。
1.5 质量控制
为保证监测数据的可靠性和真实性,本研究从玻璃仪器的清洗、采样介质前处理到样品的采集、保存和萃取等全过程都严格按照USEPA的QA/QC要求进行操作和监控。检测过程中加入平行样品、溶剂空白样品和加标回收率检测。经检验,空白样品目标化合物浓度绝大多数低于检测限。方法对水体中农药的检出限分别为:丙草胺2ng/L,丁草胺2ng/L,乙草胺2ng/L,莠去津1ng/L,2.4-D丁酯 0.2ng/L,嗪草酮2ng/L,乙氧氟草醚10ng/L。底泥和土壤中农药的检出限分别为:嗪草酮0.5μg/kg,2,4-滴丁酯0.05μg/kg,乙氧氟草醚 0.5μg/kg,莠去津、丙草胺、丁草胺和乙草胺均为0.5μg/kg。
2 结果与分析
2.1 不同环境介质中除草剂类农药的残留水平
由图1可知,池塘表层水体中除草剂分布变化在N.D.~1 671.30ng·L-1(N.D.表示未检出)之间,池塘表层底泥和周边土壤中除草剂分布在N.D.~270.43 μg·kg-1。7种除草剂中,嗪草酮和乙氧氟草醚在池塘水体中均未检出,在表层底泥和周边土壤中的检出率较低,仅为2.25%~12.36%;莠去津、丙草胺、丁草胺和乙草胺在水体、底泥和周边土壤中的检出率为100%;在表层水体中,莠去津的残留量最大,最高达1 671.30 ng·L-1;2,4-D丁酯在水体中的检出率为46.67%,在底泥和周边土壤中的检出率为100%。
2.2 不同环境介质中除草剂类浓度随时间的变化
在所研究的淡水养殖池塘区域内,时间变化对池塘不同环境介质中除草剂残留的影响较大。周边农田施用除草剂后,水体中除草剂的残留量随时间的延长而逐渐下降,施农药后1个月内,池塘水体中2,4-D丁酯和莠去津的残留浓度达最大值。表层底泥中各除草剂残留量波动变化,无明显规律,土壤中不同除草剂残留量却有明显差异。乙草胺在水体中残留量较小,在土壤中残留含量最大,底泥居中,土壤中的高峰出现在施用除草剂后的3~12d,因为它是选择性芽前处理除草剂,时间上符合东北地区水稻种植过程除草剂的使用规律。丁草胺在水体中残留较少,在底泥和土壤中残留峰值出现在施用后的119d,为8月份,正是东北地区降水较多的季节。莠去津在土壤、水体和底泥中的浓度起伏变化较大,在多个时间段出现峰值,规律不明显。
2.3 与其他地区地表水环境中除草剂残留水平的比较
除草剂类污染物在水环境中的时空分布和生态风险一直是环境研究领域普遍关注的问题。尽管对地表水环境中除草剂类物质的污染水平已有调查,但仍有待进一步完善。从近十年文献看出,农业地区河流及其沉积物中检出率和检出浓度较高的除草剂为三嗪类除草剂(莠去津、西玛津、环嗪酮、特丁津等)和取代脲类除草剂(莠谷隆、异丙隆、利谷隆等),我国的地表水环境中除草剂类污染物主要为三嗪类除草剂和酰胺类除草剂(乙草胺、丙草胺、异丙草胺、丁草胺等)。本研究涉及的淡水养殖池塘中除草剂的残留浓度低于目前报道的多数国家或地区的地表水中的浓度,例如:东辽河流域旱田区地表水体中莠去津的浓度为9.71μg/L,非旱田区地表水体中莠去津的浓度为8.854μg/L[17];官厅水库水体中莠去津含量为0.67~3.9μg/L[18];太子河流域水体中莠去津含量为0~734.0ng/L[19];东北地区水源水中乙草胺的浓度为ND~1 054.9 ng/L[20]。
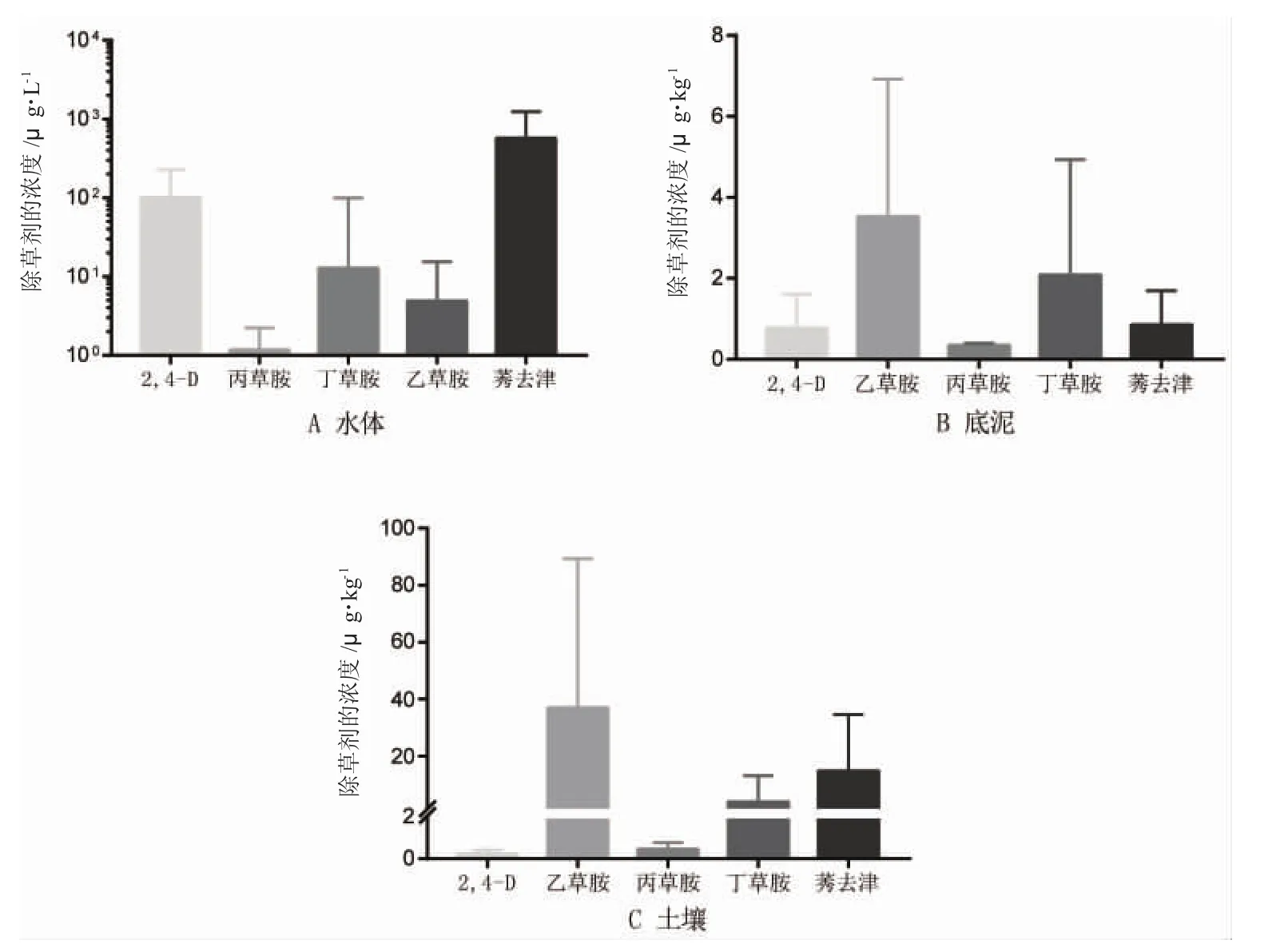
图1 养殖池塘水体、底泥和周边土壤中除草剂类农药的残留水平Fig.1 Residual levels of herbicides in water,sediment and surrounding soil of aquaculture ponds
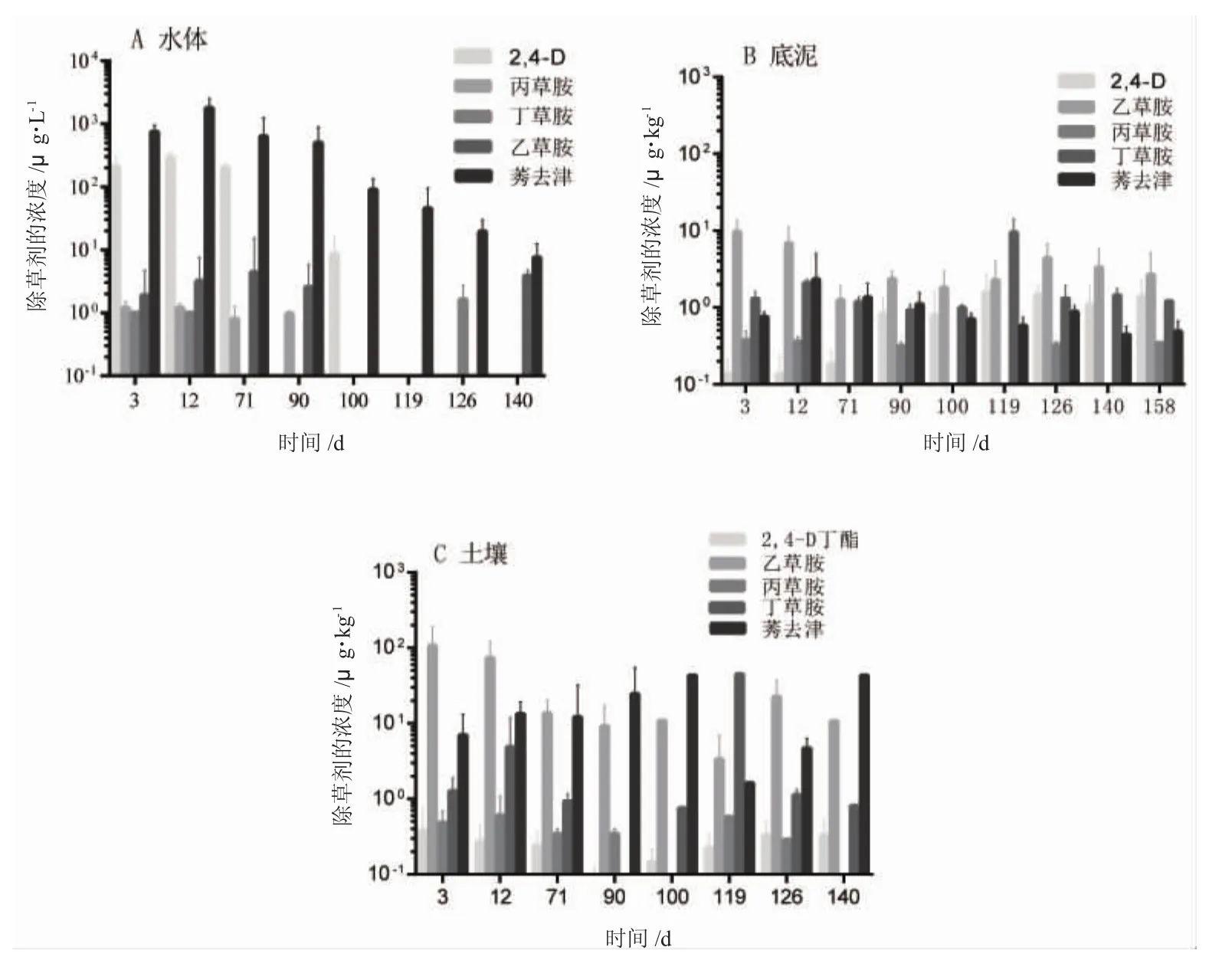
图2 不同时间环境介质中除草剂类农药浓度Fig.2 Residual levels of herbicides in ambient media in various days
3 讨论
不同环境介质中除草剂的残留量具有一定的差异性,整体表现为池塘周边土壤中最高,其次为池塘表层底泥,池塘表层水体最低(图1)。实验池塘周边有旱田与水田,一部分喷洒的除草剂残留在土壤中,导致土壤中除草剂含量较高。养殖池塘的水源主要依靠地下水和降水补充,土壤中残留的除草剂可能通过降水随地表径流进入池塘中。大部分除草剂疏水性较高,在水体中倾向于在悬浮物和沉积物中富集,这可能是池塘底泥中除草剂浓度较高的主要原因。
不用除草剂在不同环境介质中的残留量差异较大。乙草胺性质稳定,不易挥发和光解,在土壤中的移动性小,主要保持在表层土壤中[21,22],所以在底泥和周边土壤中的残留量较其他除草剂大;莠去津的蒸汽压较低,水溶性较高,吸附系数较小,在环境中的迁移性较强[23-25],易被雨水淋洗至土壤较深层或随地表径流进入地表水体[25],因此,在各环境介质中的检出率较高(100%)。多个国家和地区的地表水和地下水中均发现了莠去津的残留[26-28],美国、欧共体和日本等国均把它列入内分泌干扰剂化合物名单。美国EPA规定,饮用水中的阿特拉津不可超过 3μg·L-1[29],欧共体规定为 0.1μg·L-1[30],我国Ⅰ、Ⅱ类地表水中莠去津的标准为3μg·L-1[31]。
时间变化对池塘不同环境介质中除草剂残留的影响较大。大部分除草剂的半衰期较短,其残留量下降主要为自然降解,其次是吸附在固体颗粒表面而逐渐沉降至底泥中或者富集于水生生物体内。施农药后1个月内,池塘水体中2,4-D丁酯和莠去津的残留浓度达最大值,因此在1个月内需要观察池塘养殖生物的状态,防止除草剂污染对水生生物的毒害。不同除草剂在土壤中的移动性不同,造成了土壤中不同除草剂残留量的差异。乙草胺和丁草胺同属于移动性很弱的酰胺类除草剂,因此在水体中残留量较小,在土壤中残留含量最大,底泥居中。施用的农药主要在稻田水面和附着在植物上,但是如果有降雨,则会被冲刷到稻田水体中,并逐渐沉积在底泥中。莠去津在不同时间段不同环境介质分布规律不明显,其原因是多次使用导致重复性污染,也可能是在稻田收割季节,农业生产活动导致在种植前期用作土壤封闭的农药重新翻出,形成二次污染。
农药对地表水的污染,除了受自身移动性影响外,还与农药的施用量和降解速度、土壤性质和气候条件等因子有关。不同时间与不同地区水环境中除草剂的残留种类和含量相差较大,这与农业生产所种植的作物种类不同、种植结构调整及高效低毒除草剂新品种开发推广有关。中国地表水中除草剂类的污染较为严重,还需要进一步的调查研究,这与我国农业经济快速发展密切相关。水源水中含量尚未超过我国现行的标准,但低剂量长期摄入也会影响人体健康。因此,地表水环境中除草剂残留问题应受到人们更多关注。
本次调查表明,黑龙江省哈尔滨市郊区淡水养殖池塘表层水体中除草剂分布在N.D.~1 671.30 ng·L-1,莠去津的残留量最大;池塘表层底泥和周边土壤中除草剂分布在 N.D.~270.43μg·kg-1。莠去津、丙草胺、丁草胺和乙草胺在三种环境介质中的检出率为100%;嗪草酮和乙氧氟草醚检出率较低,2,4-D丁酯在水体中部分检出,在底泥和土壤中的检出率为100%。不同环境介质中,除草剂残留量在池塘周边土壤中最高,池塘表层底泥次之,池塘表层水体最低,且养殖水体中的除草剂残留随时间而下降。
