多聚赖氨酸在悬浮细胞转染中的应用
2019-04-02王俊婷落继先
王俊婷,落继先
山西大学 生命科学学院,山西 太原030006
细胞转染是指将含有目的基因的片段或具有生物功能的重组基因导入细胞并使其成功表达的技术,广泛应用于基因功能的研究。常用的转染方法包括病毒载体法、脂质体转染法、磷酸钙转染法[1]、基因显微注射[2]和电击转染法[2-3]等。
一般情况下,贴壁细胞较易转染,而悬浮细胞的转染普遍存在转染效率低[1,3-4]的问题。转染悬浮细胞一般采用电击转染法,但通常会造成细胞活力差[5]。常用的转染试剂脂质体性价比高,可以用于瞬时转染和稳定转染[1],但其转染悬浮细胞的效率较低,因此,脂质体在悬浮细胞转染中的应用较少。
多聚赖氨酸能够促进细胞贴壁生长,被广泛用于体外细胞培养器皿的表面处理[6]。用多聚赖氨酸处理过的培养皿培养耳蜗螺旋神经细胞[7]、胎鼠颌下腺细胞[8]、人表皮细胞[9]、背根神经节[10]、骨髓基质等细胞[6],能够显著提高细胞的贴附性,并保持良好的生长状态[11]。
我们通过多聚赖氨酸包被细胞培养板,优化脂质体转染法,检测并鉴定过表达质粒和小干扰RNA(small interfering RNA,siRNA)在悬浮细胞中的转染和表达,建立了一套利用脂质体高效转染悬浮细胞的方法。
1 材料与方法
1.1 材料
人急性T淋巴细胞白血病细胞Jurkat(Clone E6-1)和CCRF-CEM(中国科学院上海细胞库);多聚-D-赖氨酸(poly-D-lysine,PDL)、ECL发光液(碧云天公司);二甲基亚砜(Sigma公司);24孔和6孔细胞培养板(Corning公司);脂质体2000(Invitrogen公司);siRNA[生工生物工程(上海)股份有限公司];研究级倒置荧光相差显微镜(奥林巴斯公司);低速离心机(安徽中科中佳科学仪器有限公司);CO2细胞培养箱(北京生原诚业公司);硝酸纤维素膜(索莱宝公司);ABL1抗体(Santa Cruz公司);超净工作台(上海博讯试验设备有限公司);RPMI-1640(Gibco公司);多功能酶标仪(MD公司)。
1.2 siRNA设计
针对人ABL1基因的mRNA序列设计并合成siRNA(5'-GGGUGUACCAUUACAGGAUTT-3';5'-AUCCUGUAAUGGUACACCCTT-3')。
1.3 PDL工作浓度的摸索
1.3.1 PDL包被细胞培养板以无菌PBS溶液稀释PDL,设置0、0.001、0.005、0.01、0.05、0.1、0.5 mg/mL共5个浓度包被24孔细胞培养板,每孔300μL,每个浓度3个重复,于4℃过夜包被。
1.3.2 细胞培养取出过夜包被的24孔细胞培养板,于超净工作台内吸掉PDL溶液,吹风数分钟至完全干燥。每孔1.5×106Jurkat或CCRF-CEM细胞,重悬于500μL无双抗完全培养基中,于恒温CO2细胞培养箱内培养20~24 h。
1.3.3 悬浮细胞贴壁情况统计从CO2细胞培养箱中取出细胞培养板,吸除板内培养基,用PBS洗3次,于倒置相差显微镜下随机选取5个视野拍照,统计分析不同浓度PDL包被下细胞相对贴壁率,确定最佳包被浓度。
1.3.4 PDL对细胞活性的影响用PBS或PDL于4℃过夜包被细胞板,加入细胞培养(同1.3.1),24 h后换液一次;次日,每孔加入10μL MTT,轻轻摇匀,放入培养箱孵育3~4 h;将板孔上清中的细胞离心,弃上清,对应板孔与离心管中各加入100μL DMSO溶解沉淀,然后把EP管中的液体加回相应孔中,摇匀,测定D570nm值。
1.4 转染pWPXLd
用0.1 mg/mL的PDL过夜包被细胞培养板(同1.3.1),次日铺Jurkat和CCRF-CEM细胞培养(同1.3.2),20~24 h后吸除板孔中的培养基,用PBS洗3次,用3μL脂质体2000向24孔板内转染1μg pWPXLd质粒,6 h后换液,换液时把板孔中的液体1000 r/min离心5 min,用500μL完全培养基重悬沉淀,加回相应孔中,放入培养箱中继续培养。24 h后用荧光显微镜于可见光及荧光下同时拍照,观察绿色荧光蛋白的表达。
1.5 转染siRNA
PDL过夜包被细胞培养板及铺Jurkat和CCRF-CEM细胞培养(同1.4.1)。用5μL脂质体2000向6孔板内分别转染200μmol siRNA和对照siRNA(NC),4~6 h后换液,板孔中的 液 体1000 r/min离心5 min,用2 mL完全培养基重悬沉淀,加回相应孔中,放入培养箱中继续培养24 h后收细胞并裂解,采用Western印迹检测对照组和实验组中相应蛋白的表达量,选用ACTB为上样量的内参。
2 结果
2.1 PDL最适浓度的确定
用不同浓度的PDL包被细胞培养板,统计分析各浓度下2种细胞的相对贴壁率(图1)。0.01 mg/mL PDL显著促进Jurkat细胞贴壁,且这种作用随PDL浓度的增大而提高,PDL浓度达到0.1 mg/mL后继续增加至0.5 mg/mL,促进悬浮细胞贴壁的作用并没有随浓度变化而显著增加,在CCRF-CEM细胞中显示了一致的结果,所以后续实验采用0.1 mg/mL PDL包被细胞培养板。
2.2 PDL对细胞活性的影响
为了排除PDL对细胞活力的影响,将Jurkat和CCRF-CEM细胞分别与0.1 mg/mL PDL或等体积的PBS作用,用MTT法检测0.1 mg/mL PDL对细胞活力的影响。结果表明,0.1 mg/mL PDL不影响Jurkat和CCRF-CEM细胞的活性(图2)。
2.3 2种细胞转染效率检测
为了研究PDL引起的悬浮细胞贴壁后是否对质粒转染有帮助,将含有绿色荧光蛋白(GFP)基因的真核表达载体pWPXLd转染Jurkat或CCRFCEM细胞,48 h后在荧光显微镜下观察,视野范围内GFP的表达率均在90%以上(图3),表明pWPXLd质粒成功转染Jurkat或CCRF-CEM细胞。
2.4 siRNA转染及干扰效率检测
为了进一步验证上述方法是否对siRNA转染有效,设计合成了ABL1的siRNA,将细胞按上述方法贴壁处理后用脂质体转染siRNA,48 h后收取转染的细胞并裂解,Western印迹(图4)结果表明,与对照转染组及正常细胞相比,siRNA组能显著干扰Jurkat和CCRF-CEM细胞内ABL1的表达。表明上述方法对siRNA转染同样有效。

图1 不同浓度PDL处理后Jurkat细胞(A)和CCRF-CEM细胞(B)贴壁情况统计
3 讨论

图2 0.1 mg/mL PDL对Jurkat细胞(A)和CCRF-CEM细胞(B)活力没有影响
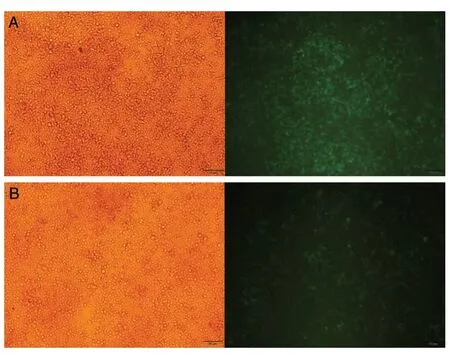
图3 转染pWPXLd的Jurkat细胞(A)和CCRF-CEM细胞(B)转染效率的鉴定

图4 Jurkat细胞(A)和CCRF-CEM细胞(B)中ABL1干扰效率鉴定
悬浮细胞转染效率较低,近年来有较多提高悬浮细胞转染效率的方法,如改变细胞铺板密度、限制悬浮细胞分裂[1]、纤连蛋白预处理细胞[2],也有人尝试改变电击转染条件,如控制电压、电容、细胞状态和缓冲液血清浓度等[5],甚至有电击法和脂质体转染法的联合使用[2],但大都存在细胞活力差和转染效率很难大幅度提高等问题。急性T淋巴细胞白血病是一种常见的恶性血液肿瘤疾病[12]。Jurkat[13]和CCRF-CRM[13-14]细胞均为急性T淋巴白血病细胞系,在T淋巴细胞白血病、T细胞信号[1]和病毒感染的相关研究中也被广泛应用[15],但这2种细胞转染效率低,使得相关研究在一定程度上受阻。
有研究表明,明胶、纤连蛋白、壳聚糖均能促进细胞黏附。与本研究用到的多聚赖氨酸相比,明胶的作用较弱[16],纤连蛋白处理对材料要求较高[17],壳聚糖需要与多聚赖氨酸联合使用才能达到较好效果[18]。此外,聚乙醇酸、多聚乳酸[19]、层黏连蛋白和转化生长因子β[20]虽然也能促进细胞贴壁,但因处理方法繁琐或技术要求高而应用较少。我们采用多聚赖氨酸包被细胞培养板,促进悬浮细胞贴壁生长,然后再用脂质体转染悬浮细胞Jurkat和CCRF-CEM,该方法适用于质粒及小干扰RNA的转染,为白血病的相关研究提供了技术手段。
