构建钙荧光探针细胞用于探究胞浆和线粒体钙对ATP刺激的响应
2019-04-02王恺赵海鑫李金亮夏晴
王恺,赵海鑫,李金亮,夏晴
国家生物医学分析中心,北京100850
腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)是重要的细胞内代谢产物,作为能量载体为几乎所有的细胞生命活动提供能量,同时,ATP也是一种重要的信号分子,参与细胞内和从细胞外到细胞内的信号传递[1-2]。在缺氧、病原体感染引起的细胞凋亡和组织损伤情况下,ATP可由细胞释放至胞外作为一种危险信号参与信息传递,并且,有报道在化疗或某些物理治疗时,坏死的肿瘤细胞会将胞内ATP释放到微环境中,引起周围肿瘤细胞和微环境中巨噬细胞的响应[3-4]。因此,深入研究细胞对外部环境中ATP刺激的响应,对于理解胞外ATP这一危险信号在某些组织损伤情况下的信号传递作用、肿瘤细胞内部生命活动与外部环境的联系,以及肿瘤细胞响应微环境物质刺激的方式具有重要意义。
细胞外ATP可通过刺激细胞膜上的嘌呤类受体P2X7分子,引起细胞内钙稳态的改变,从而引起细胞的免疫反应和代谢状态改变等[3,5-6]。钙离子是机体各种生理活动必不可少的离子,参与膜电势维持、神经传导、能量生产等重要的生理生化过程。同时,钙离子作为一种细胞内广泛存在的第二信使,参与了细胞内外的信号转导和信息传递[7]。
在本研究中,我们采用胞浆和线粒体定位钙探针GCaMP6的腺病毒分别感染人宫颈癌细胞HeLa[8-9],验证感染成功率和表达情况,研究在外源ATP刺激下HeLa细胞内部钙离子稳态的改变,希望为观察细胞内不同结构组分钙离子的动态变化提供有力的工具。
1 材料与方法
1.1 材料
人宫颈癌HeLa细胞系购自American Type Culture Collection(ATCC);DMEM基础培养基、胰蛋白酶、双抗(青霉素、链霉素)购自迈晨科技有限公司(北京);胎牛血清、Opti-MAM培养基购自Gibco公司;Lab-Tek八腔室盖玻片、ATP购自Thermo Fisher公司;Krebs-Ringer改良缓冲液(KRB)(125 mmol/L NaCl,5 mmol/L KCl,1 mmol/L Na3PO4,1 mmol/L MgSO4,5.5 mmol/L葡萄糖,20 mmol/L HEPES,pH7.4)为实验室自行配制;全长线粒体钙探针DNA来自意大利Padua大学Diego De Stefani实验室;cyto-GCaMP6和4mt-GCaMP6钙探针腺病毒为本实验室构建;P2X7受体拮抗剂A438079来自Selleck公司。
1.2 细胞培养
HeLa细胞用含10%胎牛血清及1%双抗的DMEM培养基,在5%二氧化碳条件下,37℃恒温培养箱中培养。
1.3 腺病毒感染
将HeLa细胞用胰蛋白酶消化后,用DMEM培养基重悬并计数,按3×104/孔的数量均匀种在Lab-Tek八腔室盖玻片中,待细胞完全贴壁并状态良好时,每孔更换为200μL新鲜DMEM培养基,加入10μL腺病毒浓缩液,置于37℃培养箱中,6 h后更换为新鲜培养基并继续培养。
1.4 倒置荧光显微镜下观察荧光探针表达情况
在腺病毒感染细胞24 h后,将细胞置于倒置荧光显微镜下,在波长为488 nm的激发光下观察细胞的发光情况,从而确定腺病毒感染效率和荧光探针表达效果。
1.5 钙离子荧光探针动态成像
将转染荧光探针腺病毒的HeLa细胞更换培养基,用生理盐水洗3次以去除原有的DMEM培养基,每孔加入300μL预热的KRB,在Ultra⁃VIEW spinning-disc confocal microscope(Perkin Elmer)荧光成像系统下观察,激发光波长488 nm,按3 s/帧的间隔连续拍摄。用Volocity软件对数据进行统计分析,每组统计细胞数n=20。
1.6 ATP刺激下细胞钙离子动态成像
将种植于Lab-Tek八腔室盖玻片中的待观察细胞更换培养基,用生理盐水清洗3次后每孔加入150μL预热的KRB,于共聚焦荧光显微镜成像系统下,以3 s/帧的间隔拍摄30 s,提前用预热的KRB稀释ATP至目标浓度,快速向对应腔室细胞滴加150μL终浓度为10μmol/L的ATP溶液,继续拍摄。对于需要进行抑制剂预处理的细胞,在拍摄前1 h即更换含有10μmol/L A438079的KRB预处理,其他操作一致。用Volocity软件对数据进行统计分析,每组统计细胞数n=20。
2 结果
2.1 腺病毒感染后荧光探针在相应细胞结构中得到表达
按照标准腺病毒转染步骤进行操作,将cyto-GCaMP6和4mt-GCaMP6这2种不同定位的钙探针腺病毒感染HeLa细胞,24 h后在倒置显微镜下初步观察,在共聚焦荧光显微镜下拍摄确认。结果显示,感染cyto-GCaMP6腺病毒后,HeLa细胞内荧光探针GFP信号定位于胞浆,信号较强,细胞维持良好的生长状态;感染4mt-GCaMP6腺病毒后,HeLa细胞线粒体丝网状结构有明显的GFP信号表达,细胞生长状态良好(图1)。
2.2 细胞外ATP刺激HeLa细胞胞浆发生瞬时钙瞬变
在共聚焦荧光显微镜下对感染了cyto-GCaMP6腺病毒的HeLa细胞进行动态成像,我们发现在对细胞加入10μmol/L外源ATP刺激时,细胞内绿色荧光信号在6 s内发生约10倍的瞬时增强,持续约200 s后逐渐回落到基础水平。这说明,HeLa细胞能够响应细胞外ATP的刺激,从而发生胞浆钙离子浓度的瞬时上升即胞浆钙瞬变[10],这可能是HeLa细胞对细胞外ATP刺激的一种响应机制(图2)。
2.3 细胞外ATP的加入刺激HeLa细胞线粒体发生瞬时钙瞬变
同上,在共聚焦荧光显微镜下对感染了4mt-GCaMP6腺病毒的HeLa细胞进行动态成像,在对细胞加入10μmol/L外源ATP刺激时,我们发现细胞线粒体绿色荧光信号强度在9 s左右发生大约4倍的瞬时上升即线粒体钙瞬变,约300 s后荧光强度逐渐下降到较低水平(图3)。已知,细胞线粒体内钙离子的来源主要是胞浆[11-12],因此,此结果说明在ATP刺激下,HeLa细胞内整体钙离子稳态会发生改变,线粒体会从胞浆摄入大量的钙离子,引起线粒体内钙离子浓度的上调。
2.4 HeLa细胞通过细胞膜上的P2X7受体对细胞外ATP刺激进行钙瞬变的响应
据报道,真核细胞细胞膜上存在核酸类物质的受体家族分子[13],其中P2X7受体能够结合ATP分子,从而将刺激信号转导入细胞,引起胞内的生理活动改变[5-6]。我们发现,用P2X7受体抑制剂A438079处理细胞后[14],细胞生长状态和荧光探针表达情况并不受影响,但是在ATP刺激下,细胞内胞浆钙离子浓度和线粒体钙离子浓度的上升都受到了抑制(图4)。这说明,细胞外ATP能够通过HeLa细胞膜上的P2X7受体引起细胞内钙离子稳态的改变。通过这种信号转导机制,细胞能够快速响应外界ATP的信号刺激。

图1 胞浆钙探针cyto-GCaMP6(A)与线粒体钙探针4mt-GCaMP6(B)在HeLa细胞中的表达
3 讨论
作为一种重要的信号分子,钙离子对很多器官和组织细胞内的生理活动具有关键的调控作用。在受到外来刺激和内环境变化刺激时,细胞内钙离子浓度会发生波动,从而引起细胞内生理活动状态的改变。已知细胞内主要的钙离子库是内质网和线粒体,内质网的钙离子可以通过释放到胞浆从而被线粒体摄取,引起线粒体活性的变化,这对于线粒体能量代谢、形态维持、氧化状态的调节具有重要意义[11]。

图2 外源ATP刺激引起HeLa细胞胞浆钙离子探针荧光信号瞬时上升
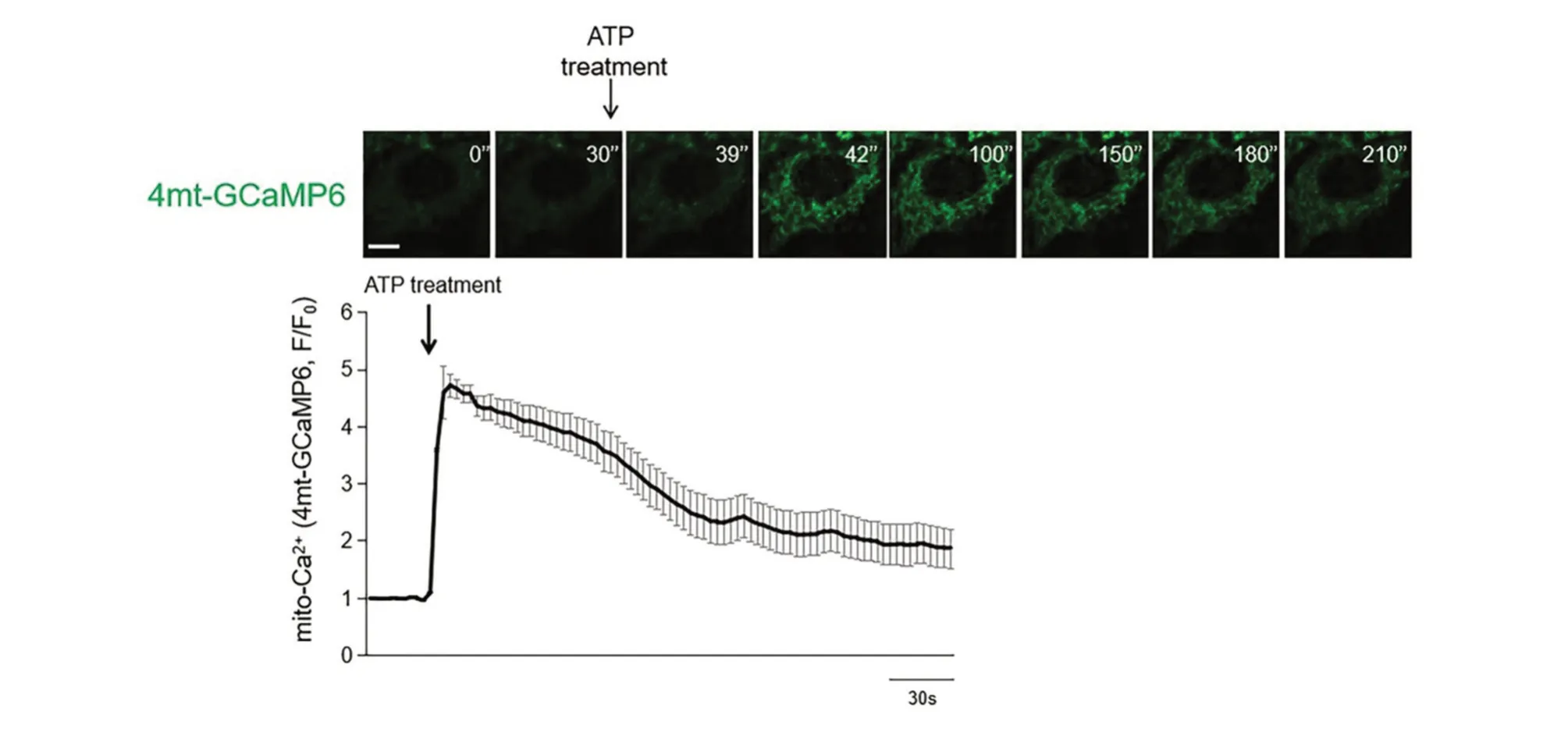
图3 外源ATP刺激引起HeLa细胞线粒体钙离子探针荧光信号瞬时上升
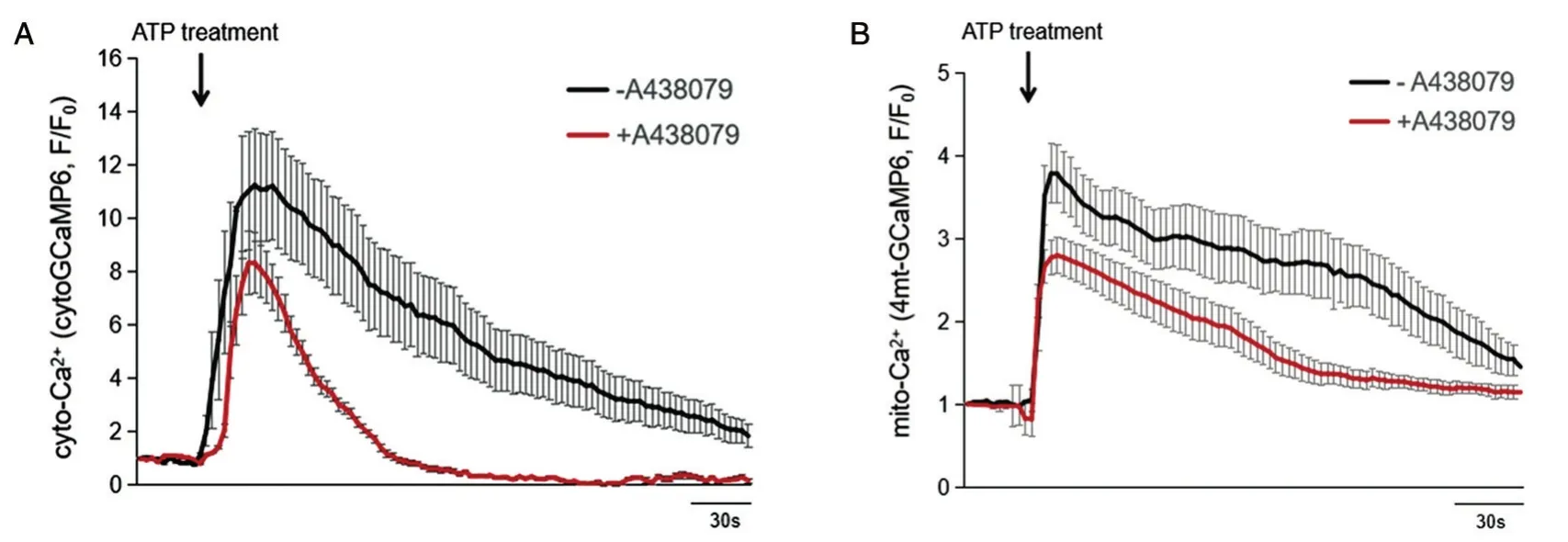
图4 ATP受体通道抑制剂A438079处理抑制外源ATP刺激引起的胞浆钙瞬变(A)和线粒体钙瞬变(B)
在此工作中,我们用基因编码钙探针对细胞内钙离子进行研究,发现HeLa细胞可以对细胞外ATP刺激产生快速反应,发生瞬时的胞浆钙瞬变和线粒体钙瞬变。这说明,HeLa细胞可以通过改变细胞内钙离子的稳态对外界环境的ATP变化产生灵敏的反应,而这种能力是通过细胞膜上的P2X7受体介导的。研究表明在某些剧烈的细胞损伤条件例如放化疗刺激下,死亡的肿瘤细胞会向外环境释放出内容物,这些细胞内大量的ATP等核酸类物质也会出现在外环境中,被周围的其他细胞所感应到,在病原体感染、组织损伤中,ATP作为危险信号,也介导了细胞炎症性损伤应答[2-4,15]。本研究成功构建了能在活体细胞内通过荧光探针实时监测钙离子响应胞外ATP刺激的细胞实验体系,为进一步深入探究ATP等危险信号导致细胞的炎性损伤机制奠定了基础。
