ELISA两种包被方法在牛乳氯霉素测定中的比较
2018-11-16张蕴哲马雯李聪李森袁耀武
张蕴哲,马雯,李聪,李森,袁耀武
(河北农业大学食品科技学院,河北保定071001)
0 引 言
在酶联免疫吸附实验(ELISA)中,包被环节是影响实验准确性及可重复性的关键因素之一。目前,一些非蛋白类小分子半抗原的包被通常先与蛋白载体共价联接制备偶联物[1-6],过程繁琐。小分子半抗原还可以采用另外一种包被方式,即半抗原自身基团简单修饰后直接与氨基化或醛基化的酶标板通过化学键联接达到包被目的[7-10],过程较为简单,而且可以排除载体蛋白引起交叉反应的风险,目前这种包被方式在文献报导中相对较少。本研究将氯霉素半抗原采用上述两种不同方式包被酶标板,利用间接ELISA测定鲜牛乳中氯霉素质量浓度,并对两种不同包被方式的测定结果进行分析比较,从而对氯霉素半抗原包被方式在实际样品测定中的效果进行评价。
1 实验
1.1 材料与设备
卵清蛋白OVA,氯霉素,氨基己酸,抗氯霉素氯抗体,各浓度氯霉素标准溶液,酶标记物,样品复溶液来自氯霉素快速检测试剂盒,JET BIOFIL酶标板,亚硝基铁氰化钠,乙酸乙酯,锌粉,硫酸锌,无水乙醇,鲜牛乳,电热恒温培养箱,离心机,酶标仪。
以下溶液本实验室配置:磷酸盐缓冲液PBS(pH=7.4);洗涤液 PBST(pH=7.4);碳酸盐缓冲液 CBS(pH=9.6);底物溶液(OPD-过氧化氢溶液);终止液(浓度2.0m o l/L的H2SO4溶液)。
1.2 方法
1.2.1 氯霉素半抗原的直接包被方式
氨基化氯霉素的制备、酶标板醛基化处理参照文献[8]中的方法进行。
酶标板的包被:将氨基化氯霉素用PBS适当稀释后加入醛基化酶标板,150μL/孔,37℃恒温反应2 h,之后PBST洗涤3次,250μL/孔PBST洗液,每次3分钟。
酶标板的封闭:用0.2 m ol/L的氨基己酸溶液封闭酶标板,200μL/孔,37℃恒温反应2 h,之后PBST如上洗涤3次。
1.2.2 氯霉素半抗原的间接包被方式
氯霉素-OVA偶联蛋白的制备:混合酸酐法,参照文献[1]中方法。
酶标板的包被:将氯霉素-OVA偶连蛋白用CBS适当稀释后加入酶标板,150μL/孔,37℃恒温反应2 h,之后PBST洗涤3次,250μL/孔PBST洗液,每次3 min。
酶标板的封闭:用含质量分数为1%的OVA的PBS溶液封闭酶标板,200μL/孔,37℃恒温反应2 h,之后PBST如上洗涤3次。
1.2.3 两种不同包被方式包被浓度的确定
在直接包被方式中,将氨基化氯霉素制备液用PBS溶液5倍递进稀释为不同质量浓度后,按照1.2.1步骤分别包被醛基化酶标板并完成封闭过程;在间接包被方式中,将氯霉素-OVA偶连蛋白制备液用CBS溶液5倍递进稀释为不同浓度后,按照1.2.2步骤分别包被酶标板并完成封闭过程。不同包被浓度的孔中分别加入50μL的酶标记物、50μL的PBS溶液及50μL的氯霉素抗体工作液,于25℃恒温培养箱中,保湿反应30 min;甩净孔内液体后按照1.2.1步骤洗板5次;向所有孔中加入底物溶液100μL,25℃避光反应15 min;向所有孔内加终止溶液50μL;用酶标仪在492 nm波长下测量各孔的吸光度(OD值)。绘制吸光度与包被浓度关系曲线,通过分析比较,确定两种包被方式的抗原包被质量浓度。
1.2.4 含氯霉素牛乳样品的制备及提取
含氯霉素牛乳样品的制备:取新鲜牛乳,人为添加氯霉素,使其在牛乳中质量浓度分别为0.05,0.2,0.8 μg/L,充分混匀。
含氯霉素牛乳样品的提取:分别量取5.0 m L添加不同质量浓度氯霉素的牛乳样品及对照牛乳,加入0.25 m L浓度为0.36 mol/L亚硝基铁氰化钠溶液和0.25 m L浓度为1m o l/L硫酸锌溶液,震荡混合,然后在转速为4 000 r/min离心10 min。避开上层油脂,移取出2.2m L的上层液至另一离心管,加入4m L的乙酸乙酯,充分震荡5 min,然后转速为4 000 r/min离心10 min。吸取上层液体2 m L,在60℃氮气流下吹干,用1 m L样品复溶液溶解干燥后的残留物,待检用。
1.2.5 间接竞争ELISA测定样品中氯霉素
在确定好包被浓度的两种不同包被方式的酶标板中,分别取不同浓度的氯霉素标准液及待测样品提取液各50μL,加到酶标板对应孔中,各孔中加入50μL的酶标记物,然后各孔中加入50μL的抗体工作液,后续反应步骤同于1.2.3。标准溶液测定吸光度值后分析重复孔吸光度值变异系数,计算百分吸光度值(百分吸光度值=B/B0×100%,B代表各浓度标准溶液的平均吸光度值,B0代表氯霉素0含量准溶液的吸光度值),绘制百分吸光度值与氯霉素质量浓度关系的回归曲线。待测样品计算百分吸光度值后根据回归曲线确定牛乳样品中氯霉素含量,并计算各浓度样品氯霉素回收率。
2 结果与分析
2.1 两种不同包被方式包被浓度的确定
两种不同包被方式的间接ELISA,在抗体与酶标记物浓度一定的情况下,包被抗原浓度与结果吸光度值的关系见图1。由图1可以看出随着包被抗原稀释度的增加,两种包被方式的吸光度值都呈现规律性下降趋势,表现出平缓—速降—平缓的过程。曲线的速降区为与抗体反应合理的抗原浓度范围,本试验在速降区中部左右选择吸光度值,两种不同包被方式与此吸光度值对应的稀释度作为间接竞争ELISA的包被浓度,即直接包被方式采用1:625倍稀释的制备液,间接包被方式采用1:25倍稀释制备液,它们对应的吸光度值均为1左右。
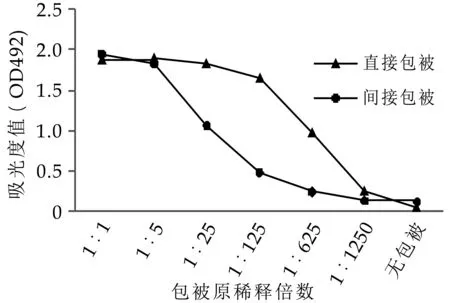
图1 包被浓度对测定结果的影响
2.2 两种不同包被方式孔间变异系数的比较
不同质量浓度的氯霉素标准液经间接竞争ELISA测定后,测定吸光度值并分析各浓度重复孔吸光度值的变异系数,结果如表1所示。由表1可以看出,两种包被方式各浓度标准液吸光度值变异系数在2.6~10.6之间,都属于正常范围以内(小于15%),经无重复双因素方差分析对吸光度值变异系数进行分析,发现两种包被方式间比较P-value值为0.039,在0.01~0.05之间,差异显著;各浓度组间比较P-value值远小于0.01,差异极显著。结果说明变异系数受到包被方式的影响,也受到样品中氯霉素质量浓度的影响,与间接包被方式相比,直接包被方式具有更低的变异系数。
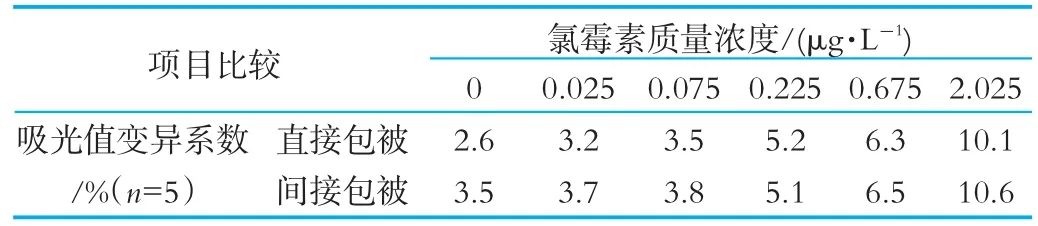
表1 不同包被方式吸光度值变异系数的比较
2.3 两种不同包被方式回归曲线的比较
不同质量浓度的氯霉素标准液经间接竞争ELISA测定后,绘制百分吸光度值(B/B0)%与氯霉素质量浓度关系的回归曲线,如图2所示。由图2可以看出,两种包被方式的回归曲线都呈现较好的量效关系,这说明不论哪种包被方式,在通过间接竞争ELISA测定氯霉素质量浓度时都是可行的。两种包被方式中,百分吸光度值随着氯霉素质量浓度在0.025~2.025μg/L之间变化均呈现规律性下降趋势,在0.075~0.675μg/L之间下降坡度最大,提示这个浓度区段是样品中抗原最佳竞争质量浓度范围。直接包被方式与间接包被方式相比,曲线末端出现明显向下背离趋势,意味着直接包被方式的回归曲线具有更大斜率,量效关系更明显,从理论上讲检测灵敏度要高于间接包被方式,出现这种结果的原因还需进一步试验确定。

图2 不同包被方式的间接竞争ELISA测定氯霉素回归曲线的比较
2.4 两种不同包被方式检测结果的比较
添加不同质量浓度氯霉素的牛乳样品经过提取后,利用间接竞争ELISA测定各样品的吸光度值,计算B/B0(%)后,根据回归曲线得出氯霉素检出量,结果如表2所示。经单因素方差分析,各处理组两种包被方式氯霉素检出量比较P-value值均大于0.05,即无显著性差异。根据测定结果计算样品回收率,直接包被方式各处理组样品回收率在80.9~91之间,间接包被方式各处理组样品回收率在85.9~94之间,经无重复双因素方差分析,两种包被方式样品回收率结果无显著性差异,各处理组间样品回收率结果也无显著性差异。

表2 不同包被方式的间接竞争ELISA对牛乳样品中氯霉素检测结果的比较
3 讨论
氯霉素是家畜疾病防治的常用药物,如果氯霉素残留物随动物性食品进入人体中,会对人类健康带来潜在危害。酶联免疫吸附实验可以快速检测样品中氯霉素的残留,而包被环节又是酶联免疫吸附实验的基础。本研究在利用间接竞争酶联免疫吸附法检测氯霉素时,对氯霉素半抗原的两种包被方式进行了对比分析。间接包被方式需要先制备蛋白偶联物,过程较繁琐;直接包被方式与间接包被方式相比,制备过程较为简单。检测结果经过对比分析发现,直接包被方式在回归曲线具有更大斜率,重复孔吸光度值的变异系数也相对较低,两种包被方式在牛乳样品中的氯霉素检出量及测得样品回收率方面并没有显著性差异,结果说明直接包被方式可以得到稳定的包被效果,能够用于乳类样品中氯霉素的检测。
