环形泰勒虫SYBR Green I荧光定量PCR方法的建立及应用
2019-04-02王素华袁淑辉吴绍强吕继洲帅江冰张晓峰赵治国
王素华,袁淑辉,吴绍强,吕继洲,帅江冰,张晓峰,赵治国
(1.温州海关,浙江温州325027;2.中国检验检疫科学研究院动物检疫所,北京100029;3.杭州海关,浙江杭州310016;4.呼和浩特海关,内蒙古呼和浩特010020)
环形泰勒虫病是由泰勒虫科(Theileriidae)泰勒虫属(Theileria)的环形泰勒虫(T.annulata)经蜱传播后寄生于牛的巨噬细胞、淋巴细胞和红细胞内,引起以高热、贫血、出血、消瘦和体表淋巴结肿胀为特征的一类血液原虫病[1]。其传播者主要是璃眼蜱属的残缘璃眼蜱和小亚璃眼蜱[2-3]。该病多呈地方流行,且为急性经过,死亡率从外来进境牛的90 %到本土牛的5 %不等。据估计,全世界每年约有2.5 亿头牛受到该病的威胁,是制约发展中国家养牛业生产的主要疾病之一[4-5]。
目前,牛环形泰勒虫病的诊断主要通过血液涂片镜检,隐性感染牛的血液染虫率较低,显微镜检测易出现漏检;牛环形泰勒虫生活史中裂殖体寄生于淋巴结内时间较短,淋巴液涂片镜检法也难以诊断[6-7]。常规PCR 方法操作流程相对繁琐、易污染,诊断周期长;SYBR Green I 荧光定量PCR 法灵敏度高、特异性强[8-10],基于此,本研究建立了针对牛环形泰勒虫Tams1基因的SYBR Green I 荧光定量PCR方法。
1 材料与方法
1.1 病原核酸及临床样品 牛环形泰勒虫(T.annulata)、牛巴贝斯虫(Babesia bovis)、反刍动物艾立希体(Ehrlichia ruminantium)和弓形虫(Toxoplasma gondii)的全血基因组DNA 分别由浙江大学动物科学学院和中国农业科学院兰州兽医研究所寄生虫学实验室惠赠。15 份疑似牛环形泰勒虫病例血液临床样本从新疆不同地区的3 个养牛场采集;20 只璃眼蜱采自温州口岸进口盐渍牛皮,由温州海关动植物检疫实验室-80 ℃保存。
1.2 主要试剂 Quick-DNATM提取和纯化试剂盒购自ZYMO RESEARCH 公司;质粒提取试剂盒、pUC57 Vector、DH5α 和Amp 购自生工生物工程(上海)有限公司;RoX Reforence Dye II、SYBR Premix ExTaqII (Tli RNaseH Plus)(2×)、TaqDNA 聚合酶(5 U/μL)、dNTPs (10.0 mmol/L)、MgCl2(25 mmol/L)、DL5000 DAN Marker、DNA 胶回收试剂盒均购自宝生物工程(大连)有限公司。
1.3 引物设计与合成 根据GenBank 中登录的牛环形泰勒虫Tams1基因(U22888.1),应用Oligo 和Primer 5.0 软件设计1 对特异性引物,引物序列为Tams1-F: 5'-CAAATTCGAGACCTACTACGATC-3'/Tams1-R:5'-CCACTTRTCGTCCTTAAGCTCG-3',扩增Tams1基因大小为319 bp,作为SYBR Green I 荧光定量PCR 引物,引物由上海华大基因科技有限公司合成。
1.4 重组质粒标准品的制备 以牛环形泰勒虫基因组DNA 为模板,应用本实验室建立的常规PCR 方法扩增Tams1基因片段。引物序列为:Tams1-F1:5'-GTAACCTTTAAAAACGT-3'/Tams1-R1:5'-TATGG TACCTAAATTATATACGTAAATAAC-3',扩增Tams1基因大小为691 bp。在50 μL 反应体系中依次加入:10×PCR Buffer 5.0 μL,dNTPs(10.0 mmol/L)1.0 μL,Mgcl2(25 mmol/L)2.0 μL,Tams1-F 和Tams1-R(25 mmol/L)各1.0 μL,TaqDNA 聚合酶(5 U/μL)0.4 μL,模板DNA 4.0 μL,灭菌去离子水补至50.0 μL。扩增程序如下:94 ℃2 min;94 ℃60 s、55.0 ℃1 min、72 ℃1 min,30 个循环;72 ℃10 min;4 ℃结束反应。将扩增的目的片段按照凝胶回收试剂盒说明书回收后与pUC57 载体连接,转化DH5α 感受态细胞,挑取阳性菌落经PCR 和测序鉴定,获得pUC57-Tams1阳性质粒,测定其浓度并计算拷贝数后作为荧光定量PCR 的标准品。
1.5 SYBR Green I 荧光定量PCR 反应条件的优化分别对25 mmol/L 的引物使用量、退火温度和循环数进行优化。采用25 μL 反应体系在如下范围内进行优化:25 mmol/L 上、下游引物各0.2 μL~1.0 μL、SYBR Premix ExTaqII (Tli RNaseH Plus)(2 × )12.5 μL、ROX Reference Dye II 0.5 μL、模板2.0 μL,灭菌去离子水补至25 μL。同时设阴性对照。反应程序如下:95 ℃1 min 或5 min;95 ℃10 s、55 ℃~62 ℃34 s、72 ℃30 s,30 个循环~40 个循环。反应结束后进行溶解曲线分析,并对反应退火温度、时间以及反应体系进行优化。
1.6 标准曲线的建立 以10 倍倍比稀释的7 个不同稀释度(1.8×108拷贝/μL~1.8×102拷贝/μL)的标准质粒DNA 为模板进行SYBR Green I 荧光定量PCR,绘制标准曲线。
1.7 特异性试验 分别以B.bovis、E.ruminantium、弓形虫的DNA 和pUC57-Tams1质粒标准品为模板,同时设置阴性对照,按照1.5 确定的方法进行SYBR Green I 荧光定量PCR,评价该方法的特异性。
1.8 敏感性试验 将pUC57-Tams1标准质粒进行10 倍梯度稀释,以7 个梯度(1.8×106拷贝/μL~1.8×100拷贝/μL)的标准质粒为模板进行SYBR Green I 荧光定量PCR 扩增,以评价该方法能够检出标准质粒的最小拷贝数,并设空白对照。
1.9 重复性试验 利用建立的SYBR Green I 荧光定量PCR 方法,以相同拷贝数标准质粒DNA 为模板进行组内重复检测;以10 倍系列稀释的5 个梯度(1.8×106拷贝/μL~1.8×102拷贝/μL)的标准质粒DNA 为模板进行组间平行试验,每个梯度分别做3次重复试验。分析该方法的重复性,计算其组内和组间变异系数。
1.10 临床样品的检测 将15 份疑似患泰勒虫病的牛血液样品和20 只从温州市口岸进境盐渍牛皮采集的璃眼蜱提取DNA,应用本研究建立的荧光定量PCR 对35 份临床样品进行检测,同时采用OIE 陆生动物诊断试验与疫苗手册推荐的PCR 方法进行检测[11],对检测结果进行比较。
2 结 果
2.1 重组质粒标准品的制备 以提取的Tams1基因为模板,以Tams1-F/R 引物进行PCR 扩增。1.5%琼脂糖凝胶电泳检测显示,目的片段约700 bp,与预期大小一致,并经测序验证,结果表明重组质粒标准品pUC57-Tams1构建正确,测定重组质粒浓度为13.6 μL/mL,并换算成拷贝数为1.8×108拷贝/μL。
2.2 SYBR Green I 荧光定量PCR 反应条件的优化结果 经反应体系与反应条件优化,最终确定了牛环形泰勒虫Tams1基因SYBR Green I 荧光定量PCR反应体系为SYBR Premix ExTaqII (Tli RNaseH Plus)(2×)12.5 μL,Tams1-F 和Tams1-R 各0.5 μL,ROX Reference Dye II 0.5 μL,DNA 模板2.0 μL,加灭菌去离子水至25 μL。该反应的循环参数最终确定为:95 ℃1 min;95 ℃10 s、60 ℃34 s、72 ℃30 s,40 个循环。反应结束后先加热至95 ℃,然后再降至60 ℃,并以每秒0.5 ℃递增至95 ℃检测荧光信号得出扩增产物的溶解曲线(图略)。
2.3 标准曲线的建立 将标准质粒pUC57-Tams110 倍倍比稀释后,以7 个稀释度进行SYBR Green I荧光定量PCR 扩增,分别以标准DNA 起始浓度和Ct 值为X、Y 轴做回归曲线,呈现良好的线性关系(图1)。线性关系表达式为Y=-3.812X+46.603,相关系数(R2)为0.99。

图1 荧光定量PCR 标准曲线Fig.1 The standard curve of the real-time PCR
2.4 特异性试验结果 以Babesia bovis、E.ruminantium和弓形虫基因组为模板,采用建立的SYBR Green I 荧光定量PCR 进行扩增反应,验证方法的特异性。结果显示,B.bovis、E.ruminantium和弓形虫基因组和阴性对照均未出现特异性扩增,仅Tams1出现特异性扩增,产生了特异性峰值(图2)。表明本研究建立的方法特异性较强。
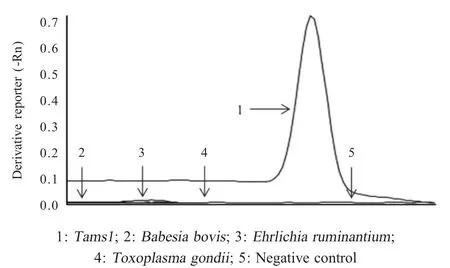
图2 SYBR Green I 荧光定量PCR 方法的特异性试验结果Fig.2 Specific test of the real-time PCR assay
2.5 敏感性试验结果 以10 倍系列稀释的7 个梯度(1.8×106拷贝/μL~1.8×100拷贝/μL)的质粒DNA为模板进行SYBR Green I 荧光定量PCR 扩增,结果显示该方法检测下限为18×102拷贝/μL,而普通PCR 的检测下限为1.8×103拷贝/μL (图3)。表明本研究建立的方法敏感性较高。
2.6 重复性试验结果 将不同稀释浓度的标准质粒pUC57-Tams1进行SYBR Green I 荧光定量PCR,用统计学软件分析扩增结果显示,建立的SYBR Green I 荧光定量PCR 方法组内变异系数在0.13%~0.29%,组间变异系数在0.15 %~0.28 % (表1),表明该方法具有良好的重复性。
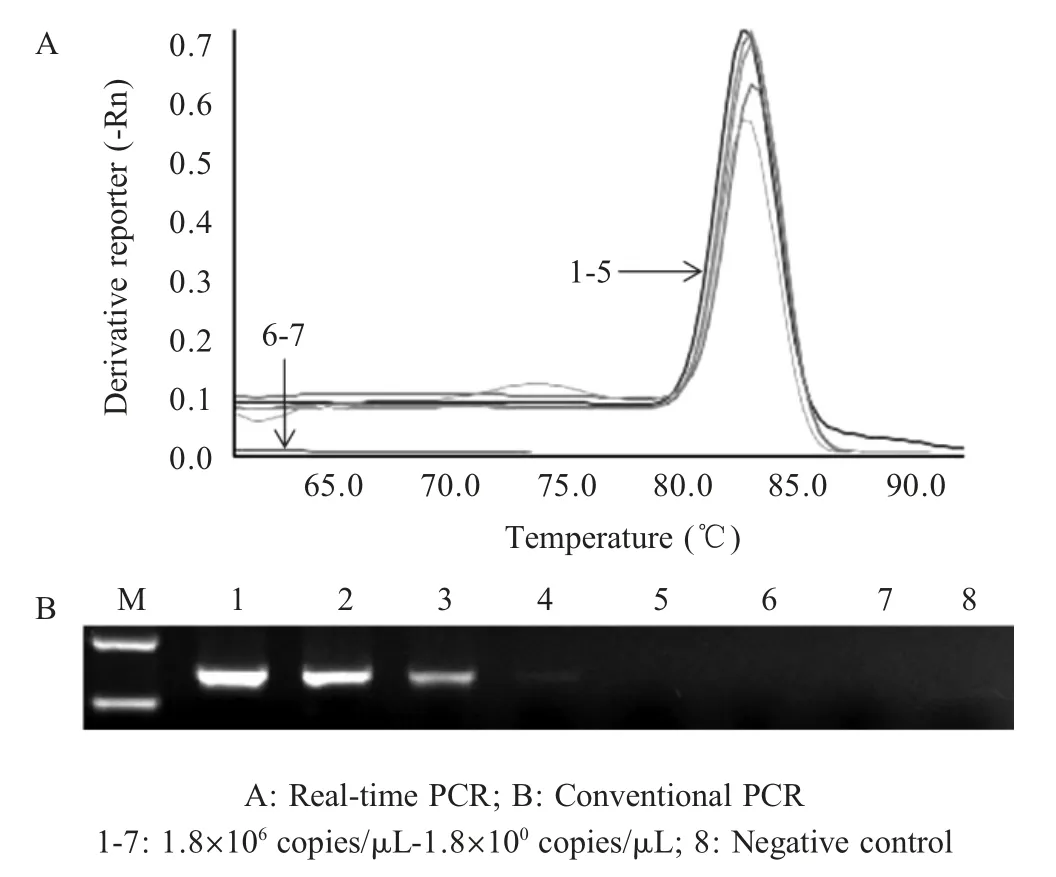
图3 SYBR Green I 荧光定量PCR 敏感性试验Fig.3 Sensitivity analysis of the real-time PCR
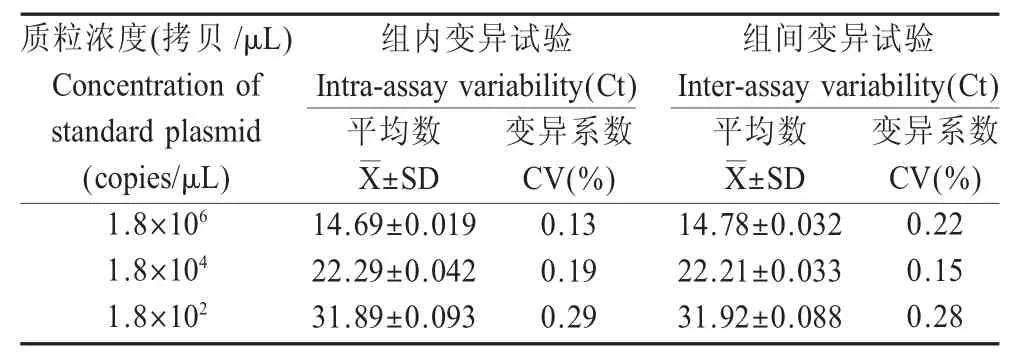
表1 SYBR GreenⅠ荧光定量PCR 的重复性试验结果Table 1 Intra-assay and Inter-assay reproducibility test of the real-time PCR
2.7 临床样品的检测 将15 份疑似患泰勒虫病的牛血液样品和20 只从温州市口岸进口盐渍牛皮采集的璃眼蜱提取基因组DNA 后进行SYBR Green I荧光定量PCR,结果检测出11 份阳性血液样品、4只阳性蜱,阳性率为42.86 %,应用OIE 陆生动物诊断试验与疫苗手册推荐的PCR 方法进行检测,鉴定出10 份阳性血液样品,未检出阳性蜱,阳性率为28.57 %。表明本研究建立的SYBR Green I 荧光定量PCR 敏感性更高。
3 讨 论
T.annulata是一种严重危害牛的寄生虫病,随着养牛业的发展和牛的频繁交易,T.annulata的流行区域逐渐扩大,发病率也随之升高,给养牛业带来了严重的经济损失[12-13]。对疑似发病牛快速鉴别检测,可以为及时采取正确防控措施和减少经济损失提供病原学依据。对于T.annulata而言,常规的血液、淋巴液涂片镜检和血清学实验等方法存在费时、费力且敏感性低的不足。为此,近年来国内外研究人员建立了普通PCR 和TaqMan 荧光定量PCR 等方法,这些方法均有快速、敏感和特异等特点[14]。但普通PCR 需要借助凝胶电泳分析结果,易对操作环境造成污染,而且无法对模板进行定量;TaqMan荧光定量PCR 虽然能够对起始模板进行准确定量,但试剂昂贵、探针合成费用高。本研究尝试以T.annulata的Tams1为检测靶基因序列,通过优化反应条件,建立T.annulata的SYBR Green I 荧光定量PCR 方法,该方法不仅可以对目的基因进行比较准确的定量,还可通过溶解曲线和Tm 值对扩增结果进行分析。
实验结果表明,该方法对T.annulata具有良好的特异性和敏感性,不与牛常见的B.bovis、E.ruminantium和弓形虫等病原体发生交叉反应,最低可检出180 拷贝/μL 的pUC57-Tams1质粒标准品,并具有良好的重复性,组内和组间变异系数均低于1 %。利用建立的SYBR Green I 荧光定量PCR 对35 份临床样品进行检测,与普通PCR 的检测结果进行比较,SYBR Green I 荧光定量PCR 比普通PCR 具有更高的检出率,表明本研究建立的SYBR Green I 荧光定量PCR 方法可以用于临床样品中T.annulata的检测,为T.annulata流行病学调查和诊断提供了有力的技术支持。
