H6亚型禽流感病毒厦门分离株全基因序列分析
2019-04-02蔡振鸿张丹英连玉华
赵 冉,蔡振鸿,陈 琼,张丹英,杨 涛,连玉华
(1.厦门市动物疫病预防控制中心,福建厦门361009;2.厦门市思明区市政管理中心,福建厦门361005)
H6 亚型禽流感病毒(AIV)为低致病性AIV,分布广泛,主要感染水禽呈隐形感染,还可感染陆禽、鼠、水貂、猪,甚至人,危害不容忽视。2007年从广西健康青年血液中检出H6 亚型AIV 抗体[1],2013年有H6N1 亚型AIV 感染人的病例报道[2],证明H6 亚型存在跨宿主感染的风险。国内主要流行过的H6 亚型有H6N2 AIV、H6N6 AIV。华东地区流调发现,2002年~2008年H6N2 AIV分离率较高,2009年后H6N6 AIV 分离率较高。H6N1、H6N5、H6N7、H6N8、H6N9 等其他亚型AIV 偶见报道。野鸟可携带H6 亚型AIV,20 世纪80年代,北美洲和欧洲野鸟监测结果表明,H6 亚型是分离率最高的亚型之一[3-4]。亚洲地区多个国家也先后监测到野鸟中H6 亚型的分布[5-8]。本研究对活禽屠宰场鸭群中分离到的4 株H6 亚型AIV 进行全基因组序列测定、遗传演化分析和特殊位点的氨基酸分析,掌握分子生物学信息,为该地区禽流感防控提供基础研究资料。
1 材料与方法
1.1 检测样品及主要试剂 检测样品采自厦门活禽屠宰场“待宰活禽”的咽喉及泄殖腔。HA AIV 通用诊断试剂盒购自QIAGEN 公司;核酸提取试剂(MagMAXTM-97Viral RNA)购自Thermo Fisher Scientific 公司;病毒RNA 提取试剂盒购自天根生化科技(北京)有限公司;测序反应试剂盒BigDye Terminator 3.1 购自美国ABI 公司。
1.2 病毒的分离与基因测序 样品经“全自动核酸提取仪”提取核酸后(参照RNA 提取试剂盒说明书进行),“HA 禽流感病毒荧光定量PCR 通用诊断试剂盒”初筛,确认为HA 流感病毒的阳性样本,送哈尔滨兽医研究所实验室进行进一步的分离纯化及序列测定(该步骤由哈尔滨兽医研究所崔鹏飞老师完成)。HA 检测阳性样品用滤膜法过滤除菌后,接种10 日龄SPF 鸡胚,37 ℃孵化72 h 后,收集含有最高血凝价、最大稀释倍数的鸡胚尿囊液,连续纯化3 代后,按测序反应试剂盒说明书进行序列测定。
1.3 各基因节段序列遗传进化分析 借助Lasergene MegAlign 软件对1.2 分离的病毒各基因节段氨基酸序列进行同源性及关键位点的分析,利用MEGA5.2 分析软件进行各基因节段序列的遗传进化分析。通过Blast 比对得到与分离病毒株各基因节段具有最高同源性的病毒株。
2 结果与讨论
2.1 病毒的分离与鉴定 从健康鸭群中分离到4 株H6N6 AIV,病毒命名如下A/duck/Fujian/SD013/2017(H6N6)(简称FJ13);A/duck/Fujian/SD086/2017(H6N6)(简称FJ86);A/duck/Fujian/SD099/2017(H6N6)(简称FJ99); A/duck/Fujian/S1307/2017 (H6N6)( 简 称FJ307)。全基因序列上传至GenBank (MG198925~MG198956)。
2.2 HA 基因及氨基酸序列分析 4 株H6N6 AIV HA 经PCR 扩增测序后显示,该基因1 701 bp,共编码567 个氨基酸。4 株分离株HA 核苷酸序列比较,同源性90.7 %~99.5 %,其中FJ13 分离株与其他3 株同源性最低(图1)。裂解位点的氨基酸序列为PQIETRGL,未见连续的碱性氨基酸,表现为低致病性AIV 的分子特征。受体结合位点239 (相当于H3 亚型226 位点)为Q,241 (相当于H3 亚型228 位点)为G,易与唾液酸α2-3 受体结合,表现禽感染嗜性,未发生人感染嗜性的突变。4 株分离株HA均含有7 个潜在的糖基化位点,分别为26NNS28、27NST29、39NVT41、306NKT308、311NVS313、498NGT500、557NGS559,与新疆野鸟粪便分离株A/WB/XJ/S1541(2015)(H6N6)[9]一致。其中FJ99 株与其他3 株分离株相比,在182 位多出1 个潜在的糖基化位点182NNT185。结果表明,目前厦门这4 株分离株的HA基因序列仍表现为低致病性AIV 特征及禽感染嗜性,未发生人感染嗜性的突变。FJ99 株多出1 个潜在的糖基化位点,未见相关文献报道,其是否对病毒毒力产生影响仍有待进一步研究。
2.3 NA 基因及氨基酸序列分析 FJ13 分离株NA基因经PCR 扩增测序后显示,该基因1 380 bp,共编码460aa。4 株分离株NA 核苷酸序列比较,同源性92.4 %~99.4 %,其中FJ13 分离株与其他3 株同源性最低(图2)。其颈部有11aa 的缺失,这种颈部序列的缺失有利于提高病毒株的毒力;6 个潜在的糖基化位点51NET53、70NIT72、86NLT88、146NGT148、201NAS203、402NWS403,与新疆野鸟粪便分离株A/WB/XJ/S1541(2015)(H6N6)[4]一致。FJ86、FJ99、FJ307株NA 基因经PCR 扩增测序后显示,该基因编码区全长1 413 bp,共编码471aa,7 个潜在的糖基化位点,与FJ13 分离株相比增加67NFT69。结果表明,FJ13 病毒株的基因序列存在毒力增强的分子特征。FJ86、FJ99、FJ307 株多出1 个潜在的糖基化位点,未见相关文献报道,其是否对病毒毒力产生影响仍有待进一步研究。
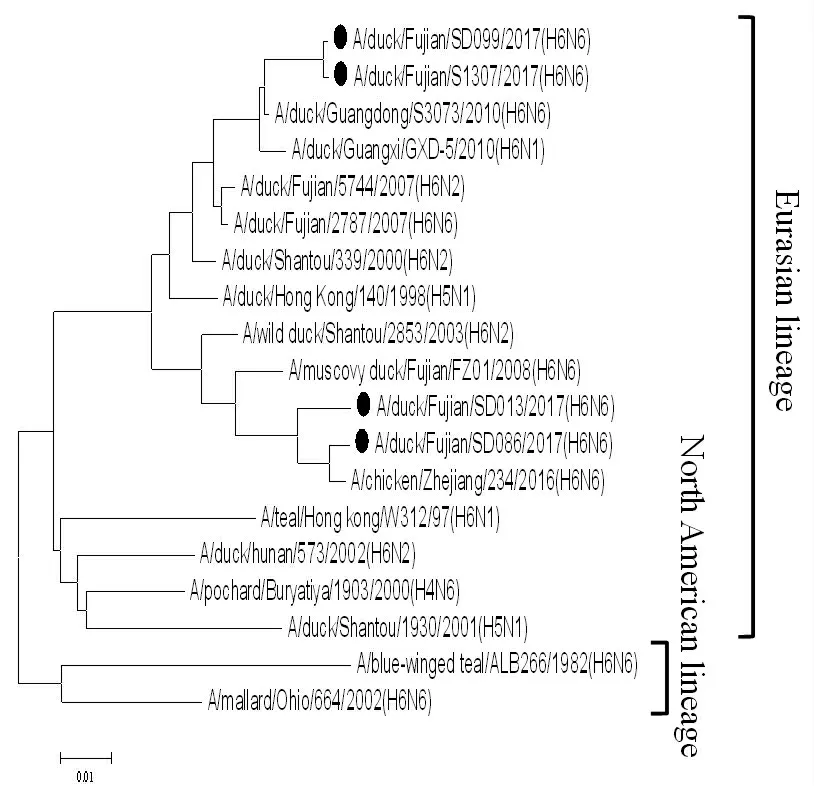
图1 HA 基因的进化树Fig.1 Phylogenetic tree of HA gene

图2 NA 基因的进化树Fig.2 Phylogenetic tree of NA gene
2.4 内部基因及氨基酸序列分析 4 株分离株核苷酸序列比较,其中M 基因的同源性为93%~99.7%,NP 基因同源性为95.1 %~99.8 %,NS 基因同源性为99.3%~100%,PA 基因同源性为93.7%~99.7%,PB1 基因同源性为91.7 %~99.5 %,PB2 基因同源性为97.3 %~99.9 %,其中FJ13 分离株的内部因节段与其它3 株同源性最低。内部基因编码氨基酸序列分析显示,4 株分离株均出现M1 的N30D、T215A突变,NS1 P42S 突变,这些突变与病毒致病性增强或哺乳动物嗜性相关。FJ13 的NS1 还出现了D92G突变。PB2、NP、PA 这3 个基因编码氨基酸未见毒力相关位点的突变。M2 蛋白为离子通道,关键位点的突变与金刚烷胺类药物耐药性相关。4 株分离株M 蛋白均出现V27I 的突变,提示这4 株分离株对金刚烷胺类药物耐药性产生了变化。结果表明,4株分离株内部基因编码氨基酸均出现了与病毒致病性增强、哺乳动物嗜性和耐药性相关的突变。其中,M1 的N30D、T215A 突变与NS1 的P42S 突变与本地同一时期分离到的6 株H9N2 亚型相同,提示这几个与宿主嗜性和毒力增强相关位点的变异已趋于稳定,或者这两种亚型相互间存在这两个基因重组的现象。
2.5 分离株全基因的遗传进化分析 H6 亚型AIV分为欧亚分支和北美分支。其中欧亚分支又可以细分为ST339-like、ST2853-like、HN573-like、ST192-like、W312-like 分支等[10]。基因进化树显示,4 株分离株HA 属于欧亚分支中的ST2853-like 分支。FJ13的HA 基因序列与2015年浙江鸡源分离株A/chicken/Zhejiang/74154/2015 (H6N6)(KU050780)的HA 基因序列同源性最高(98 %);FJ86 的HA 基因序列与2013年江西鸭源分离株A/duck/Jiangxi/10304/2013(H6N6)(KP285309.1)的HA 基因序列同源性最高(98%);FJ99 的HA 基因序列与2014年印度鸭源分离株A/duck/India/11CL01/2014 (H6N2)(KU598235.1)的HA基因序列同源性最高(97 %);FJ307 的HA 基因序列与2013年江西鸭源分离株A/duck/Jiangxi/10304/2013(H6N6)(KP285309.1)HA 基因序列同源性最高(98 %)(图1)。结果表明,分离株HA 基因序列与近年来流行的H6N6 病毒株HA 基因高度同源;部分分离株HA 来源于H6N2、H6N1 病毒株,或者与它们有着共同的来源。
基因进化树,4 株分离株NA 基因属于欧亚分支。FJ13 的NA 基因序列与2016年浙江鸡源分离株A/chicken/Zhejiang/234/2016 (H6N6)(KY056303.1)的NA 基因序列同源性最高(99 %),FJ86、FJ99、FJ307 的NA 基因序列与2007年福建鸭源分离株A/duck/Fujian/8089/2007(H6N6)(CY110154.1)的NA基因序列同源性最高(96 %),并且与2014年越南鸭源H5N6 分离株A/muscovy duck/Vietnam/LBM757/2014(H5N6)的NA 基因序列亲缘关系较近,有共同的来源(图2)。结果表明,分离株NA 基因序列与历年来流行的H6N6 病毒株NA 基因高度同源;3 株分离株NA 基因序列与H5N6 的HA 基因有共同的来源。
将分离株的8 个基因节段与国内外H6 亚型病毒株进行同源性比较,构建系统进化树。根据序列同源性(组内同源性95 %以上),15 株H6N6 亚型病毒株中NP、PB1 划分为7 个Group,HA、PA 划分为6 个Group,NA、M、PB2 划分为5 个Group,NS 划分为2 个Group,绘制基因图谱。基因图谱显示,15 株H6N6 亚型病毒株表现为12 个基因型,4株分离株均分别属于不同基因型。其中,FJ13 株与2016年浙江鸡源分离株A/chicken/Zhejiang/234/2016(H6N6)属于同一个基因型(图3)。

图3 H6N6 病毒基因图谱Fig.3 Genotypes of viruses
我国家禽中H6 亚型AIV 主要分离自南方水禽,2016年11 月~2017年3 月厦门活禽交易市场流行病学调查结果显示,鸭群中主要为H6 亚型AIV,并存在与其它亚型AIV 混合感染的现象。本研究分离到4 株H6 亚型病毒,均为H6N6 亚型,分离自不同来源的鸭群,均属于欧亚分支,遗传演化呈现多样性,其中FJ13 与其它3 株亲缘关系最远。同源性分析显示,3 株分离株的NA、NP、PA 等基因与2006年~2007年H6N2 和H6N6 病毒株同源性很高,可见10年前福建及周边省份流行的H6N2 和H6N6 病毒株的部分内部基因仍为本地区流行的H6N6 病毒株中的优势基因。本研究结果表明,4 株H6N6 AIV 均表现为低致病性AIV 特征,但也存在与耐药性、毒力增强等相关的突变,属于4 种不同的基因型,基因来源呈现多样性。本研究初步了解该地区H6 亚型AIV 主要流行病毒株的分子进化情况,为AI 防控提供科学依据。
