氮缺乏对保加利亚乳杆菌胞内肽酶基因表达的影响
2019-04-01赵悦含姜梦婷高达刘飞杜鹏侯俊财
赵悦含,姜梦婷,高达,刘飞,杜鹏,侯俊财
(东北农业大学乳品科学教育部重点实验室食品学院,哈尔滨150030)
0 引 言
乳酸菌主要是依靠自身蛋白水解体系来为其菌体提供营养,不能直接利用外源蛋白质[1-2]。乳酸菌蛋白水解体系包括胞外酶、转运系统和多种胞内酶。主要包括以下三步:大分子酪蛋白在胞外蛋白酶的作用下降解成多肽;寡肽转运体系将水解后的多肽转运至胞内;胞内肽酶再使转运至胞内的多肽产生乳酸菌生长所需的各种游离氨基酸和短肽,最终进行氨基酸代谢或合成蛋白质[3-4]。乳酸菌通过上述的蛋白水解体系逐步将外源蛋白质水解成供菌体自身营养和生长所需的肽和小分子游离氨基酸[2]。乳酸菌完全利用胞内多肽通常需要肽链内切酶、氨肽酶、二肽酶和三肽酶这几种酶协同作用[1],且乳酸球菌的蛋白水解能力比乳酸杆菌低,主要是因为乳酸杆菌的胞内肽酶多且胞内肽酶的表达水平较高[5]。有关研究表明,不同胞内肽酶作用于多肽的不同位点且即使是同一种肽酶作用位点也可能不同[6]。蛋白水解体系中各种关键蛋白酶基因的表达在不同菌株、同一菌株不同生长阶段以及不同的菌体生长环境都会有所差异,如氮源含量、氮源种类、培养基的温度和初始p H等都会对关键蛋白酶基因的表达产生影响。基于此,本试验选取保加利亚乳杆菌作为研究对象,分析氮缺乏对保加利亚乳杆菌胞内肽酶基因表达的影响,为进一步深入研究保加利亚乳杆菌生长代谢变化的分子生物学机制提供理论依据。
1 材料与方法
1.1 菌株来源
选用保加利亚乳杆菌(Lactobacillus delbrueckiisubsp.Bulgaricus) LB08006、 LB08007、 LB08012、 L08014、LB08015、LB08016、LB08017作为研究对象,上述菌株均由东北农业大学乳品科学教育部重点实验室(KLDS)乳酸菌菌种库提供。
1.2 培养基
培养基的成分详见表1,使用前需将培养基pH调至6.2,并于121℃灭菌15 min,4℃保存备用。

表1 培养基
1.3 菌株的活化与保存
先将菌株接入MRS液体培养基中活化两代,培养条件为42℃、16~18 h。而后接入MRS固体培养基中纯化,培养24 h后挑取单菌落并接种于MRS液体培养基中培养12 h,备用。菌株于20%甘油中-80℃保存。
1.4 基因表达的检测方法
基因表达检测方法采用qRT-PCR技术,现已被广泛应用于鉴别乳酸菌以及检测乳酸菌中基因的表达差异[7-10]。根据本试验研究目的采用qRT-PCR技术并采取荧光染料法进行相对定量分析。
1.5 关键酶基因在不同菌株之间的表达测定
将7株保加利亚乳杆菌活化两代后接种于MRS液体培养基(42℃发酵18 h),再分别提取菌体RNA并检测其完整性和浓度,而后反转录为cDNA,再对样品进行qRT-PCR检测。
1.6 胞内肽酶基因在氮缺乏培养下的表达测定
将菌株活化两代后分别接种于MRS液体培养基和氮缺乏液体培养基中42℃发酵12 h,分别提取菌体RNA并检测其完整性和浓度,而后反转录为cDNA,再对样品进行qRT-PCR检测。
1.6.1 胞内肽酶基因及管家基因的确定
乳酸菌等细菌在荧光定量PCR实验中所使用的管家基因选择比较普遍且稳定性较好的16SrRNA[11-17]。选择保加利亚乳杆菌蛋白代谢过程中的几种胞内肽酶基因(见表2)作为本试验的目的基因。
1.6.2 PCR引物设计与合成
依据Lactobacillus delbrueckiisubsp.bulgaricusATCC 11842的DNA序列(GenBank accession number:NC_008054.1)中相应基因序列,使用primer5.0软件设计基因的引物序列并由上海生工生物技术有限公司合成16SrRNA,引物详见表3。
1.6.3 RNA的提取及检测
使用RNAprep pure培养细菌总RNA提取试剂盒(天根),按说明分别依次提取在氮缺乏环境和MRS液体培养的菌株RNA,提取时所用的枪头和离心管需要在浓度为1/1 000的DEPC溶液中浸泡过夜,再经121℃,30 min高温高压的灭菌处理。注意需使用DEPC处理水配置溶液以防止RNA酶污染。
用溴化乙锭(EB)对样本进行染色,取3μL RNA样液和2μL的Loadingbuffer于1%琼脂糖凝胶电泳(150 V,15 min),经CDS8000型凝胶分析系统成像后,观察16 s和23 s电泳条带,判断RNA的完整性。
对所提取RNA在260 nm、280 nm处的吸光度进行测定,判断RNA的浓度[18]。
1.6.4 反转录合成cDNA
反转录使用PrimeScript®RT反转录试剂盒且所得的cDNA样本(保存于-20℃)用于qRT-PCR检测。

表2 实时定量PCR的目的基因

表3 实时荧光定量PCR引物

表4 RT反应液成分
利用得到的cDNA以及合成的引物先进行普通PCR试验,而后进行凝胶电泳观察扩增产物的条带的大小和亮度,确保RNA提取成功以及引物特异性完好。
1.6.5 实时荧光定量PCR
使用SYBR®Premix Ex TaqTM试剂盒(Takara公司)配置PCR反应液,使用ABI 7500 Fast Real-Time PCR System进行qRT-PCR试验,反应体系及方法参照杜越欧和侯俊财的方法[19]。
1.7 数据处理与分析
本研究采用2-△△CT法评估目的基因的相对表达量[16,19]。先用Excel对数据进行初步整理,而后的方差分析采用SPSS(11.5)软件进行整理,P<0.05为差异显著。
2 试验结果
2.1 RNA的纯度及完整性
试验得到的RNA样品经电泳分析结果如图1所示,由图可见完整的23S条带和16S条带,这表明RNA的降解程度很小且样品的质量完好。经检测所得的OD260/OD280的数据比值均在1.8~2.0之间,这表明RNA纯度较高。同时,如果RNA样品被基因组DNA污染也会造成后续PCR实验产生非特异性扩增,导致RNA的表达量高于实际量,本实验在总RNA提取试剂盒中配备了DNA酶(DNase I),有效的取出了基因组DNA。经以上检测可知实验中所得的RNA样品可用来进行后续的实时荧光定量PCR实验。提取的RNA样品经反转录合成cDNA后,先要经过普通PCR试验,通过凝胶电泳观察到条带亮度适宜、无杂带且大小与目的基因相符,由此证明反转录过程中没有污染且引物特异性良好。

图1 RNA样品电泳图
2.2 实时荧光定量PCR结果
各样本cDNA经实时荧光定量PCR试验所得目的基因以及管家基因的熔解曲线,见图2。由图可见曲线均呈现出单一峰,由此能够排除实验过程中形成引物二聚体和非特异产物对试验结果所产生的的影响,且引物的特异性良好。
以循环圈数为横坐标,荧光强度变化值为纵坐标绘制扩增曲线,经qRT-PCR试验得的扩增曲线见图3,可以看出管家基因和各目的基因的扩增效率较高,稳定性和CT值的重复性较好,得到的CT值可用于分析试验结果。

图2 管家基因和目的基因PCR产物的熔解曲线

2.3 不同菌株之间关键酶基因的表达情况分析
不同菌株间胞内肽酶基因的表达情况见图4,并将菌株LB08006作为参照菌株。与参照菌株相比其他6株菌中的PepC、PepF、PepQ这三种目的基因的表达量均下降,其中前两种基因在菌株LB08007中表达量最低,PepQ基因在菌株LB08012中的表达量最低。PepT基因在菌株LB08007、LB08014和LB08015中的表达量上调,但是与参照菌株相比其上调幅度不显著,并且在其他菌株中该基因的表达量下降。PepX基因在菌株LB08014中的表达量显著上升(P<0.05),在其他五株菌中表达量均显著下降且在菌株LB08015中下降幅度最大。

图4 不同菌株之间目的基因的表达情况
2.4 氮缺乏对各目的基因表达的影响
2.4.1 氮缺乏对PepC基因的表达的影响
氮缺乏对pepC基因的表达的影响见图5。氮缺乏培养条件下的pepC基因表达水平呈显著下调趋势(P<0.05),平均下降了2.8倍,其中菌株LB08006下降最少,菌株LB08007、LB08016和LB08017下降幅度较大。
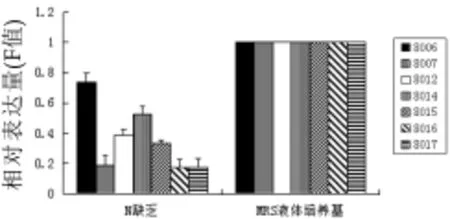
图5 氮缺乏培养下pep C基因表达的动态变化
2.4.2 氮缺乏对pepF基因的表达的影响
氮缺乏对pepF基因的表达的影响见图6。氮缺乏培养条件下的pepF基因表达量显著上调(P<0.05),平均上调3.2倍,其中菌株LB08006、LB08014和LB08015的上调幅度较大,而菌株LB08012的上调幅度是最小的。

图6 氮缺乏培养下pep F基因表达的动态变化
2.4.3 氮缺乏对pepQ基因的表达的影响
氮缺乏对pepQ基因的表达的影响见图7。在氮缺乏培养条件下,菌株LB08006、LB08007和LB08015中的pepQ基因表达量显著上升(P<0.05),平均上调2.6倍;而在其他4株菌中显著下调(P<0.05),平均下调1.7倍。

图7 氮缺乏培养下pep Q基因表达的动态变化
2.4.4 氮缺乏对pepX基因的表达的影响
氮缺乏对pepX基因的表达的影响见图8,7株菌中的pepX基因的表达均呈显著下调趋势(P<0.05),平均下调1.8倍。其中菌株LB08012和LB08016下调幅度较大。

图8 氮缺乏培养下pep X基因表达的动态变化
2.4.5 氮缺乏对pepT基因的表达的影响
氮缺乏对pepT基因的表达的影响见图9。在氮缺乏培养条件时,菌株LB08006、LB08007和LB08015中的pepT基因表达量显著上升(P<0.05),平均上调了1.4倍 ;而 在 菌 株 LB08012、LB08014、LB08016、LB08017中显著下降(P<0.05),平均下调了2.6倍。

图9 氮缺乏培养下pep T基因表达的动态变化
3 讨 论
目前对乳酸乳球菌的蛋白水解系统已经进行了一系列的研究,对参与酪蛋白降解、寡肽的利用以及一些肽的分解路径有了深入的了解[20]。保加利亚乳杆菌蛋白水解体系中关键肽酶基因的表达不仅仅与菌株差异有关,还会受到其他因素影响,如pH[21-22]、菌株生长阶段[23]、培养温度[24]等。虽然关于瑞士乳杆菌和保加利亚乳杆菌的研究也有一定的进展,但是还有许多问题没有探明,尤其是菌株间胞内肽酶基因表达差异及氮环境对菌株胞内肽酶基因表达影响还未涉及。
本试验结果表明,胞内肽酶基因的表达水平在不同菌株之间差异显著,这与吕加平等[25]研究结果一致,主要是因为菌株间的差异性,但规律性不强,足以说明胞内肽酶基因表达情况不仅受菌体自身影响还会受到外界因素影响。在进行乳酸菌培养时,氮源供给量对于菌体蛋白水解体系中胞内肽酶基因的表达是一个限制性因素,氮缺乏对胞内肽酶基因表达产生影响。Guédon等[3]详细分析了不同环境中Lactococcus lactisMG1363蛋白水解体系16个基因的表达变化,研究发现表达水平较高的蛋白水解酶基因受氮源的影响,表达水平较低的基因不受肽供应的影响,本试验研究发现氮缺乏环境下各胞内肽酶基因的表达量的表达情况因菌株不同而不同,这正如Guédon等认为的受菌株自身的生物学特性影响。除了pepC和pepX基因,其他三个目的基因的表达量在氮缺乏培养时均显著升高(P<0.05),这与Vermeulen等[7]研究结果一致,Lactobacillus sanfranciscensisDSM 20451T在面团中生长至对数期时,oppF、dtpT和pepT三个基因的表达量与添加肽的面团基因表达相比,基因的表达量都在未添加肽的面团中最高。这种情况可能是因为酪蛋白胨和大豆蛋白胨中含有乳酸菌生长所需的各种氨基酸、寡肽及生长因子等。菌体在生长初期利用这些氮源大量繁殖,使游离氨基酸和短肽大量积累,缩短菌体进入对数期所用的时间,使其提前进入稳定期。但与方芳等研究结果有所不同,研究发现有机复合氮源能够促进菌体的生长,为菌体提供多种营养物质且产酶活力高,而在无机氮源培养基中培养时菌体生长缓慢[26],主要原因是无机氮源使培养基pH值过低、氮源缺乏,从而抑制乳酸菌生长。
4 结论
本试验结果表明,氮缺乏培养条件下,pepF基因表达量比MRS液体培养条件下显著上调(P<0.05),平均上调3.2倍,而pepX和pepC基因表达水平呈显著下调趋势(P<0.05);氮缺乏培养条件下,菌株LB08006、LB08007和LB08015中pepT和pepQ基因表达量上调,而在菌株 LB08012、L08014、LB08016和LB08017pepT和pepQ基因表达量则是下调的。因此,氮缺乏可显著影响保加利亚乳杆菌胞内关键肽酶基因的表达,且在不同菌株间表现出不同的表达量,培养基中氮源的供给是保加利亚乳杆菌的胞内肽酶基因表达限制性因素之一。
