一种商用乳品发酵剂中微生物的组成分析
2019-04-01徐伟良郭梁李春冬郭元晟郝苗苗王亚慧王东玉朱建军钱俊平雅梅
徐伟良,郭梁,3,李春冬,郭元晟,3,郝苗苗,王亚慧,王东玉,朱建军,钱俊平,3,雅梅,3
(1.锡林郭勒职业学院,内蒙古锡林浩特026000;2.锡林郭勒生物工程研究院,内蒙古锡林浩特026000;3.锡林郭勒食品检验检测和风险评估中心,内蒙古锡林浩特026000)
0引 言
乳品发酵剂通常指用于酸奶、奶酒、奶豆腐、奶酪、奶油等发酵产品生产的细菌以及其他微生物的培养物。市场上常见发酵剂大多由益生菌组成,例如,酸奶发酵剂一般由嗜热链球菌和保加利亚乳杆菌两种乳酸菌组成[1];马奶酒发酵剂由酵母菌联合嗜酸乳杆菌及瑞士乳杆菌组成[2];蒙古族奶豆腐发酵剂由乳酸链球菌和乳油链球菌组成[3]。益生菌(Probiotics)是一类能够促进宿主肠内微生物菌群的生态平衡,对宿主健康或生理功能产生有益作用的活性微生物[4]。迄今为止,科学家已发现的益生菌大体上可分成三大类,其中包括乳杆菌属(如干酪乳杆菌、嗜酸乳杆菌、植物乳杆菌、詹氏乳杆菌等);双歧杆菌属(如长双歧杆菌、短双歧杆菌、嗜热双歧杆菌、卵形双歧杆菌等)和革兰氏阳性球菌属(如乳球菌、粪链球菌、中介链球菌等)[5-7]。此外,明串球菌属、丙酸杆菌属和芽孢杆菌属的部分菌种株,以及一些霉菌与酵母菌等亦可归入益生菌的范畴[8]。
利用分子生物学方法对微生物多样性的鉴定可分为非培养模式与培养模式两种[9]。非培养模式采用直接从样品中提取微生物的核酸,通过菌群的核酸进行序列分析。这种非培养模式的分子生物学方法避开了微生物分离培养的过程,能够更加深入快捷的了解微生物的多样性[10]。然而这种方法也存在一定的弊端,引物与模版的匹配性、样品中微生物含量过少、一些核酸片段的共泳效应等问题的存在,都可能导致核酸的不可检测。培养模式一般是通过传统的微生物分离方法进行大量的平板分离,选择合适的培养基对分离的微生物进行培养。通常选择乳酸细菌培养基(MRS)对乳酸菌进行培养,马铃薯葡萄糖琼脂培养基(PDA)对酵母菌等真菌进行培养[11]。根据菌落的形态和颜色进行随即挑选,进一步使用随机扩增多态性PCR(Random Amplified Polymorphic DNA-PCR,RAPD-PCR)、限制性内切酶片段长度多态性(Restriction Fragment Length Polymorphism,RFLP)、基因外重复回文系列PCR(Repetitive Extragenic Palindromic,Rep-PCR)、脉冲场凝胶电泳 (Pulsed Field Gel Electrophoresis,PFGE)等方法对微生物的亲缘关系及多样性进行分析[12-13]。然而在菌落挑选阶段,由于大量的菌落基本相似,难以凭肉眼区分,这在一定程度上影响了多样性研究的准确性。因此,将非培养模式与培养模式两种方法结合使用,对微生物多样性的鉴定分析,才能更加准确有效。
蒙古族乳制品历史悠久,作法考究,风味独特,是蒙古族人民的必需食物之一[14]。锡林郭勒盟地区作为内蒙古的产乳大盟,也是三大绿色黄金乳源基地之一,具有丰富的传统乳制品资源,包括奶豆腐、酸奶、奶酒、奶皮子、奶酪、稀奶油及黄油等[15]。遗憾的是,这些乳制品的生产仍处于传统的手工作坊阶段,大多数产品采用自然发酵,导致质量差异很大,且不稳定。以传统奶豆腐为例,其在发酵过程中采取的即为自然发酵,利用自身和环境中的微生物进行发酵,但由于在整个发酵过程中微生物环境比较复杂且存在不确定性,生产出的奶豆腐的感官、品质都不稳定,不能大规模、工业化生产[16]。因此,为了更好地开发蒙古传统乳制品,研发适合乳制品发酵的发酵剂,提高了产品的品质和稳定性,使传统蒙古族乳制品形成规模化、产业化,是具有非常重要的意义。
1 器材与试剂
1.1 材料
商用发酵剂(购于商业公司,微生物成分保密)。
1.2 试剂
Takara快速提取试剂盒(Code No.9164);100 bp DNA Ladder(Lot#L20208);EasyTaq®PCR Super Mix(Lot#K20614);Takara Mini BEST Agarose Gel DNA Extraction Kit Ver.4.0(Code No.9762);MRS培养基:蛋白胨10 g、牛肉粉7.5 g、酵母浸粉5 g、磷酸氢二钾2 g、柠檬酸二铵 2 g、乙酸钠 5 g、葡萄糖 20 g、吐温-80 1 mL、硫酸镁0.58 g、硫酸锰0.25 g、琼脂15 g、蒸馏水 1 L,pH 7.0,121℃灭菌20 min;PDA培养基:马铃薯切片200 g、葡萄糖20 g、琼脂20 g、蒸馏水 1 L,pH 7.0,121℃灭菌20 min。
1.3 仪器
FA2004N电子天平、SW-J-2FD净化工作台、HWS-250BX恒温恒湿培养箱、厌氧袋(含产气包、厌氧指示剂)、2720 Thermal Cycler PCR扩增仪、MLS-3751L-PC高温高压灭菌锅、5418R台式高速离心机、WD-9413B凝胶成像仪、琼脂糖凝胶电泳系统。
2 实验方法
2.1 乳品发酵剂供试样品的分子鉴定
2.1.1 DNA提取
发酵剂的基因组总DNA采用Takara快速提取试剂盒对其进行提取。取50μL Lysis Buffer for Microorganism to Direct PCR于灭菌的EP管中。用灭菌枪头挑取单菌落,置于EP管中搅拌几下。80℃热变性15 min,低速离心(8000 rpm,5 min),将上清液取出放入新的EP管中,作为PCR反应的模板。
2.1.2 PCR扩增
选用真菌通用引物ITS1/ITS4与ITS4/ITS5扩增5.8S rDNA基因片段。引物序列分别为:ITS1(5'-TCCG TAGGTGAACCTGCGG-3'),ITS4(5'-TCCTCCGCTTATTGATATGC-3'),ITS5(5'-GGAAGTAAAAGTCGTAACAAGG-3')。细菌选用16S rDNA V3片段的 2对通用引物(27F/1495R)用于扩增。引物序列分别为:27F(5'-AGAGTTTGATCCTGGCTCAG-3'),1495R(5'-CTACGGCTACCT-TGTTACGA-3')。扩增结果用1.2%琼脂糖凝胶电泳检测。
2.1.2.1 PCR反应体系
40μL反应体系:模板DNA 2μL、引物各2μL、dd H2O 14μL、EasyTaq PCR Super Mix 20μL。
2.1.2.2细菌PCR反应条件
94℃预变性5 min;94℃变性 1 min、58℃退火1 min、72℃延伸2 min,共30循环;72℃末端延伸10 min;
2.1.2.3 真菌PCR反应条件(Touchdown)
第一阶段,95℃预变性 3 min;95℃变性30 s、69℃退火30 s、每循环降低退火温度1℃、72℃延伸1 min,共15循环。第二阶段,95℃变性30 s、47℃退火30 s、72℃,延伸 1 min,共20循环;73℃加强延伸1 min。
2.1.3 序列测定
将PCR扩增产物利用Takara MiniBEST Agarose Gel DNA Extraction Kit Ver.4.0进行回收。具体步骤如下:在紫外灯下切出含有目的DNA的琼脂糖凝胶放置于EP管中,向胶块中加入溶解液Buffer GM,振荡混合,放入50℃金属浴中溶解胶块。将溶解的胶块溶液转移至Spin Column,12 000 rpm离心1 min,弃滤液。再将700μL的Buffer WB加入 Spin Column中,室温12 000 rpm离心1 min,重复上述操作一次。将Spin Column安置于新的EP管上,在Spin Column膜的中央处加入30μL灭菌蒸馏水静置1 min后室温12 000 rpm离心1 min洗脱DNA。将回收的DNA扩增产物送北京睿博生物科技有限公司,用相同引物进行测序。测序结果经拼接后在NCBI数据库中进行BLAST同源比对。
2.2 发酵剂样品中益生菌的分离培养
取一定量无菌处理好的样品转移至50 mL含0.85%生理盐水的三角瓶内,将三角瓶在漩涡振荡器上振荡3 min。震荡后用接种环取稀释后的菌液,分别在PDA、MRS两种平板培养基上进行划线,将MRS平板倒置于37℃恒温培养箱中,厌氧培养3 d;PDA平板倒置于30℃恒温培养箱中,培养5 d,观察菌落生长状况。
2.3 分离菌种的分子鉴定
通过菌落观察PDA平板培养基中未有微生物菌落生长,因此,只在分离培养的6个平行皿的MRS平板培养基中,分别随机挑取3个单菌落进行基因组总DNA的提取。同样采用Takara快速提取试剂盒对菌落总DNA进行提取,PCR扩增同“2.1.2.2”PCR反应条件。
3 结果与讨论
3.1 发酵剂DNA测定结果
将乳品发酵剂以细菌27F/1495R为引物,设置3个平行,进行PCR反应,并将扩增产物进行琼脂糖凝胶电泳(如图1A)。由图1A可知,D1、D2、D3的三个重复电泳条带在1 500 bp处清晰且唯一,没有其他杂带,说明该条带是经过PCR扩增反应得到的特异性带,符合27F/1495R为引物的目的条带大小。将乳品发酵剂分别以真菌ITS1/ITS4和ITS4/ITS5为引物,并设置3个平行,进行PCR反应,并将扩增产物进行琼脂糖凝胶电泳(如图1B)。由图1B可知,分别以ITS1/ITS4和 ITS4/ITS5为引物的3个平行样(D1~D3与d1~d3),均未出现目的条带,可推测发酵剂中不含酵母菌等真菌菌群。并由图1C发酵剂供试样基因测序结果可知,基因测序序列有杂峰,在排除样品干扰的情况下,推测可能存在多类乳酸菌,因此,将发酵剂进行菌种分离培养,进一步对其进行菌种鉴定。
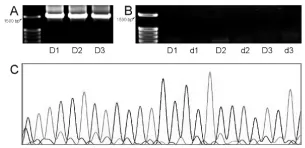
图1 发酵剂PCR扩增产物电泳图与序列测定结果
3.2 发酵剂菌种分离培养结果
将乳品发酵剂通过微生物培养方法,分别接到MRS和PDA平板培养基进行培养,培养结果如图2。由图2可知,发酵剂在PDA平板培养基中未有微生物菌落生长,与图1B电泳结果一致,因此可以确定,发酵剂中不含酵母菌等真菌菌群。由MRS培养基上划线培养结果可知,MRS有乳酸菌菌落生长,且通过观察,发现存在不同形态特征的单菌落,因此可以推断发酵剂中不仅存在一种发酵剂菌群,还需进一步对菌株进行基因鉴定。
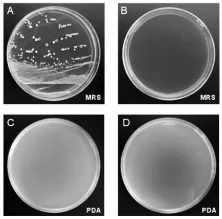
图2 发酵剂菌种分离培养结果
3.3 发酵剂菌种序列鉴定结果
随机挑取MRS培养基上18个单菌株(C1-C18)进PCR扩增,并经琼脂糖凝胶电泳验证后,送测序公司进行序列测序。经NCBI数据库中进行BLAST同源比对表明,18个单菌株ident均为100%,其中13株为植物乳杆菌(Lactobacillusplantarum);5株为干酪乳杆菌(Lactobacillus casei)。
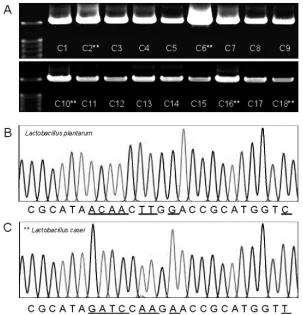
图3 发酵剂菌种PCR扩增产物电泳图与序列测定结果
4 结论与讨论
通过基因鉴定(16SrDNA和ITS)与分离培养两种方式对发酵剂中微生物组成进行分析,最终确定该种商用发酵剂是由植物乳杆菌(L.plantarum)和干酪乳杆菌(L.casei)组成。植物乳杆菌(L.plantarum)是乳酸菌的一种,广泛存在自然发酵乳制品中,是许多发酵食品挥发性风味形成的重要菌株。植物乳杆菌能够产生有机酸、细菌素、双乙酰等多种天然活性成分,具有维持肠道内菌群平衡,提高机体免疫力,促进营养物质吸收等多种保健作用[17-18]。干酪乳杆菌(L.casei)属于乳杆菌属(Lactobacillus)的乳酸菌,与常用的嗜酸乳杆菌和双歧杆菌两大益生菌,一起被称为“健康三益菌”。干酪乳杆菌能够水解蛋白质,具有非常显著的产酸和产香能力,常作为增香的辅助发酵剂应用在发酵制品生产中[19-20]。通过对以上对两种乳杆菌的研究,可以认定该种商用乳品发酵剂能够增加发酵乳制品的风味,提高其品质,在发酵乳制品的生产加工中具有重要的作用。目前,随着我国人均生活消费水平的不断提高,消费者对具有营养保健功能的益生菌发酵乳制品的需求越来越大,使得益生菌发酵剂具有极为广阔的市场应用前景。然而,现有商业发酵剂的种类较少、微生物多样性较低、供需的巨大差异等局限性,从而鼓励研究人员从自然发酵食品中分离、鉴定以及开发益生菌资源。本研究中的微生物培养、分离及鉴定为锡林郭勒草原自然发酵乳制品中的益生菌资源开发提供了有益借鉴。
