小鼠骨髓来源巨噬细胞内多肽的分离鉴定
2019-04-01李阜烁汪超林文珍范梦珠YacineHemar洪志骏陈平张少辉
李阜烁,汪超,林文珍,范梦珠,Yacine Hemar,洪志骏,陈平,张少辉,
(1.上海交通大学农业与生物学院,上海200240;2.浙江熊猫乳业集团股份有限公司,浙江温州325800;3.浙江辉肽生命健康科技有限公司,浙江温州325800)
0 引 言
随着生活水平的提高,人们对饮食的要求从“追求量”转变为对“质”的追求。因此对具有特殊功能的生物活性肽的研究成为热点。生物活性肽主要是由2~20个氨基酸组成的蛋白质片段[1]。现已从食物中发现了很多不同种类的生物活性肽,例如从发酵乳[2-3]、大豆[4]、花生[5]以及动物皮肤[6]发现了很多具有生物活性的多肽,而且实验验证可能具有抗氧化、抗菌、抗癌、免疫调节、降血压等功能。
巨噬细胞是机体抵御外界有害物质入侵的第二道防线,广泛存在于机体各种组织中,是主要免疫应答细胞,通过吞噬及分泌细胞因子参与免疫应答、免疫调节等生物学功能,在免疫系统中发挥着重要的作用[7]。对于巨噬细胞的研究有很多,但是针对巨噬细胞中存在的多肽的研究甚少。因此,在巨噬细胞发挥免疫功能时,是否有多肽参与并发挥作用是一个值得探究的课题。
本课题以小鼠骨髓来源巨噬细胞为研究对象,研究巨噬细胞内的多肽,建立巨噬细胞多肽数据库,为后续研究巨噬细胞中多肽具有的生物活性和作用奠定基础。
1 实 验
1.1 材料与设备
材料:Balb/c小鼠(SPF级,雄性6~8周龄),10 ku超滤管,40μm细胞筛网,Corning 10cm细胞培养皿,Ziptip C18柱。
试剂:DMEM完全培养液(青霉素100 U/mL、链霉素100μg/mL和10%胎牛血清),M-CSF,磷酸盐缓冲液(PBS),EDTA,红细胞裂解液,PE标记的抗小鼠F4/80抗体,APC标记的抗小鼠CD11b抗体,脂多糖(LPS),二硫苏糖醇(DTT),碘乙酰胺(IAA),乙腈,甲酸。
设备:BJ-2CD超净工作台,GL-22M高速冷冻离心机,BD FACSCalibur流式细胞仪,手术剪,超声波破碎仪,细胞培养箱,离心浓缩干燥仪,纳升液相色谱-四极杆飞行时间串联质谱联用仪,电热恒温水浴锅。
1.2 方法
1.2.1 小鼠骨髓巨噬细胞的获取
依据动物实验有关规定,采用快速脊椎脱臼法处死小鼠,用体积分数为75%酒精浸泡5 min,对小鼠进行体表消毒杀菌。将小鼠移置已经紫外线杀菌的超净台中,用消毒后的手术剪将两侧大腿取下,剥离皮肤和肌肉组织,得到干净的股骨和胫骨置于细胞培养皿中。用无菌手术剪剪开股骨上下两侧,用冷PBS将骨髓冲出,直到骨髓腔发白为止。骨髓冲洗悬液过40μm细胞筛网,使组织分散成单个细胞,对悬液进行离心,离心条件为4℃,400 g,5 min。弃去上清液,向离心管中加入适量红细胞裂解液,用枪头吹打均匀,再混匀后,室温放置1 min,迅速加入10倍量的PBS中和,在4℃,400 g条件下离心5 min,弃上清。
用DMEM完全培养液重悬细胞,将细胞均匀接种至细胞培养皿中,加入M-CSF使其终质量浓度为50 ng/mL,在37℃质量分数为5%的CO2,95%湿度条件下培养3 d后更换新鲜培养基,再继续培养至7 d后,得到分化完全的小鼠骨髓来源的巨噬细胞[8-9]。
1.2.2 流式分析骨髓来源巨噬细胞纯度
弃去培养皿中的培养基,用PBS洗涤贴壁细胞,加入质量分数为0.25%的EDTA溶液,37℃下放置15 min,镜下观察消化状态。待消化完全加入等体积完全培养液,终止消化,收集细胞于15 mL离心管中,再以4℃(400 g)5 min的条件进行离心,弃去上清液,用完全培养液重悬细胞并用血细胞计数板计数。加入PE标记的抗小鼠F4/80抗体,APC标记的抗小鼠CD11b抗体,在4℃下孵育30 min,避光,用流式细胞仪鉴定所诱导的巨噬细胞成功比例[10]。
1.2.3 构建炎症细胞
诱导的巨噬细胞培养7 d后,换细胞培养液,实验组加质量浓度为100 ng/mL LPS刺激,对照组加等量的PBS液。继续培养4 h,加入质量分数为0.25%的EDTA溶液消化,收集细胞于离心管中并计数。
1.2.4 胞内多肽样品的分离
将离心管中细胞(约107个)在4℃(1530 g)5 min的条件下进行离心,离心后弃上清,收集的细胞用4℃冷却的PBS洗涤两次,加入400μL的PBS溶液重悬细胞,将细胞悬液放在冰盒上进行超声破碎,超声破碎功率为40 W,破碎时间10 min,超声时间3 S,间隔5 S。将破碎后的混合液进行低温离心,离心条件为4℃(13 700 g)15 min。离心后取上清,加入浓度为1 mol/L的DTT至终浓度为50 mmol/L,在56℃的恒温水浴锅中保温30 min。向上清中加入40μL浓度为1 mol/L的IAA溶液,室温避光反应20 min。在4℃(13 700 g)15 min条件下进行离心分离,收集上清液,即为胞内多肽提取液。保存在-20℃条件下备用。
将获得的胞内多肽提取液用10 ku超滤管进行超滤,超滤条件4℃(13 700 g)1 h。收集超滤液,滤液用离心浓缩干燥机进行干燥,干燥后的样品经Ziptip C18脱盐处理,备用。
1.2.5 纳升液相色谱-四极杆飞行时间串联质谱联用分析
溶液配制:(1)溶解缓冲液为质量分数0.1%甲酸溶液;(2)洗涤缓冲液为质量分数0.1%甲酸溶液;(3)洗脱缓冲液为质量分数20%乙腈0.1%甲酸溶液;(4)上样缓冲液为质量分数2%乙腈和0.1%甲酸溶液。配制过程中所用水均是超纯水。
Ziptip分别用100%乙腈和0.1%甲酸水平衡,将干燥后的固体样品溶于20μL质量分数为0.1%甲酸水溶液中,振荡10 min,用平衡后的Ziptip反复吸打样品,用100μL 0.1%甲酸洗涤后,用20μL含20%乙腈、0.1%甲酸洗脱缓冲液洗脱样品,洗脱后的样品用离心浓缩干燥仪干燥,50~55℃、10 min。干燥后的样品加入30μL上样缓冲液溶解,溶解后的样品进行离心,条件为15 650 g、10 min、室温。取上清液加入样品瓶进行LC-MS分析,为防止仪器误差,每个样品做三次质谱分析。
HPLC-MS条件及过程:样品分析是由Nano LC-QTOFMS/MS(纳升液相色谱-四极杆飞行时间串联质谱联用)系统完成,它的最大操作压力为68.95 MPa,分辨率大于20 000,使用的多肽富集柱为C18反相柱(75 mm×2 cm×3μm),液相色谱分析柱为C18反相分析柱(75 mm×15 cm×3μm)。样品进样量为1 μL,流动相A是0.1%甲酸水混合液,流动相B为乙腈(含质量分数0.1%甲酸)。流动相流速为250 nL/min,流动相梯度变化如下:在10 min内的起始梯度为2%的流动相B;110 min内流动相B上升到20%;到125 min时,流动相B上升到30%;60 s内上升到80%的流动相B,并维持10 min;再下降至2%的流动相B并维持15 min,最后系统用100%流动相A平衡15 min。质谱分析时采用ESI+模式,质谱电喷雾毛细管电压设置为2 000 V,气体流速设为2.0 L/min,离子源温度为150℃,选择电荷数+1,+2,+3和+4的母离子且质核比为100~1 500 u的进行二级碎裂,采用数据依赖性采集(DDA)模式进行扫描。
1.3 数据分析
以UniProt(http://www.uniprot.org/)中小鼠的数据作为现有蛋白数据库进行搜索比对。检测结果使用Data Analysis4.1软件提取离子峰生成mgf文件,小鼠多肽序列通过Mascot 2.4搜索引擎搜索匹配以上蛋白氨基酸数据库得到。
检测过程中设置的条件:母离子质量容差为2.5×10-5;二级谱图质量容差为0.050 u,固定修饰为Carbamidomethyl(C),可变修饰为Oxidation(M)。多肽选择的分数>15,p值设置为p<0.05,一个蛋白至少检出一条肽段。
2 结果与讨论
2.1 流式分析巨噬细胞纯度
获取小鼠骨髓细胞并用M-CSF诱导后,于第7天用流式细胞仪检测巨噬细胞的情况。结果显示F4/80和CD11b阳性,并且巨噬细胞纯度达到98%以上,结果如图1所示。因此认为小鼠骨髓来源的巨噬细胞培养成功。
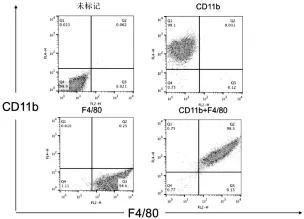
图1 流式检测7d后小鼠骨髓来源巨噬细胞纯度
2.2 NanoLC/Q-TOFMS/MS分析结果
以UniProt(http://www.uniprot.org/)中小鼠蛋白数据库作为多肽检索数据库,用Mascot 2.4搜索引擎检索以上蛋白数据库,人工筛选p<0.05的所有和母体蛋白序列相配对的多肽片段,并在三次质谱中最少出现两次的多肽序列,以此确定分离得到的多肽。数据通过DataAnalysis分析,三次质谱分析结果如图2所示。经过统计分析质谱结果,在本次研究中共鉴定得到340条多肽,实验组检测得到的多肽有242条,来源于80条前体蛋白;对照组有255条,来源于92条前体蛋白(多肽数量如下图3所示)。发现其中部分多肽序列在两个实验组中共同存在,数量为157条,从种类和数量上可以看出,巨噬细胞内多肽种类比较复杂。
在经过LPS刺激后,与对照组相比巨噬细胞内新增85条多肽,这些新增的多肽可能在巨噬细胞的免疫反应过程中发挥着重要的作用,其中157条是巨噬细胞受到刺激前后均存在的胞内多肽。Gelman[11]等人在对人类细胞系SY5Y,MCF7和HEK293进行多肽组学分析时,在三种细胞内分别检测到多肽102条、110条和219条,其中有114条多肽至少在两种细胞中同时存在。这不仅说明细胞内多肽的复杂性,也反映出不同细胞内会有相同的多肽存在,这一结果与本研究中出现的结果一致。
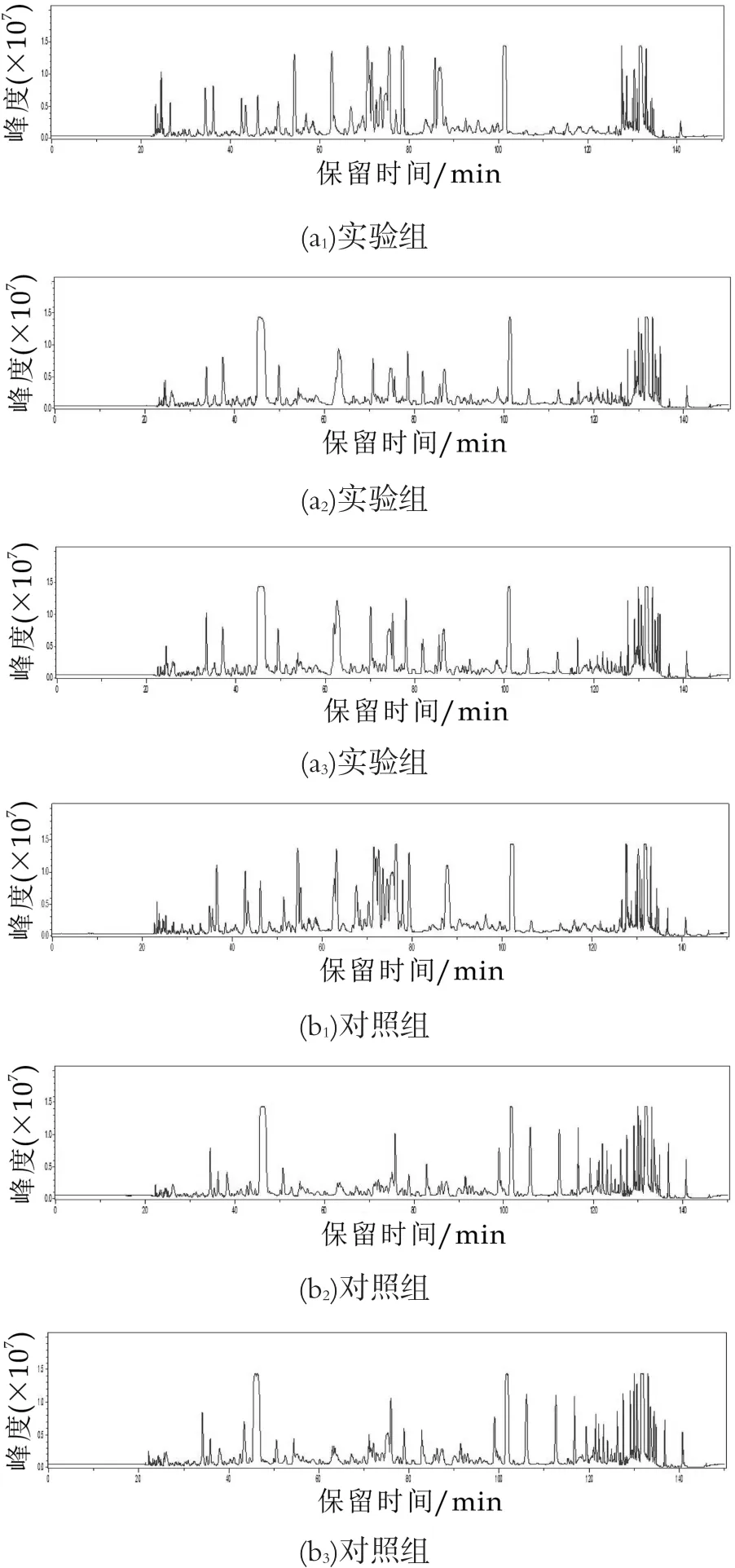
图2 小鼠骨髓来源巨噬细胞胞内多肽的Nano LC–MS/MS质谱图

图3 检测到的BMDM中所有多肽维恩
本研究中得到的多肽大多来自波形蛋白、半乳糖凝集素1、组织蛋白酶B,因为多肽属于蛋白的一部分,蛋白发挥功能时和组成蛋白的多肽片段有很大的关系,因此从蛋白功能的角度猜测可能多肽可能的生物活性。波形蛋白是一种中间丝蛋白,主要表达于巨噬细胞、中性粒细胞等中胚层起源的间充质细胞中。波形蛋白具有维持细胞的正常形态的功能,并且参与细胞凋亡、细胞迁移和细胞免疫等过程[12]。半乳糖凝集素1可通过调节参与固有和适应性免疫的关键调节分子(例如FcγRI和MHC-II)的表达和功能对巨噬细胞进行一定的调节作用,也可以通过ERK1/2依赖性途径调节单核细胞活性,但不会影响人单核细胞的存活[13]。组织蛋白酶B参与细胞凋亡过程,当细胞受损时(如炎症反应、氧化应激等),溶酶体膜通透性增大,甚至破裂,大量组织蛋白酶B释放到细胞浆或细胞间隙中,可能激活细胞凋亡信号,造成细胞凋亡[14]。蛋白质是由氨基酸以“脱水缩合”的方式组成多肽链,再由多肽链经过盘曲折叠形成的具有一定空间结构的物质,因此蛋白质发挥其生理功能与氨基酸组成密切相关,通过前体蛋白的功能来预测其多肽可能具有的活性。这3条蛋白都在细胞免疫过程中发挥重要的作用,因此来自于这些蛋白的多肽可能存在免疫调节功能。
将得到的多肽序列通过谷歌(https://www.google.com.hk/)、欧洲专利局(http://www.epo.org/)、专利检索及分析(http://www.pss-system.gov.cn/sipopublicsearch/portal/uiIndex.shtml和PCT(http://www.wipo.int/pct/en/)等网址进行搜索比对,确定被报道和未被报道的多肽。未被报道的多肽即为本课题新发现的多肽,结果如图4所示。最终发现实验组的242条多肽中有61条为新发现的肽,有28条仅在实验组中发现,(见表1),对照组有74条新发现的多肽,有41条仅在对照组中发现(见表2),其中有33条为两者共有的多肽。

图4 检测到的BMDM中新发现多肽维恩
在两组中共有的33条多肽,它们的母体蛋白及氨基酸序列分别:为,半乳糖凝集素1为:GEVASDAKSFVLNL,KVRGEVASDAKSFVLNL,DQADLTIKL;波形 蛋白为 :NKILLAELEQL,EQQNKILLAELEQL,LEQQNKILLAELEQL,SLPLVDTHSKRTLL,SVP-GVRLLQDSVD,、TTSTRTYSLGSALRPSTS;肽基-脯氨酰顺反异构酶A为:NAGPNTNGSQFFICTAKTEWL,ANAGPNTNGSQFFICTAKTEWL,ANAGPNTNGSQFFICTAKTEWLDGKHVVF;组织蛋 白 酶 B:为IDLPETFDAREQW,DIDLPETFDAREQW,GIESEIVAGIPRTD,GIESEIVAGIPRTDQ;组织蛋白酶Z为SNDGIEYWIVRN;SH 3结构域结合富含谷氨酸的蛋白质为:QDTLQEFLKLA;脱氧核糖核酸酶-2-α为:LSCYGDSGQPVDWFVVYKLPAHSG;胱抑素-B为:KRQIVAGTNLFIKV;ATP合成酶亚基d,线粒体为:KSWNETFHARLASL;甾醇调节元件结合蛋白1为:LAASNLALSAL;溶菌酶C2为:SALLQDDITAAIQCA和NRGDQSTDYGIFQI;附睾特异性α-甘露糖苷酶为:ILSVPGWTYSR;补体成分1 Q子成分结合蛋白为:LHTEGDKAFVEFLTDEI;半乳糖凝集素3为:GTVKPNANRIVLDF;原肌球蛋白α-4链为:KTIDDLEEKLAQ;磷脂酶D 4为:QPGATTVQEQLR;细丝A为:HIPGSPLQFYVDYV;组织蛋白酶D为:EPVSELLKNY;丝切1为EKLGGSAVISLEGKPL和KEILVGDVGQTVDDPYTTFV。
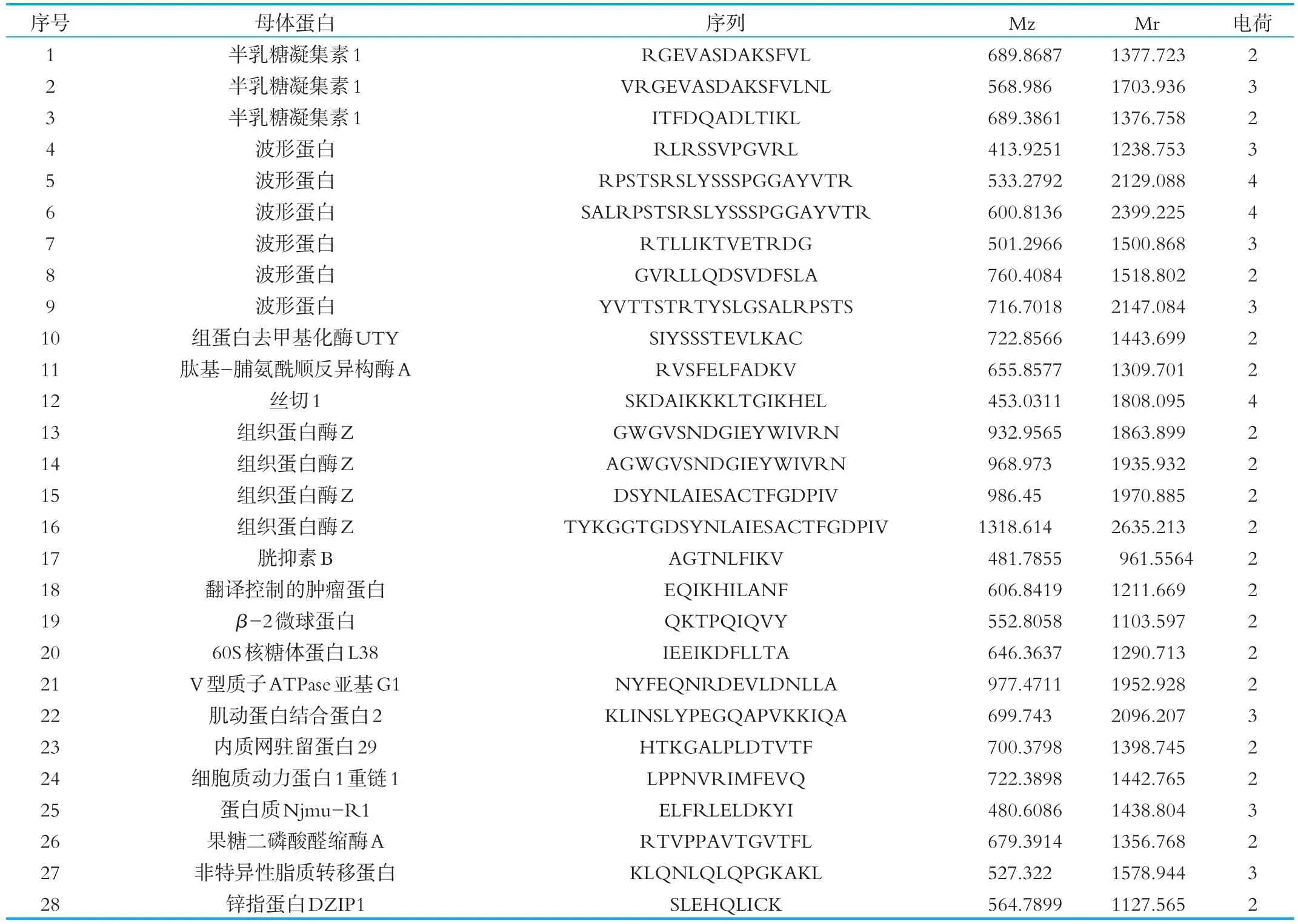
表1 实验组胞内鉴定的多肽序列
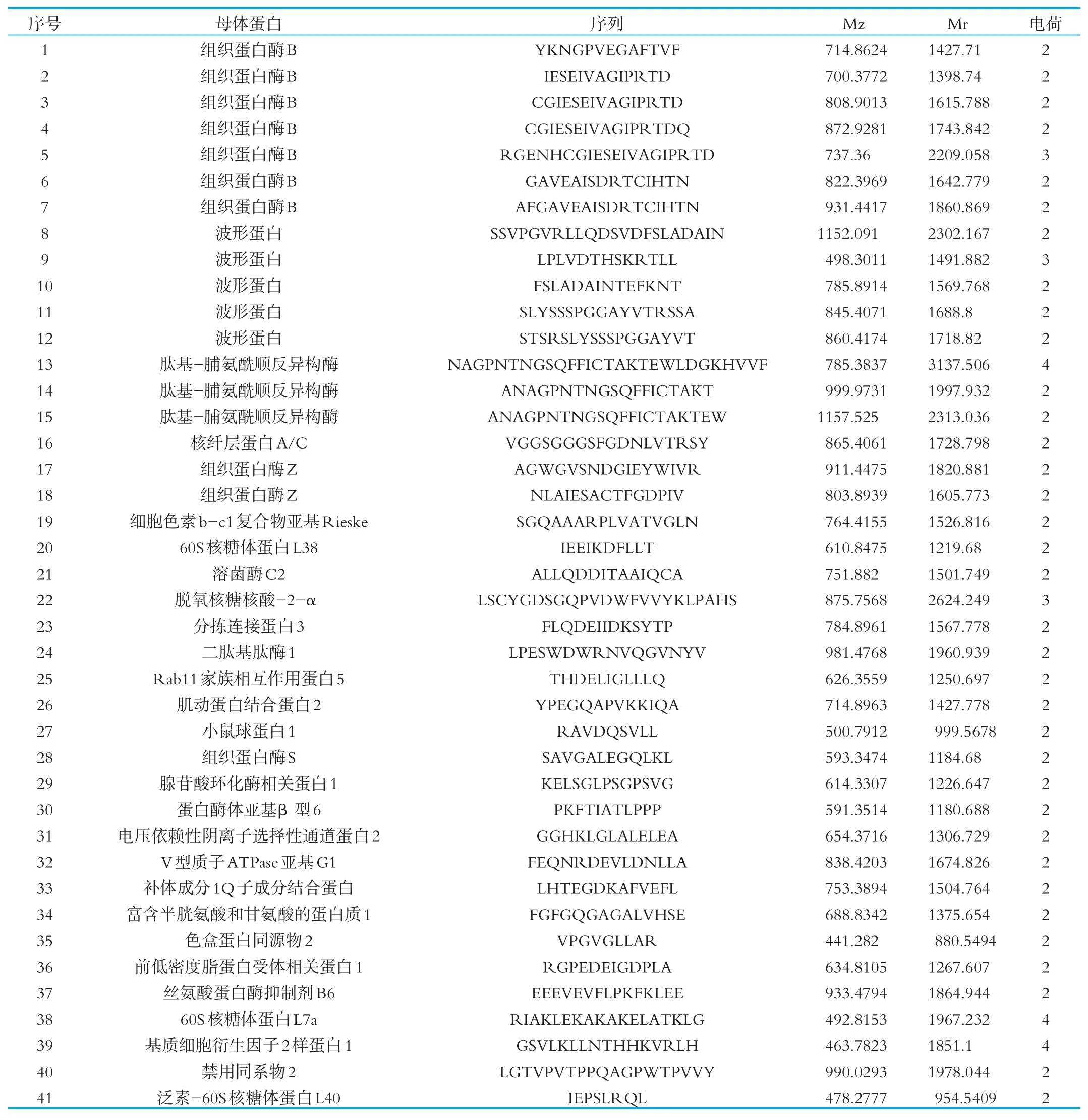
表2 对照组胞内鉴定的多肽序列
从多肽序列中可以看出,本研究中得到的多肽主要是C端氨基酸为亮氨酸(Leu),而多肽的生理活性和其末端氨基酸的种类有一定的关系。在之前的研究发现,具有DPP-IV抑制性的多肽具有共同的特征:N-末端为疏水性氨基酸Trp,Leu,Ile或Phe、第二位为Pro或Ala,C-末端氨基酸为Pro[15-16]。但是本次研究中得到的多肽功能与其末端氨基酸之间的关系还需进一步探究。
在本研究中共有102条新发现的多肽,由8~29氨基酸组成,其中以10~20氨基酸肽数量最多,有85条,占据83%,均是3 ku以下的多肽(结果如图5所示),在之前的研究中也出现过类似的情况。Yin[17]等人对小鼠和大鼠星形胶质细胞多肽进行分析,结果鉴定出57条来自24条母体蛋白的多肽,其中10~20氨基酸肽有42条,0~10肽有10条,20~30肽有5条。在对人细胞系SH-SY5Y,MCF7和HEK293进行多肽分析时发现,三种细胞中共鉴定了272条多肽,这些多肽的分子量在578~3256 u,平均分子质量约为1374 u,也即得到的多肽平均为10肽[11]。这些小分子多肽与很多研究中发现的有生物活性多肽相似:一般由3~30个氨基酸组成,分子量在3 ku以下[18-20]。Bowdish[21]等人在研究来源于牛中性粒细胞的13氨基酸肽indolicidin的免疫功能时发现,多肽indolicidin在巨噬细胞样细胞系中抑制LPS诱导的TNF-α产量。Elfahri等[22]采用3种瑞士乳杆菌菌株ASCC474,ASCC1188和ASCC13153在37℃条件下发酵牛奶蛋白;获得含有4~18个氨基酸残基的短肽混合物,这些肽具有免疫调节的功能,均可以促进人外周血单核细胞(PBMCS)中IL-10的分泌与IFN-γ的表达量。从巨噬细胞中发现的这些小分子多肽很有可能存在一些生物活性,其功能特性还有待研究。

图5 新发现的多肽氨基酸数分布
3 结束语
本实验采用小鼠骨髓来源巨噬细胞作为研究对象,对获得的巨噬细胞进行超声破碎后,用10 ku超滤管处理,采用纳升液相色谱-四极杆飞行时间质谱联用仪(Nano LC-Q-TOFMS)对巨噬细胞胞内的所有多肽进行了全面扫描及鉴定分析,全面分析探索小鼠巨噬细胞来源的多肽的种类、数量,比较LPS刺激组和未刺激组多肽种类及数量,分析可能的生物活性。实验结果最终建立了一个特定的“肽数据库”,包含340条胞内多肽,发现其中102条是从未公开报道的新肽,这些多肽大多数都是由20个以下氨基酸组成的多肽,具有潜在的生物活性。关于这些多肽所具有的生物活性和功能还需进一步研究。现在市面上已经出现生物活性肽产品,本研究为动物体内具有特定功能的生物活性肽产品的开发提供借鉴。
