利福平胶囊的微生物限度检查方法的研究
2019-03-13董自艳易大为张亚杰
董自艳 易大为 张亚杰
(1 辽宁省抚顺市药品检验检测中心,抚顺 113006;2 辽宁省药品检验检测院,沈阳 110035)
利福平(rifampicin)是利福霉素B的一种衍生物,其抗菌力强、抗菌谱广、能低浓度抑菌和高浓度杀菌。它对结核杆菌、多数革兰阳性菌有强大快速的抗菌作用,对麻风杆菌、某些革兰阴性菌有抑菌作用[1]。利福平为红色或暗红色的结晶状粉末,不溶于水。一般制成胶囊或片剂的口服药,与其他抗结核药合用起协同作用。主要用于治疗结核病、脑膜炎和金黄色葡萄球菌感染,外用可治疗沙眼等[2]。
利福平的抑菌活性很强,2015年版中国药典强调的方法学适用性试验更显重要性,只有采用适宜方法去除抑菌活性,才有可能检出药品中污染的微生物,避免检验结果假阴性,从而保证微生物限度检查方法的科学性,以有效控制药品质量[3]。而文献中虽有滴眼用利福平的微生物限度检查方法的报道,却未见利福平胶囊微生物限度检查方法的报道[4-5],而且滴眼用利福平的微生物限度检查方法与本文所建立的利福平胶囊微生物限度检查方法的差异很大。基于此,本文按照2015版中国药典四部非无菌产品微生物限度检查方法的要求,对利福平胶囊进行方法学适用性试验,建立的微生物限度检查方法,对同类药品的微生物学检验具有一定的指导意义,具体研究如下。
1 材料
1.1 供试样品
利福平胶囊,规格:0.3g,批号:1708031、1708032和1708033,某药厂生产。
1.2 仪器
JJ1000型分析天平(江苏常熟双杰测试仪器厂);DK-98-IIA型电热恒温水浴锅(天津泰斯特仪器有限公司);HFSAFE-1500型生物安全柜(上海力申科学仪器有限公司);SHB-ⅢA型循环水式多用真空泵(郑州长城科工贸有限公司);GN-6 Metricel Grid滤膜及滤器(Pall corporation);KB240型培养箱(Binder公司);SX-700高压灭菌器[Tomy. Kogyo.(日本)]。
1.3 菌种
枯草芽孢杆菌[CMCC(B)63501]、金黄色葡萄球菌[CMCC(B)26003]、铜绿假单胞菌[CMCC(B)10 104]、大肠埃希菌[CMCC(B)44 102 ]、白念珠菌[CMCC(F)98001]、黑曲霉[CMCC(F)98003]均由中国食品药品检定研究院提供。
1.4 试剂
吐温80(国药集团化学试剂有限公司,批号20151105);十四烷酸异丙酯(国药集团化学试剂有限公司,批号:20121122);氯化钠(国药集团化学试剂有限公司,批号:10019318)。
1.5 培养基
胰酪大豆胨液体培养基(TSA)(广东环凯微生物科技有限公司,批号:1063865);胰酪大豆胨琼脂培养基(美国Merck公司,批号:VM740758622);沙氏葡萄糖液体培养基(SDB)(美国Merck公司,批号:VM682839518);沙氏葡萄糖琼脂培养基(SDA)(广东环凯微生物科技有限公司,批号:3304005);pH7.0氯化钠-蛋白胨缓冲液(北京陆桥技术股份有限公司,批号:151010);麦康凯液体培养基(广东环凯微生物科技有限公司,批号:1064485);麦康凯琼脂培养基(广东环凯微生物科技有限公司,批号:3302132),均为成品培养基,使用前均进行培养基适用性检查,均符合规定。
2 方法与结果
2.1 菌液的制备
取金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、白念珠菌的新鲜培养物适量,用0.9%无菌氯化钠溶液制成含菌数约为103~104CFU/mL,备用。取经培养7d的黑曲霉斜面培养物,加5mL含0.05%(mL/mL)吐温80的0.9%无菌氯化钠溶液洗下霉菌孢子,作为原液;取霉菌孢子悬液倍量稀释至霉菌数约为103~104CFU/mL,备用。取大肠埃希菌的新鲜培养物适量,用0.9%无菌氯化钠溶液制成含菌数约为10~102CFU/mL,备用。
2.2 供试液制备
2.2.1 油性供试液的制备
取供试品10g,无菌操作开启胶囊壳,倾出内容物置无菌锥形瓶中,胶囊壳置无菌乳钵中。取2mL pH7.0氯化钠-蛋白胨缓冲液注入无菌乳钵中,置于44℃水浴上研磨,使胶囊壳软化至泥状,将软化的胶囊壳投入装有利福平内容物的无菌锥形瓶中,加灭菌十四烷酸异丙酯至100mL,继续在44℃水浴上保温并振摇,使成均一混悬液,作为油性供试液。
2.2.2 水性供试液的制备
取“2.2.1”项下油性供试液50mL(相当于利福平胶囊5g),置于500mL无菌输液瓶中加pH7.0氯化钠-蛋白胨缓冲液100mL,密封,充分振摇1min,倒置、分层,用无菌注射器取水层,置于无菌锥形瓶中,取上清液,作为1:20供试液。取1:20供试液5mL,加pH7.0氯化钠-蛋白胨缓冲液45mL,作为1:200供试液。
2.3 微生物计数法适用性试验
2.3.1 需氧菌总数计数方法
(1)稀释法:取1:20供试液9.9mL 5份,分别加入5种试验菌0.1mL(含菌量约104CFU/mL),混匀。立即分别取1mL注入平皿,倾注TSA培养基。按平皿倾注法测定其菌落数。同法测定供试品对照组及菌液对照组菌数。(2)稀释法结合薄膜过滤法:用适量冲洗液将无菌滤膜湿润。取1:200供试液1mL,经薄膜过滤,用保温至44℃的含0.1%吐温80的pH7.0氯化钠-蛋白胨缓冲液1000mL冲洗滤膜滤器,每次冲洗量为100mL,在最后一次冲洗液中加入小于100CFU试验菌(铜绿假单胞菌、金黄色葡萄球菌和枯草芽孢杆菌),每个试验菌各制备1张滤膜,菌面朝上贴于TSA平板上。同法测定供试品对照组及菌液对照组菌数。
2.3.2 霉菌和酵母菌总数计数方法(稀释法)
取1:20供试液9.9mL 2份,分别加入白念珠菌和黑曲霉0.1mL(含菌量约104CFU/mL),混匀。立即分别取1mL注入平皿,倾注SDA培养基。按平皿倾注法测定其菌落数。同法测定供试品对照组及菌液对照组菌数。
2.3.3 回收比值测定
试验组:分别按上述菌落计数方法进行试验组菌落的计数。菌液对照组:以稀释剂替代供试品溶液,按照试验组的菌落计数方法试验。供试液对照组:按菌落计数方法,不加试验菌,测定供试品本底菌数。中和剂对照组:取相应量稀释液替代供试品同试验组操作。回收比值计算:中和剂组回收比值为中和剂对照组菌落数与菌液对照组菌落数的比值,试验组回收比值为试验组菌落数减去供试品对照组菌落数与菌液对照组菌落数的比值。
2.4 控制菌(大肠埃希菌)检查方法验证试验
用适量冲洗液将无菌滤膜湿润,取1:20供试液20mL,加pH7.0氯化钠-蛋白胨缓冲液至50mL,经薄膜过滤,用pH7.0氯化钠-蛋白胨缓冲液500mL,冲洗滤膜滤器,每次冲洗量为100mL,在最后一次冲洗液中加入小于100CFU大肠埃希菌,将滤膜投入至TSB培养基100mL中,依相应大肠埃希菌的控制菌检查法在规定温度和时间下培养,进行检查。
2.5 阴性对照试验
以上计数方法及控制菌检查方法,在不加供试品和试验菌的情况下,以稀释剂替代供试品按相应微生物计数方法和控制菌检查法进行检测。
2.6 结果
2.6.1 稀释法(1:20)
结合平皿倾注法的微生物计数方法验证试验结果,按稀释法(1:20)结合平皿倾注法的方法验证试验结果见表1。结果表明:经3次独立平行试验,铜绿假单胞菌、金黄色葡萄球菌和枯草芽孢杆菌的菌回收比值均低于0.5,白念珠菌和黑曲霉的菌回收比值均高于0.5。稀释法(1:20)结合平皿倾注法可用于霉菌和酵母菌总数测定,不适用于本品的需氧菌总数测定。
2.6.2 稀释法(1:200)
结合薄膜过滤法微生物计数方法验证试验结果,测定结果见表2。结果表明:经3次独立平行试验,铜绿假单胞菌、金黄色葡萄球菌和枯草芽孢杆菌菌回收比值高于0.5,该方法可用于本品的需氧菌总数测定。
2.6.3 控制菌方法验证试验结果
控制菌按薄膜过滤法检查的验证试验结果见表3。结果表明:采用薄膜过滤法进行大肠埃希菌检验,阳性对照菌均检出,所有阴性对照试验均无菌生长。
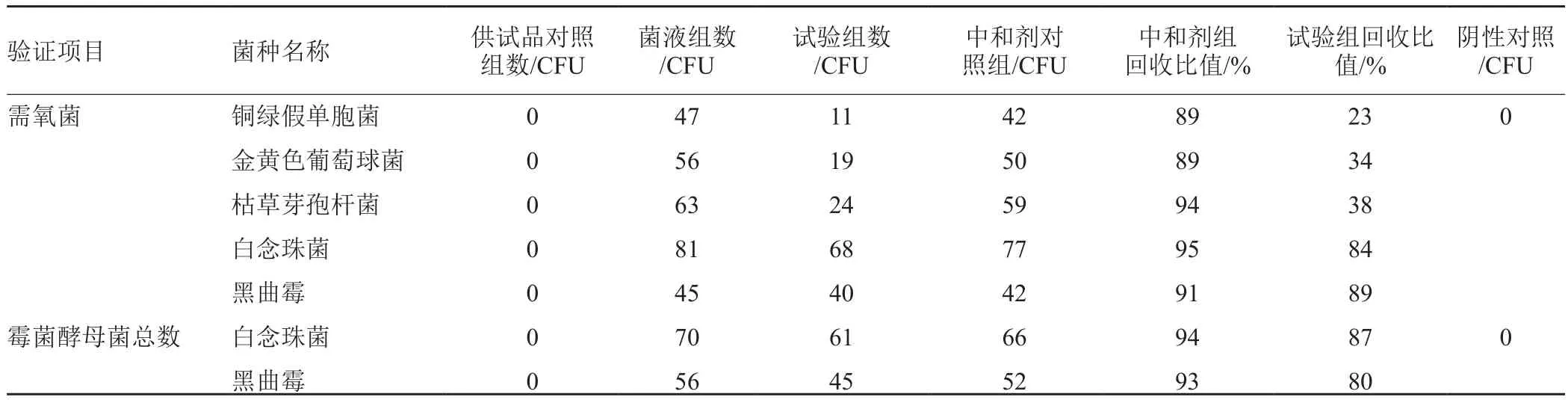
表1 稀释法(1:20)结合平皿倾注法的计数及回收比值测定结果(n=3)Tab. 1 The counting and recovery of dilution method combined with routine method (n=3)

表3 控制菌按薄膜过滤法检查的方法验证试验结果(n=3)Tab. 3 Verification test results of control bacteria by membrane filtration method (n=3)
2.7 供试品微生物限度检查及控制菌检查
采用上述确定的检查方法对3批样品进行微生物限度检查和控制菌检查,结果需氧菌总数小于200CFU/g,霉菌和酵母菌总数小于200CFU/g,均未检出大肠埃希菌,符合2015年版中国药典口服制剂的微生物限度标准,具体结果表4。
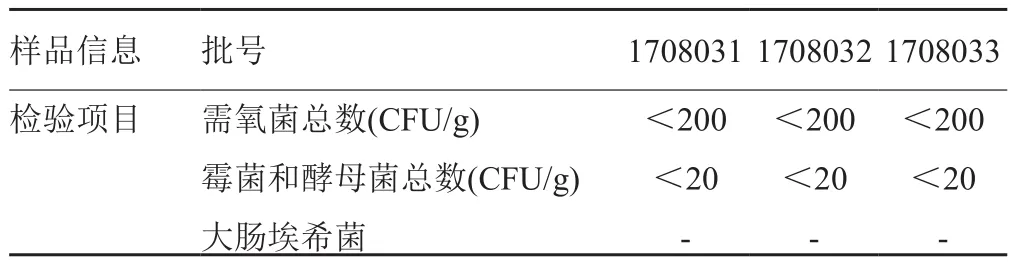
表4 3批样品的微生物限度检查结果Tab. 4 Results of microbial limit test of three batches of samples
3 讨论
(1)供试液的制备方法:利福平胶囊抑菌活性很强,直接接种法、培养基稀释法、用pH7.0氯化钠-蛋白胨缓冲液溶解的1:1000供试液进行薄膜过滤法都不能去除其抑菌性,细菌的回收比值均无法达到要求。本文改善了供试品的处理方法,冲洗液冲洗体积也做了调整,采用十四烷酸异丙酯分散成混悬液,再用pH7.0氯化钠-蛋白缓冲液萃取后,采用稀释法结合薄膜过滤法可解决这个问题。
(2)冲洗量的确定:通过反复试验发现,利福平对细菌抑制活性最强,对真菌和酵母菌抑制活性较弱,因此需氧菌计数的冲洗量采用1000mL,真菌和酵母菌采用常规法计数,控制菌大肠埃希菌冲洗量为500mL,即能达到实验要求。
(3)冲洗液的温度和吐温80的含量:利福平为脂溶性抗生素,薄膜过滤时易吸附残留于滤膜上,冲洗不干净,即使浓度低,也抑制部分阳性试验菌的生长。因此本文采用的是含0.1%聚山梨酯80的pH7.0无菌氯化钠-蛋白胨缓冲液作为冲洗液,冲洗液用44℃水浴保温,可增加冲洗液和供试液的滤过性。
