米尔贝霉素A3和A4高产菌的理性选育
2019-03-13滕云徐美冬朱进伟郑玲辉应雪肖白骅
滕云 徐美冬 朱进伟 郑玲辉, 应雪肖 白骅,
(1 浙江省抗真菌药物重点实验室,浙江海正药业股份有限公司,台州 318000;2 浙江海正药业(杭州)股份有限公司,杭州 311404)
米尔贝霉素(milbemycin)于1967年由日本Sankyo公司的青木(Aoki)等[1]从吸水链霉菌S. hygroscopicussubsp.aureolacrimosus的发酵液中发现,其结构属十六元大环内酯类化合物。米尔贝霉素是微生物天然产物农药,已有数据表明它是当今世界上最优良的杀螨剂之一。美国环保署认定其为低危险性杀虫剂,荷兰批准其为“GNO”(作物生产中的天然产物)。它属生态友好型农药,适用于有机农业病虫害的综合防治,在发达国家已成为一种受欢迎的杀虫杀螨剂[2-3]。1983年,米尔贝霉素(milbemycin)A3和A4组分的混合物(A3:A4=3:7,如图1所示)被批准上市。现在,1%的米尔贝霉素乳油已经在多个国家用于果蔬、家庭观赏植物虫害的防治[4]。
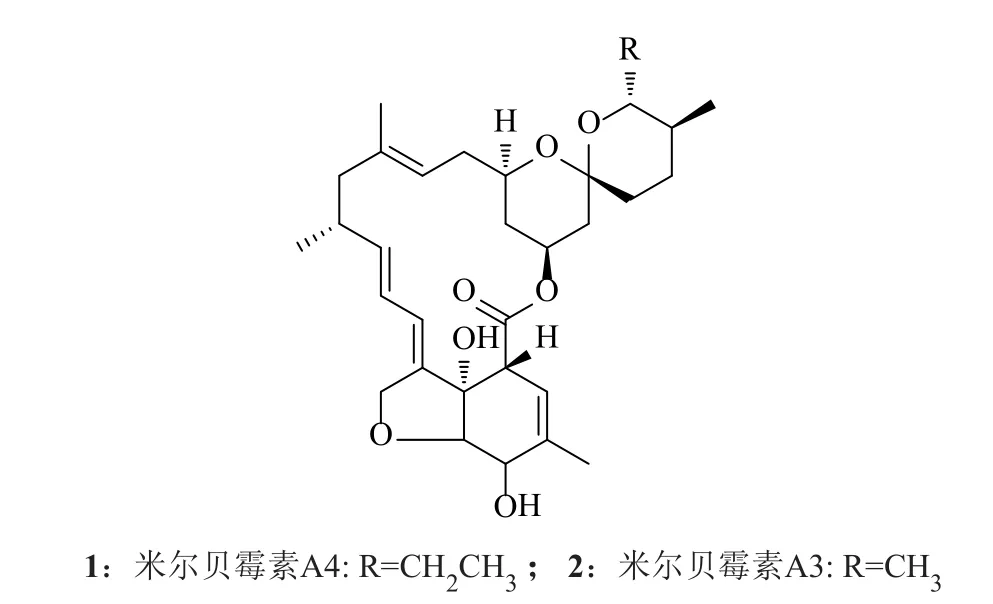
图1 米尔贝霉素化学结构式Fig. 1 Structure of milbemycin
由于最终产品对A3/A4的比例(3:7)有着严格的要求。米尔贝霉素的生产技术一直被日本三共和美国默克等企业所控制,而一般的菌种很难满足这一比例,需要通过提取工艺优化来解决比例问题,从而导致提取收率偏低,生产成本过高。米尔贝霉素A3/A4在结构上非常相似,在药效和稳定性上A3优于A4还是A4优于A3目前并没有文献报道,但从已有文献上看,米尔贝霉素A3/A4在代谢过程中的确存在一定的差异[5-6]。如果能够实现A3,A4单一组分的生产,且进一步提高发酵单位,降低成本,则可以避开多组分产品的市场限制,推动该类产品在国内的使用。
本研究根据米尔贝霉素生物合成途径的特点[7-8],设计了不同的筛选策略,结合各种物理化学诱变方法,分别筛选得到A3比例大于70%,A4比例大于80%的生产菌种。通过培养条件的进一步优化,A3单一组分菌种发酵单位超过2000mg/L,A4单一组分菌种发酵单位超过3000mg/L,远高于文献报导的1200-1400mg/L的单位[9-10],可为米尔贝霉素的产业化提供优良的菌株。
1 仪器与材料
LC-20A型高效液相色谱仪(日本Shimadzu公司);ARTP-II型常压室温等离子体(ARTP)微生物诱变系统(北京思清源生物科技有限公司);50L发酵罐(上海国强生化工程装备有限公司)。1和2对照品(按文献方法制备并标定[11],纯度98%):甲醇、乙腈为分析纯,水为去离子水。
S. milbemycinicusCGMCC7677由本公司实验室保藏。菌种经过本实验室自然分离筛选,初始1的摇瓶发酵效价为789mg/L,2的效价为267mg/L。
斜面/平板孢子培养基(g/L):酵母抽提物2,麦芽抽提物2,蔗糖10,脱脂奶粉1.2,琼脂20,消前pH7.0~7.2。
种子培养基(g/L):酵母抽提物5,蛋白胨5,蔗糖20,脱脂奶粉3,磷酸氢二钾0.8,消前pH6.8~7.2,摇瓶装液量为250mL,三角瓶装30mL。
发酵培养基[10](g/L):蔗糖120,黄豆饼粉20,酵母抽提粉5,肉胨5,K2HPO40.5,MgSO4·7H2O 0.5,FeSO4·7H2O 0.05,CaCO33; pH7.0~7.2。
2 方法
2.1 培养条件
将CGMCC7677菌株接种到斜面/平板孢子培养基上,28℃培养12d。在已生长完好的试管斜面中加入含有0.01%吐温80的无菌水洗下,然后转移至加有玻璃珠的三角摇瓶中,振荡器上振荡20min。移取所得菌悬液1.5mL,转接到装液量为20mL的250mL种子瓶中,28℃条件下培养3d;然后以10%的接种量接种于装液量为25mL的250mL摇瓶中,28℃,250r/min培养10d。
2.2 HPLC分析方法
取发酵液0.5mL,加入4.5mL 75%乙醇,混合均匀,3000r/min、离心15min,取上层液用HPLC法测定。
色谱条件:色谱柱Zorbex RX-C8柱(150mm×4.6mm,5μm);流动相条件见参考文文献[10]。
检测波长,240nm,柱温30℃,进样量10μL。根据标准品浓度计算发酵液中1和2的含量。
2.3 诱变与处理方法
NTG(亚硝基胍)诱变处理:称取NTG晶体10mg,溶解在10mL无菌Tris缓冲液(pH8.0)中,再加入1mL菌悬液,置于28℃培养基中旋转式或往复式摇床上振荡处理30min。将处理过的菌悬液经适当稀释涂布于斜面/平板孢子培养基平板上。未作诱变处理的菌悬液亦经适当稀释涂布于斜面/平板孢子培养基平板作为对照。28℃培养10d后,检查菌落数,并计算致死率。
UV(紫外)诱变处理:取10-1或10-2梯度的单细胞菌悬液5~10mL到带一根回形针的平板内(直径9cm),置于UV诱箱内,置磁力搅拌器上,开盖于UV15W,30cm处照射数分钟(一般2~5min),边照边搅拌,照后用黑布包好,然后用生理盐水(0.9%氯化钠溶液)稀释10-2~10-7,分别涂斜面/平板孢子培养基平板得诱变组。EMS(甲基磺酸乙酯)诱变处理:吸取1mL EMS溶于2mL无水乙醇中,再加入22mL,pH7.2的0.1mol/L磷酸缓冲液,配制成4.0%EMS溶液。取10-1或10-2梯度的单细胞菌悬液5mL到带一根回形针的平板内,加入4.0%EMS溶液5mL,最后EMS溶液浓度为2.0%。置磁力搅拌器上,搅拌处理20~60min。诱变平皿内加入10mL 5%的硫代硫酸钠即可中止反应,用生理盐水依次稀释10-2~10-7,涂斜面/平板孢子培养基平板得诱变组。
ARTP(常压室温等离子体)诱变:发生气(氦气)流量12.5L/min;发射口与盛样品铁片间距离2mm;照射功率100W,照射时间0、5、10、20、30、60和90s。照射完毕后将菌悬液连同铁片置于液体培养基中,振荡数秒后吸取适量液体培养基,涂斜面/平板孢子培养基平板。培养温度28℃,培养周期12d。
3 结果与讨论
3.1 米尔贝霉素主组分菌株的理性选育
传统的的菌种选育是采用各种“2.3”项中的诱变手段进行单个或者复合诱变,通过自然分离后获得突变株,这种方法有非常大的随机性。为了提高选育效率,研究者往往会在筛选过程中增加一个筛子,以筛选期望获得的菌株。单一组分的菌种筛选也是如此,比如夏焕章等[12]在筛选妥布霉素单组份生产菌种的过程中利用妥布霉素和安普霉素的不同微生物抗性设计了双层平板,最终筛选出了妥布霉素单组分菌种。
本研究根据米尔贝霉素的生物合成途径以及1和2的不同合成途径,设计了多个筛选的模型,分别是甘氨酸抗性、3-溴丙酮酸抗性、乙酸钠抗性、rifampicin抗性,筛选途径见图2。
米尔贝霉素的生物合成是丙酸基、乙基以及其他一些结构基团通过聚酮合酶(polyketidesynthase,PKS)途径合成而来[2]。因此,采用利福平抗性平板筛选得到的菌株发酵单位提高了30%,乙酸钠抗性筛选也有较好的结果。在各种物理化学诱变方式中,ARTP是一种较新的诱变处理方式,在各种微生物选育上都取得了不错的效果[13-15]。本研究过程中发现,米尔贝霉素的生产菌所产生的孢子对ARTP具有一定的耐受性,需要辐照2min以上才能达到90%以上的致死率。同时还发现,在其他物理化学诱变方法效果不显著时,ARTP诱变处理会获得意想不到的效果。本研究仅仅经过一轮ARTP诱变就获得了发酵单位提高15%的菌种。通过各种诱变手段和筛选方法的组合,虽然没有获得A3,A4组分差异特别显著的菌株,但进行到54-30号菌种后,发酵单位已经较出发菌提高了近3倍,达到了3000mg/L。当对54-30号菌株进行紫外诱变,并采用3-溴丙酮酸作为抗性筛选后,在平板上发现了两种形态有较大差别的菌落,见图3。
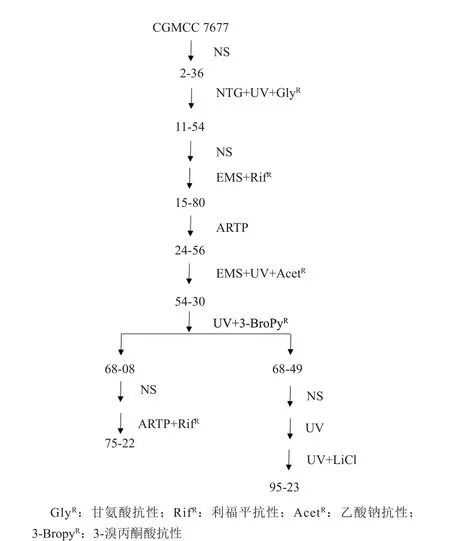
图2 米尔贝霉素生产菌CGMCC7677选育谱系图Fig. 2 Mutation process for the Milbemycin producing strain CGMCC7677
从图3中可以发现,诱变的菌种与出发菌相比在形态上已经发生了较大的变化,突变株在菌落表面基本上不分泌色素。通过3-溴丙酮酸抗性筛选得到的两种不同形态的菌落,从菌落正面观察,两株菌在菌落中心的形态上稍有差异,但在菌落背面上有较大的差异。一种菌落背面有明显的色素产生(通常情况下),一种菌落则基本上不产色素。将两种菌落在摇瓶上进行发酵实验,结果显示产色素的菌落1:2的比例大于4:1,也就是1的含量超过了80%。不产色素的菌落1:2的比例小于3:7,也就是2的含量超过了70%。3-溴丙酮酸是一种可用于治疗肿瘤的药物,其主要作用是影响细胞的葡萄糖代谢途径[16-17]。通常情况下采用该物质作为抗性筛选底物的目的是为了筛选得到葡萄糖代谢途径发生变化的菌株。通过该抗性能够筛选得到2含量的菌种最大的可能是突变株的糖代谢途径发生改变后也影响到了次级代谢途径的变化,进而获得了2可以大量积累的突变株。在接下来的筛选中发现,2高产的突变株性状非常的不稳定,很容易产生回复突变,回复突变株基本上没有发酵单位。

图3 选育过程中形成的两种形态突变株Fig. 3 Morphology mutant during the strain selection
对两种形态突变的菌株,进一步进行诱变筛选,经多轮分离纯化后,最终得到了两株高产菌75-22和95-23。其中75-22菌株在摇瓶中1的单位达到了3500mg/L以上,1的含量达80%以上,见图4;95-23菌种在摇瓶中2的单位达到了3000mg/L,2的含量达70%以上,见图5。
3.2 高产菌株发酵工艺研究
使用突变菌株75-22和95-23在原有发酵培养基和培养条件下进行50L罐的发酵培养,考察突变株的生长代谢情况和合成1和2的能力。

图4 75-22菌株摇瓶发酵检测结果(12d)Fig. 4 HPLC graph for the strain 75-22 in shake-flask (12d)

图5 95-23菌株摇瓶发酵检测结果(12d)Fig. 5 HPLC graph for the strain 95-23 in shake-flask (12d)
突变株75-22在50L发酵罐的生长代谢曲线见图6。与原始菌相同,突变株仍然选择蔗糖作为碳源,12%的蔗糖会在发酵的96h内被完全水解为葡糖糖和果糖,然后再被细胞所利用。糖的消耗速度显示,果糖的消耗速度要快于葡萄糖。1和2的生物合成与糖代谢有着密切的联系,本研究曾经尝试用葡萄糖和果糖的组合来代替蔗糖,结果发现产物的合成受到严重的影响。结合蔗糖水解曲线和1、2的合成曲线,可以发现当蔗糖被完全水解后,产物开始快速合成。这一现象表明,蔗糖及其相关酶系在米尔贝霉素的生物合成过程中起到了很重要的作用,值得进一步研究。
整个发酵过程维持通气量1000L/h,通过改变搅拌速度控制溶氧大于30%。本发酵过程对氧气的需求并不是特别高,在蔗糖水解速度最快的初始阶段搅拌维持在相对较高的水平,溶氧也快速下降。此后搅拌一直维持在较稳定的水平,细胞进入次级代谢,对氧的需求量降低。米尔贝霉素的合成在整个发酵过程中都比较平稳,只是在300h后,随着葡萄糖和蔗糖的耗尽,合成速率有所下降。360h后由于碳源耗尽,pH回升,1的发酵效价达到3900mg/L,比例达到80%以上。

图6 突变株75-22在50L发酵罐中的代谢曲线Fig. 6 Fermentation curve for the mutant strain 75-22 in 50L fermentor
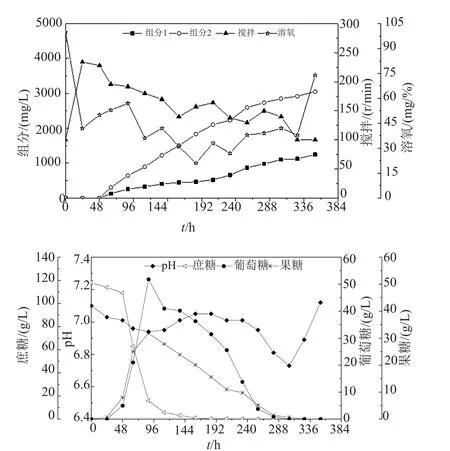
图7 突变株95-23在50L发酵罐中的代谢曲线Fig. 7 Fermentation curve for the mutant strain 95-23 in 50L fermentor
突变株95-23在50L发酵罐的生长代谢曲线见图7。与75-22相比,95-23菌株在50L发酵罐上的生长速度较慢,这与选育过程中的现象一致。由于生长速度偏慢,对蔗糖的水解速度也稍偏慢,但葡萄糖代谢和果糖代谢速度要快于75-22。该菌种对溶氧的要求也不高,在1000L/h的空气流量下,搅拌转速没有超过250r/min。48h后搅拌转速即开始下降,细胞进入次级代谢,米尔贝霉素开始合成,290h后碳源耗尽,pH回升,最终2的发酵效价达到2900mg/L,比例达到70%以上。
3.3 结论与展望
通过对出发菌种CGMCC7677进行多轮和多种诱变方式的处理,结合各种抗性筛选:甘氨酸抗性,利福平抗性,乙酸钠抗性等,1和2的发酵单位得到了显著提高。在添加3-溴丙酮酸作为抗性的筛选平板上,得到了两种形态完全不同的突变株,经过进一步分离纯化,分别得到突变株75-22和95-23。摇瓶和发酵罐的代谢数据表明,75-22发酵产1的能力提高4倍,1和2之间的比例也由3:7提高至小于2:8;95-23发酵产2的能力则提高了近10倍,1和2之间的比例有3:7变化为大于7:3。这两株突变株的获得,为米尔贝霉素单一组分的生产和开发提供了可能,发酵单位的提高,超出了转向产业化的要求。但由于1和2的结构非常相似,若要获得单一的1和2的产品,还需要下游提取工艺牺牲一定的收率。今后可进一步对现有菌种进行选育,或者通过培养基和培养条件的优化,继续提高1和2在发酵液中的含量比例,形成更有利于工业化生产成本控制的目的。
