细菌脂蛋白生物合成调控研究进展
2019-03-13贾雨晴夏杰张文轩闻刚冯波连旭薛文杰吴松
贾雨晴 夏杰 张文轩 闻刚 冯波 连旭 薛文杰 吴松
(中国医学科学院,北京协和医学院药物研究所,活性物质发现与适药化研究北京市重点实验室,北京 100050)
细菌脂蛋白是一种脂质修饰的膜蛋白,是革兰阴性菌外膜和革兰阳性菌细胞被膜的重要组成成分[1]。脂蛋白在细菌的重要生理过程中如细胞膜的合成,营养摄取,细胞壁代谢,细胞分裂,跨膜信号转导,孢子形成,抗生素耐药性,物质转运(如ABC转运系统)以及蛋白质的胞质外折叠[2]发挥关键作用,对细菌的生存至关重要。对于病原菌来说,脂蛋白既是细菌在复杂环境中生存的基础,也常常是其致病不可或缺的毒力因子,直接参与病原菌的多种致病机制,如细菌定殖、入侵、逃避宿主防御和影响宿主免疫系统等[3-5]。脂蛋白基因普遍分布在细菌中,占细菌总基因组的1%~3%[6]。尽管细菌脂蛋白具有不同的来源、结构和功能,但均具有Leu-(Ala/Ser)-(Gly/Ala)-Cys组成的称为“lipobox”的共识序列[7]。脂蛋白以前体形式在细胞质中合成,通过Sec或Tat分泌系统首先被转运到细胞内膜的外表面上,然后进行脂蛋白的生物合成[8-9]。脂蛋白的经典生物合成途径包括以下步骤(图1):首先,二酰甘油基转移酶(Lgt)识别原前脂蛋白保守序列中的半胱氨酸Cys,将磷脂酰甘油醇(PG)的二酰甘油基转移至半胱氨酸的巯基上,形成二酰甘油基修饰的前脂蛋白。然后,脂蛋白信号肽酶Ⅱ(LspA)切除二酰甘油基-前脂蛋白的信号肽形成脂蛋白。最后,脂蛋白N-酰基转移酶(Lnt)催化磷脂酰乙醇胺(PE)的酰基链转移到半胱氨酸的N末端,产生一个成熟的三酰化脂蛋白[10]。其中Lgt和LspA存在于所有革兰阴性和革兰阳性细菌中,而Lnt仅存在于革兰阴性菌和高GC(鸟嘌呤、胞嘧啶)含量的革兰阳性菌中。在低GC含量的革兰阳性菌中,脂蛋白多以二酰甘油基脂蛋白的形式存在,但仍有一些细菌中存在非经典生物合成途径,如枯草杆菌和金黄色葡萄球菌中,脂蛋白以三酰化脂蛋白形式存在[11-12]。正确的脂蛋白修饰以及该过程中所涉及到的酶对革兰阴性菌和一些高GC含量的革兰阳性菌的活力至关重要。了解这些酶的催化机制,结构和功能有助于发现针对这一重要途径的新型抗生素。因此,本文中主要介绍了这3种酶的生物学功能和晶体结构。
1 前脂蛋白二酰甘油基转移酶Lgt
Lgt催化脂蛋白产生路径的第一步反应,能够识别前脂蛋白“lipobox”的共识序列[LVI]-3[ASTVI][GAS]C+1,从而将来自磷脂酰甘油醇(PG)的二酰甘油基转移至lipobox序列中半胱氨酸残基的巯基上[13],形成二酰甘油基修饰的前脂蛋白。Lgt位于细胞内膜中,是由lgt基因编码形成的含有291个氨基酸(33kDa)的膜蛋白[14],其最适反应温度为37℃,最适反应pH为7.8[15]。大多数细菌含有一个单一的lgt基因,只有少数细菌有两个或两个以上的lgt同源基因[16]。Lgt对底物的识别具有特异性[17],带负电荷的磷脂酰甘油醇(PG)是最有效的二酰甘油基供体;另外两种带负电荷的磷脂酸(PA)和磷脂酰丝氨酸(PS)可作为低效的供体;中性磷脂,磷脂酰乙醇胺(PE),磷脂酰胆碱(PC)和二酰甘油基(DAG不能作为Lgt的底物)。最近对保守氨基酸残基的分析,表明了Lgt特征序列的存在,并且该序列中的两个氨基酸残基(Asn146和Gly154)对于Lgt的功能是必不可少的[18]。另外,氨基酸残基His103-Gly108以及Tyr26和Tyr235对于Lgt的功能也很重要[19]。Lgt功能的缺失,会导致革兰阴性菌死亡,可能是由外膜脂蛋白的基本特性决定的[20],如Yfio外膜蛋白是大肠埃希菌存活的必要组分。Lgt对于所有革兰阳性细菌的体外生长是非必要的,可能是某些前体脂蛋白具有与必需脂蛋白相同的功能[21-22],例如PrsA脂蛋白是枯草芽孢杆菌中的必需蛋白质,但该生物体的lgt突变体仍然能够存活。但是Lgt功能的缺失会导致革兰阳性菌活力和致病能力的下降,例如枯草芽孢杆菌lgt突变体在细胞色素caa3活性[23],蛋白质分泌[22],孢子形成[24]中表现出可与特定脂蛋白功能受损相关的缺陷。因此,Lgt是研发新一代广谱型抗生素的潜在靶标。2016年,Zhang课题组[10]解析出大肠埃希菌Lgt的蛋白结构(图2),并确定了具有催化作用的氨基酸残基。Lgt由7个跨膜螺旋(TM)组成,其N末端朝向细胞周质,C末端朝向细胞质,构成了蛋白结构的主体,此外,还有6个β-片层和4个α短螺旋。在跨膜螺旋TM4和TM5之间,4个扭曲的β片层(β1、β2、β4和β6)和2个α短螺旋(α3和α4)形成1个具有球形形状的周质头部结构域。此外,Lgt有两条两亲性臂,一条是由跨膜螺旋TM1的N-末端β片层(β2和β3)形成的“臂-1”,一条位于TM2和TM3之间,由α1和η2(20个氨基酸残基组成的短链)形成的“臂2”。跨膜螺旋TM2、TM3和“臂2”形成了一个小的跨膜结构域,其余的跨膜螺旋则形成了主要的跨膜结构域。对于Lgt功能很重要的氨基酸残基His103-Gly108位于跨膜螺旋TM3的N-末端。在两个跨膜结构域之间有一个中心腔,该腔内有两个底物结合位点,第一个结合位点是Glu151,第二个结合位点是Arg143,该腔的底部(细胞质侧)是完全疏水的,而上部(细胞周质侧)由更多极性氨基酸残基组成,与底物PG的分布取向一致。此外该中心腔有两个(正面和侧面)裂隙作为底物PG的潜在入口和释放离去基团的周质出口。具有催化活性的氨基酸残基Arg143和Arg239也位于该中心腔中,其对二酰甘油基的转移至关重要。前脂蛋白的巯基可能对磷脂酰甘油醇的羰基进行亲核进攻,其中Lgt提供催化残基Arg143以支持二酰甘油基转移到前体蛋白上,并将两个底物靠近在一起,而Arg239通过与二酰甘油基(DAG)形成氢键,协同Arg143发挥作用。

图1 脂蛋白产生途径[10]Fig. 1 The canonical biosynthetic pathway of bacterial lipoproteins[10]
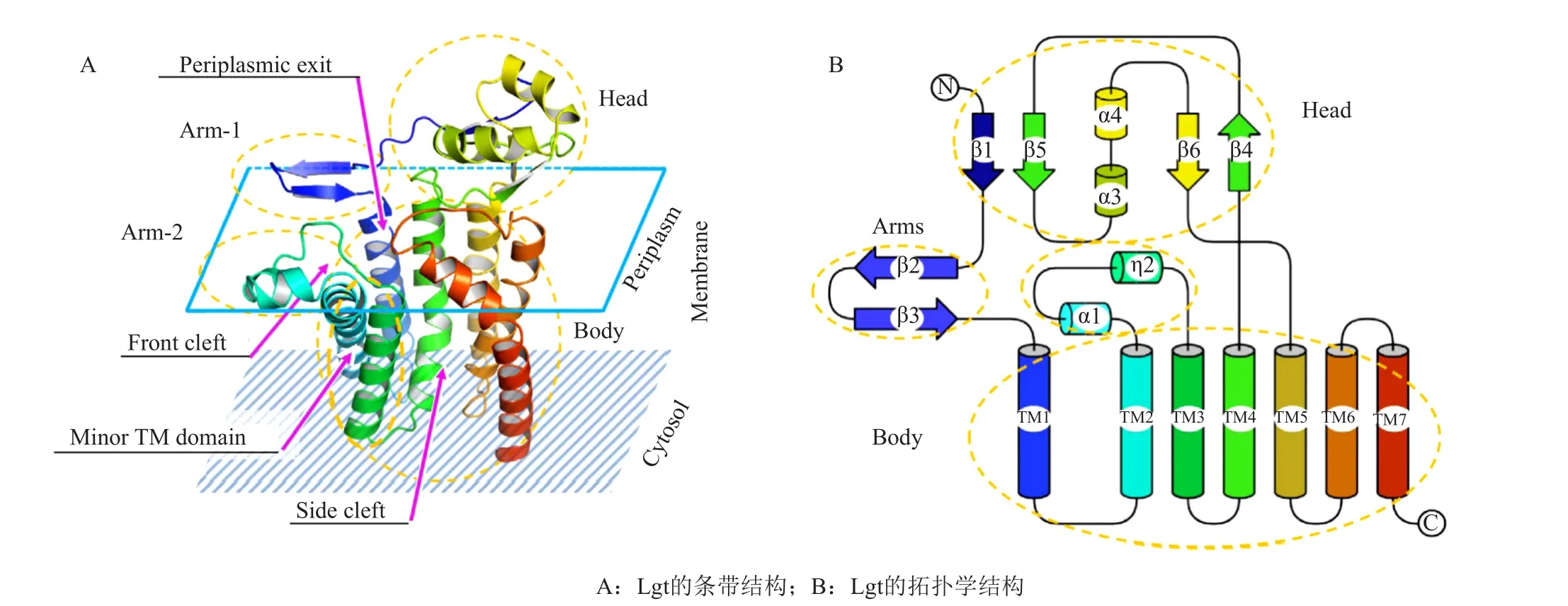
图2 大肠埃希菌Lgt晶体结构[10]Fig. 2 Crystalstructure of E. coil Lgt[10]
2 脂蛋白信号肽酶II LspA
LspA作用于脂蛋白产生途径的第二步,通过切除前脂蛋白上半胱氨酸N末端的信号肽,形成脂蛋白。LspA是由169个氨基酸组成的蛋白质,普遍存在于细菌中,位于细胞质膜上,其反应适宜温度37~45℃,最适反应pH7.8[14]。尽管其缺少天冬氨酰蛋白酶的氨基酸共有序列Asp-Thr-Gly[25],但是LspA被初步确定为天冬氨酰肽链内切酶。在革兰阴性菌中,LspA严格切除脂质修饰的半胱氨酸残基N-末端的信号肽,而一些革兰阳性菌的LspA可能对底物具有较低的特异性或不同的识别模式,如链球菌的LspA已被证明可以切割原前脂蛋白中未经修饰的半胱氨酸残基N末端的信号肽[26-27]。LspA是革兰阴性菌中必需的酶。在革兰阳性菌中,LspA是非必需的,可能是因为LspA突变菌株中前体脂蛋白的积聚导致其他肽酶的替代处理[28],例如最近在粪肠球菌中发现了Eep肽酶,其参与了前体脂蛋白信号肽的切割过程。但LspA功能的缺失会导致革兰阳性菌致病能力的减弱[29],例如,金黄色葡萄球菌LspA突变菌株毒力减弱。大部分细菌有一个单一lspA基因,只有少数细菌拥有两个同源性的lspA基因,并且LspA与已知结构的蛋白质没有序列同源性,在人体中无同源类似物,使其成为潜在药物靶点[30-33]。2016年,Caffery课题组[34]解析出铜绿假单胞菌LspA-Globomycin(格罗泊霉素)共晶结构,并确定了其催化位点。LspA由两个结构域组成(图3a),第一个结构域由4个跨膜螺旋(MH1-4)组成,其N末端和C末端均在细胞质中。第二个是细胞周质结构域,它由两个亚结构域所组成,其中较大的一个亚结构域是一个由4条肽链组成,两亲性的β-片层,位于细胞内膜上。第二个亚结构域由周质螺旋(PH)组成,也位于细胞内膜上,其长轴正交于β-片层。LspA-Globomycin共晶结构显示,格罗泊霉素通过氢键以及疏水作用牢固的镶嵌在LspA中,作用在跨膜螺旋MH1、MH2和MH3之间电子云密度独特的环形区域,格罗泊霉素的Leu、Ile和Ser的主链羰基和LspA严格保守的氨基酸残基Asn112和Arg116的侧链形成氢键,而Leu的侧链,羟基脂肪酸的乙酰基链与LspA非极性氨基酸残基具有疏水相互作用。此外,格罗泊霉素Ser上的β-OH与LspA氨基酸残基Asp143的羰基形成了最为显著的氢键,Asp143是LspA催化二联体中其中一个氨基酸残基,另外一个是Asp124(图3b)。LspA催化前体脂蛋白N-末端信号肽裂解的机制为:LspA的N端与二酰甘油基脂蛋白结合,起催化作用的天冬氨酸残基Asp143、Asp124与水分子形成氢键来保持它所在的位置。当遇到二酰甘油基脂蛋白时,Asp143协助水分子进行亲核进攻,Asp124则是活化二酰甘油基脂蛋白肽键的羰基碳,形成四面体中间体。羰基碳上酰胺键的断裂重排,导致前体脂蛋白N末端信号肽的断裂。另外,对来自485个与铜绿假单胞菌的LspA具有35%~95%序列同源性的生物体进行LspA氨基酸序列的推导,分析鉴定出LspA有14个严格保守的氨基酸残基(Asp23、Lys27、Asn54、Gly56、Gly108、Ala109、Asn112、Arg116、Val122、Asp124、Phe139、Asn140、Ala142和Asp143)。
2.1 LspA抑制剂
2.1.1 格罗泊霉素(Globomycin)
1978年,格罗泊霉素(1)(图4)首次被鉴定为由不同链霉菌菌株产生的对大肠埃希菌具有抑制活性的抗生素[35]。它是一个两亲性的19元环状缩肽,由L-Ser和L-allo-Thr构成了极性的一半,而羟基脂肪酸,L-Leu和L-Ile构成了非极性的一半。动力学研究表明,格罗泊霉素以非竞争性抑制方式抑制LspA,其与二酰甘油基-前体脂蛋白的结合常数Ki为36nmol/L,米氏方程常数Km为6μmol/L[36]。其对LspA的EC50为2μg/mL[37]。格罗泊霉素对变形菌属具有更好的抑制活性(但是对铜绿假单胞菌无活性),对厚壁菌属的抗菌活性较差[38-39]。对格罗泊霉素类似物的构效关系研究表明,随着羟基脂肪酸烷基侧链的延长,对革兰阴性菌的抗菌活性也会随之增强,可能是因为较长的侧链可以增强其与LspA跨膜螺旋 MH2非极性表面的疏水相互作用。并且随着烷基侧链延长,其对一些革兰阳性菌(链球菌,金黄色葡萄球菌,肠球菌)表现出一定的抑制活性。L-Ser的羟基对于格罗泊霉素发挥抑制作用是必不可少的[39],可能是其与关键氨基酸Asp143形成了氢键相互作用,阻断了LspA的催化活性位点。
2.1.2 Myxovirescin(TA)
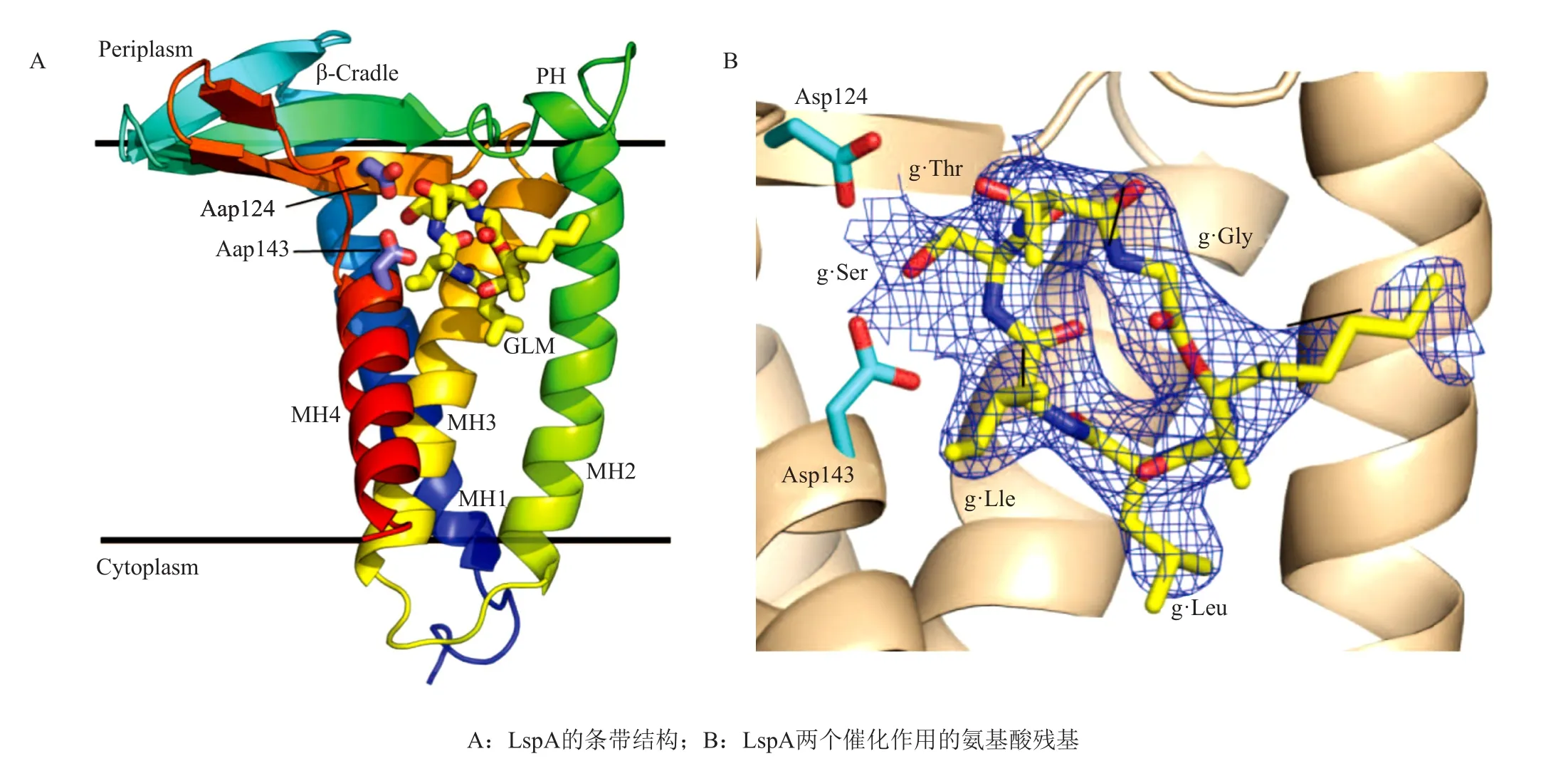
图3 LspA-Globomycin共晶结构[34]Fig. 3 LspA-globomycin complex structure[34]
抗生素TA(myxovirescin)(2)(图4)是由黏细菌产生的次生代谢产物,具有28元大环内酰胺内酯结构,是一种快速杀菌剂,具有广谱抗菌活性。TA已被证明可以靶向LspA发挥抑制作用[37],对LspA的EC50为0.25μg/mL。TA对大肠埃希菌YX127的最低抑菌浓度为0.25μg/mL,而格罗泊霉素对大肠埃希菌YX127的最低抑菌浓度为2μg/mL,TA比格罗泊霉素显示出更好的LspA抑制活性及抗菌活性。由于TA对真菌,原生动物,真核细胞,啮齿动物甚至人类没有毒性,其抗菌活性是特异性的[40]。但是TA具有代谢不稳定性,可将TA作为LspA抑制剂的先导物进行结构优化。
2.1.3 苯甲酰胺类化合物
2017年,Seiya等[41]报道了苯甲酰胺类化合物以非竞争性方式抑制LspA的活性,初始苗头化合物3a(图4)是通过高通量筛选得到的,该化合物包含苯甲酰胺基和噻二唑结构,对LspA的IC50为4.2μmol/L。通过对该化合物苯环上的甲氧基,噻二唑杂环,以及杂环上所连接的脂肪链进行结构修饰,得到了对LspA具有更强抑制作用的化合物3b,该化合物的IC50为99nmol/L。可能是由于革兰阴性菌的外膜渗透性限制了该化合物的有效性,化合物3b必须在细胞外膜穿透剂多黏菌素衍生物PMBN存在下,才能抑制大肠埃希菌的生长。在PMBN存在下,其对大肠埃希菌的最低抑菌浓度(minimal inhibitory concentration, MIC)为11μg/mL。此外,格罗泊霉素在PMBN存在下,对大肠埃希菌的抗菌活性增强了100倍。外膜渗透性是革兰阴性抗生素药物发现中的重要障碍,同时说明了体外LspA抑制作用和体内抗菌作用的差异。因此,LspA抑制剂和细胞外膜穿透剂或更多临床相关的黏菌素或多黏菌素B的组合疗法可能是增强LspA抑制剂体内和临床有效性的方法。
3 脂蛋白N-酰基转移酶Lnt
Lnt是作用于脂蛋白产生过程中的最后一个酶,催化磷脂酰乙醇胺(PE)的sn-1-酰基链转移到脂蛋白半胱氨酸游离的α-氨基上,最终形成成熟的三酰化脂蛋白[42-43],成熟的脂蛋白停留在内膜或被特定的脂蛋白转运系统转运到细胞外膜上,通过N端脂基团锚定在膜上发挥其正常功能。在革兰阴性菌中,脂蛋白正确的细胞定位是其发挥正常生理功能的基础,这依赖于细胞内脂蛋白转运系统的正常运转,Lnt对脂蛋白从细胞质膜释放和通过脂蛋白转运系统转运到外膜是必不可少的。Lnt的缺失,会导致细胞质膜中脂蛋白的积累,这对革兰阴性菌来说是致命的[44]。1991年,Gupta等[44]证实了大肠埃希菌Lnt位于细胞质膜上,并且确定了其最适反应pH(pH6.5~7.5)。2007年,Vidal-Vidal-Ingigliardi等[45]鉴定了Lnt的几个主要的氨基酸残基,它们主要位于起催化作用的周质结构区域,包括催化三联体Glu267-Lys335-Cys387。该催化三联体参与了两步反应:在第一步反应中,Glu267充当反应过程的碱基,离去氢原子,活化Cys387,增强其亲核性,进攻磷脂sn-1脂肪酸链上的羰基,形成硫酯-中间体;在第二步反应中,酰基转移产生成熟的三酰化脂蛋白,而Lys335用以稳定在N-酰化反应两个步骤中形成的四面体中间体的含氧阴离子[46-47]。动力学研究显示Lnt遵循乒乓(ping-pong)机制,由此在第一个反应中产生的溶血磷脂副产物,在第二个底物脂蛋白结合和修饰之前释放[47]。Lnt对磷脂底物有选择性,具有sn-1饱和脂肪酸链(棕榈酸酯或油酸酯)和sn-2不饱和脂肪酸链的磷脂酰乙醇胺是其最有效的供体[47]。2009年,Tschumi等[48-49]首次报道了Lnt在高GC含量放线菌属中的活性,耻垢分枝杆菌和结核分枝杆菌的Lnt直系同源物具有N-酰基转移酶活性,出乎意料地是,耻垢分枝杆菌脂蛋白的N-酰化脂肪酸种类和脂肪酸在磷脂中的位置分布表明[50],其Lnt的底物应该来自PE的sn-2位置。这种特异性不同于大肠埃希菌Lnt底物来自PE的sn-1位置[51],而对大肠埃希菌Lnt功能必需的氨基酸残基Try237和Lys388,在耻垢分枝杆菌的Lnt中不存在[52],这些氨基酸残基被证明参与第二步的反应,载脂蛋白的N-酰基化,表明它们可能在底物特异性中起作用[53]。在所有的链霉菌属中,含有两种lnt基因(lnt1和lnt2),在疥疮菌属中,lnt1基因对于Lnt的N-酰化转移功能至关重要,而lnt2基因对Lnt的功能不太重要,在lnt2基因不存在下,仍能产生成熟的三酰化脂蛋白[54]。综上,Lnt对于革兰阴性菌和一些高GC含量放线菌属的存活十分重要。因此,Lnt可作为广谱抗生素的潜在靶标。2017年,Sharookn课题组[55]解析出野生型大肠埃希菌Lnt蛋白结构(图5),其由八条跨膜螺旋组成,N末端和C末端均位于细胞质中。TM3在氨基酸残基Gly71中含有明显的扭结,侧链间的相互作用导致TM4和TM5具有相似的跨膜角度,TM4和TM5在内膜的外小叶附近稍微张开以形成通向Lnt周质结构域的沟槽。除了一个短的两亲性螺旋(Lys161-Gly168)在TM6之前靠在膜周质侧,这些跨膜螺旋之间的大环(W141-V169)主要嵌入膜中。这些螺旋和介于它们之间的环形成一个小的亲水性腔体。在跨膜螺旋TM7和8之间,具有一个大的特征性的α-β-β-α夹心折叠的周质碳-氮水解酶结构域,它由一个大的水解酶家族组成,包括腈基水解酶,酰胺水解酶,N-酰基转移酶。其催化三联体Glu267-Lys335-Cys387位于该水解酶区域。

图4 LspA抑制剂(1、2、3a和3b)的结构Fig. 4 Structures of LspA inhibitors (1, 2, 3a and 3b)
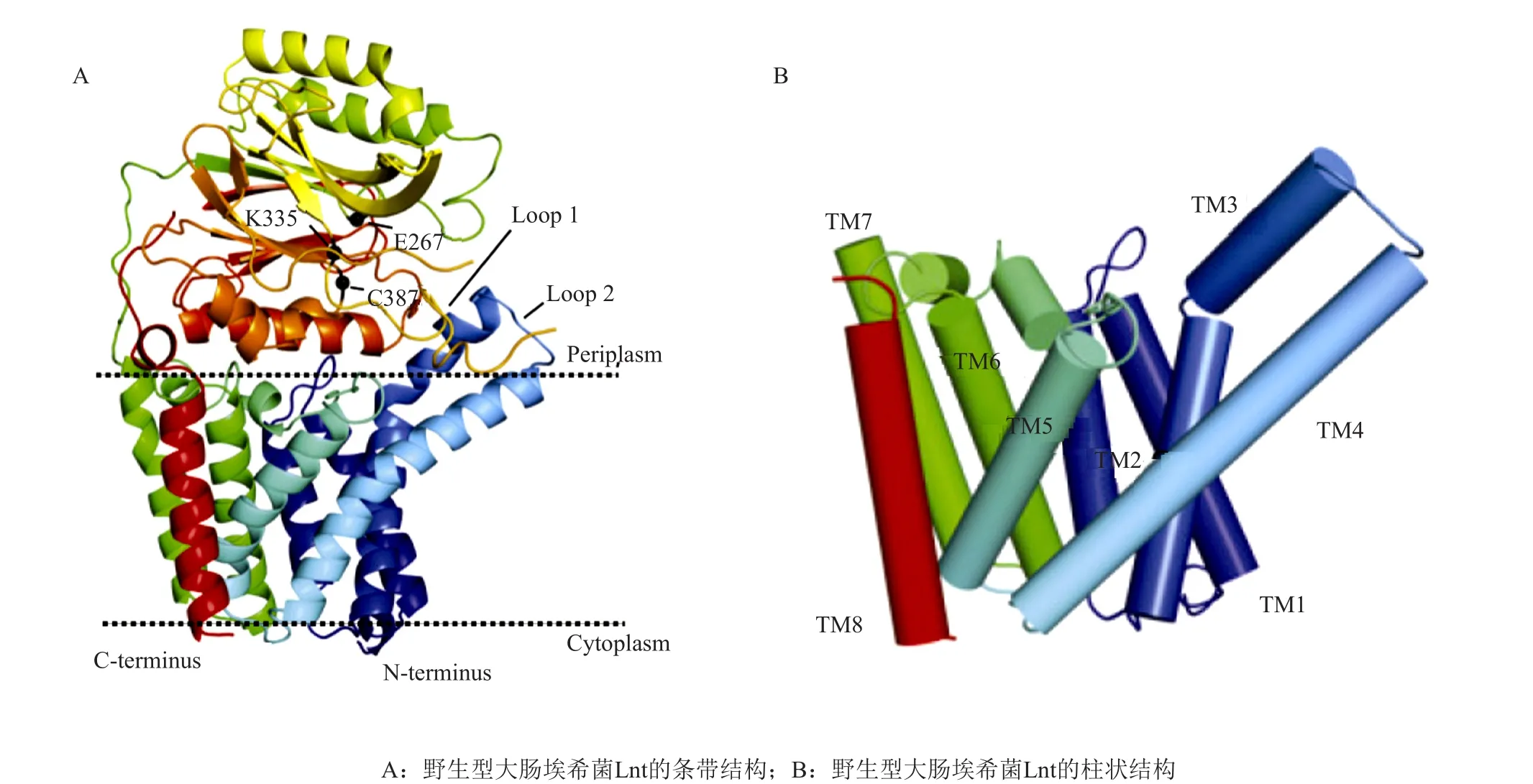
图5 野生型大肠埃希菌Lnt晶体结构[55]Fig. 5 Crystalstructure of wild-type Lnt[55]
4 结论与展望
随着抗菌药物的广泛应用,细菌对抗生素产生了耐药性,因此研发新作用机制的抗生素有望克服细菌耐药性问题。脂蛋白生物合成途径的Lgt和LspA,Lnt酶是原核生物特有的,干扰该合成途径将影响大量脂蛋白的合成,因此脂蛋白的生物合成途径所涉及的3种酶可以作为抗生素发展的潜在靶标。目前的临床耐药机制对作用于新靶标的抗生素可能不存在交叉耐药性。此外,Lgt、LspA和Lnt这3种酶都是跨膜蛋白,这种结构可以使得一些小分子与它们结合,抑制它们的活性而不需要穿过难以渗透的细胞质膜,从而提高抗菌有效性。目前这3种酶的蛋白质晶体结构均已被解析出来,从而可以开展基于结构的药物设计,加快抗耐药菌药物先导结构的发现。但是,目前针对脂蛋白的生物合成路径所涉及的3种酶抑制剂,少有文献报道。已报道的LspA抑制剂仍处于临床前研究,其具体作用机理仍需进一步探究。
