脂多糖缺失所致多黏菌素耐药的鲍曼不动杆菌研究进展
2019-03-13卞星晨刘笑芬张菁陈代杰
卞星晨 刘笑芬 张菁,* 陈代杰
(1 上海师范大学 生命与环境科学学院,上海 200234;2 复旦大学附属华山医院 抗生素研究所,上海 200040;3 上海交通大学药学院,上海 200240)
鲍曼不动杆菌是全球院内感染的重要致病菌[1-2],可引起医院获得性肺炎、血流感染、尿路感染和伤口感染等各种感染性疾病[3]。随着抗生素的大量和不恰当的使用,鲍曼不动杆菌对抗生素耐药的情况日渐突出,在一些国家,对常用药物如碳青霉烯的耐药率已高达70%[4]。因缺乏新的有效的治疗药物,临床上开始使用“古老的”抗生素多黏菌素B和黏菌素(多黏菌素E)治疗广泛耐药鲍曼不动杆菌所致的各种感染[5]。然而,多黏菌素使用出现的耐药性问题在欧洲、亚洲、美洲、非洲多个国家均有报道[6-9]。已报道的鲍曼不动杆菌耐药机制主要有由脂多糖(lipopolysaccharide,LPS)缺失以及LPS修饰所致[10]。本文将简要综述脂多糖缺失所致多黏菌素耐药鲍曼不动杆菌的有关研究进展。
多黏菌素有A、B、C、D和E共5种。目前只有多黏菌素B和E被批准上市。多黏菌素为带正电的阳离子、含三肽侧链的环状七肽,环肽与侧链通过α氨基相连接[11](图1为多黏菌素B和E的结构[12-13])。
多黏菌素对革兰阴性菌具有强大的抗菌活性,其主要作用于革兰阴性菌的细胞膜而发挥抗菌作用。革兰阴性菌的外膜由脂多糖LPS层和磷脂层组成,带正电的多黏菌素与LPS层中脂质A上带负电的磷酸基团发生静电吸引,与磷酸酯键相互结合,置换了膜上具有桥连稳定作用的二价阳离子,如钙离子和镁离子,然后多黏菌素疏水基团N端脂肪酸部分插入其中,细胞膜稳定性遭破坏,细胞内成分丢失,细菌死亡[14-15]。
革兰阴性菌的外膜是非对称双分子层;LPS为外层,包含成分有脂质A、核心多糖和O-特异侧链;磷脂层为内层,其间镶嵌有多种脂蛋白、孔蛋白、外膜蛋白[16]。脂质A以β-1',6相连的氨基两个葡萄糖为骨架,2,3,2',3'位置被(R)3-羟十四酸残基酰化,与非还原糖连接的脂肪酸又在羟基上进一步酰化,产生酰基羧酸的结构。另外,二糖结构末端1和4'位被磷酸化,带负电(图2)[17]。
1 LPS缺失鲍曼不动杆菌对多黏菌素的耐药机制
鲍曼不动杆菌脂多糖的结构修饰,是报道较多的一种对多黏菌素的耐药机制。该耐药机制主要是由于pmrB基因发生点突变,pmrAB基因表达水平上调,磷酸乙醇胺(PEtN)转移相关基因pmrC高表达。PEtN对脂质A的N-乙酰葡糖胺的4'位进行修饰,使外膜负电荷降低,与黏菌素亲和力降低而产生耐药[17-19]。另外,脂质A的糖苷化(己糖胺)也是造成细菌对多黏菌素产生耐药性的重要机制之一,可使多黏菌素对其MIC达到1.5~48μg/mL[18]。在多黏菌素耐药鲍曼不动杆菌耐药菌中还有较多的庚酰化的脂质A。这些以脂质A修饰造成的耐药机制,与其他一些肠杆菌科细菌对多黏菌素产生耐药的机制相同。
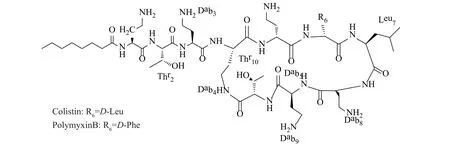
图1 多黏菌素B和多黏菌素E的结构Fig. 1 The structure of polymyxin B and colistin
脂多糖完全缺失的鲍曼不动杆菌,首先由Moffatt等[11]在含有高浓度黏菌素(10μg/mL)的固体培养基中被发现,经测定其细胞膜表面的脂多糖缺失,且脂质A的合成基因lpxACD发生核苷酸突变或缺失。通过质粒pAL840导入完整的lpxA基因,可使其对黏菌素敏感性恢复。此耐药机制在鲍曼不动杆菌ATCC19606以及临床菌株中均有发现。但脂质A仅是黏菌素作用的初级靶点,因而即使缺失脂质A,药物仍然具有一定的抗菌活性。
LPS对于许多革兰阴性菌的生长至关重要,多数细菌失去LPS后无法生存[20],而鲍曼不动杆菌在失去LPS后仍能生存并获得对多黏菌素的耐药性。失去LPS的鲍曼不动杆菌在适应性、表达谱、与宿主相互作用等很多方面都发生了变化。
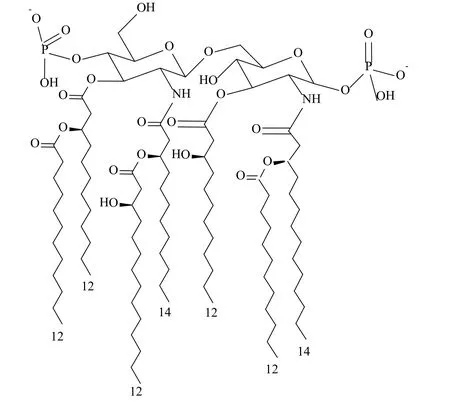
图2 不动杆菌脂质A结构Fig. 2 The structure of lipid A of Acinetobacter baumannii
为进一步研究LPS缺失引起的基因表达的改变,Henry等[16]使用高通量RNA测序比较耐药株19606R和敏感株ATCC19606的转录组差异。结果显示,耐药菌中有229个基因表达改变,其中123个表达上调,106个表达下调。在123个上调基因中,超过9%的基因与编码外膜蛋白与外膜合成相关蛋白有关,包括Mla逆行磷脂转运系统的相关基因mlaBCD表达增加5.3~7.5倍,Lol脂质转运系统中的编号基因lolA、lolB、lolD和lolE在耐药株中表达增加4.9~27.9倍,PNAG(polyβ-1,6-N-acetylglucosamin,聚β-1,6-N-乙酰葡萄糖胺)的合成与转运相关的pgaABCD在耐药株中表达增加14.9~48.5倍。该结果表明耐药株弥补LPS的缺失主要通过3个转运系统进行调控,即Mla逆行磷脂转运系统,Lol脂质转运系统,PNAG生物合成和转运系统。此外,耐药株的外排泵系统比敏感株更为活跃,可以排出细胞内毒性物质。这一系列变化使缺乏LPS的外膜仍能维持其功能,以保证细菌存活与生长。
一个有趣的现象是,这种LPS缺失的革兰阴性菌对阿奇霉素、利福平、万古霉素等抗生素敏感性提高,分析推测的原因可能是:原存在于外膜上的LPS分子之间有很强的横向相互作用,因而对于胞外物质具有较强的选择性透过作用。而当LPS缺失后,这种横向相互作用下降,致使选择透过作用下降。这一改变提示这些抗生素或许可以成为针对LPS缺失耐药株的潜在的治疗选择[11,21]。
2 LPS缺失鲍曼不动杆菌的表面结构变化
耐药鲍曼不动杆菌在高浓度多黏菌素(32mg/L)以及无多黏菌素时都能保持完整,有明显的细胞聚集,也会聚集成链或集落。电镜观察发现即使缺失了LPS,耐药株仍有外膜存在[11]。另外,LPS缺失鲍曼不动杆菌的形态也会发生变化:在对数生长期,敏感菌呈棒状,耐药菌株偏圆形;平台稳定期敏感菌在无抗生素条件下发生细胞延长,呈细长状,耐药菌株也略微延长,呈短棒状[22-23]。
在进行研究中检测细菌表面电荷量十分必要,因为鲍曼不动杆菌对多肽类抗生素如多黏菌素的敏感性与细菌表面电荷有着密切的关系[14]。细菌表面电荷量可用Zeta电位表示。
Soon等[14]分别在多黏菌素B或黏菌素(1、4和8mg/L)存在下对细菌电位进行测定。结果显示,在8mg/L多黏菌素B或黏菌素存在下鲍曼不动杆菌敏感菌株与耐药菌株的Zeta电位均显著上升,且数值高于1与4mg/L条件下的上升值。表明多黏菌素的存在对细菌表面负电荷有中和作用,且药物浓度越高,中和作用越强,Zeta电位也就越高。在耐药菌株中,外膜负电荷均比敏感菌株有所减少,对多黏菌素的中和作用减弱。尽管中和耐药菌和敏感菌负电荷所需多黏菌素差别不大,但耐药株比敏感株的耐药性高100倍以上。
同时Soon等[23]运用原子力显微技术研究敏感菌株与LPS缺失耐药菌株表面性能的差异,多黏菌素暴露量与生长阶段对表面性能产生不同的影响。结果表明,在每个生长阶段,敏感菌株比耐药菌株表面更加坚硬,机械强度更大,可能是敏感菌中的二价阳离子的桥连作用以及脂质A链饱和烃之间的横向作用形成了坚硬的外膜[24]。荧光探针实验证明基因回补株可以产LPS,但表面机械强度小于敏感菌株,可能暗示回补菌株的LPS含量少于敏感菌株。对于敏感菌株,用低浓度多黏菌素(1mg/L)处理使其机械强度降低,因多黏菌素与细菌特异性结合使外膜变得不稳定;而高浓度多黏菌素(32mg/L)处理使其机械强度增加,因多黏菌素与LPS特异性结合位点已饱和,非特异性结合被放大,多黏菌素在外膜上积聚引起机械强度增加。对于耐药菌株,多黏菌素均以非特异性方式与LPS结合,因此高低浓度均能增加其机械强度[23]。
另外,在生长速率方面,多黏菌素耐药鲍曼不动杆菌与敏感菌在MH琼脂(MHA)平板上的生长速率相近,但耐药株的菌落形态变小[11]。Mu等[25]的研究结果显示,LPS缺失耐药株的生长速度减慢。
3 LPS缺失的鲍曼不动杆菌对宿主的影响
3.1 对细胞毒力的影响
LPS中的脂质A是革兰阴性菌致病物质内毒素的物质基础,因此LPS的存在与否影响细胞毒力[26]。
分别用敏感菌株和LPS缺失耐药突变菌株感染小鼠模型,根据小鼠存活率及半数致死量LD50等指标判断细菌毒力。在ATCC19606的菌落数为1×107、4×107、12×107以及40×107CFU/mL时,小鼠死亡率分别为0、0、80%和100%。在耐药菌株菌落数为3×107,12×107,25×107,40×107以及80×107CFU/mL时,小鼠死亡率分别为0、0、0、20%和60%。半数致死量分别为10×107和63.5×107CFU/mL。由此可见,LPS缺失使细菌毒力大大降低[27-28]。
3.2 对固有免疫系统的影响
当细菌入侵宿主,宿主会首先启动固有免疫系统抵御细菌的入侵。单核巨噬细胞表面的CD14分子和Toll样受体识别细菌,与细菌表面的LPS结合,激活NF-κB信号通路,能够改变基因的表达,通路激活后可引起机体发生炎症反应[29],比如巨噬细胞分泌肿瘤坏死因子(TNF),主要是TNF-α,发挥抗感染的作用。
MyD88是Toll样受体信号通路中重要的转导蛋白,TLR2与TLR4通过转导蛋白MyD88与Mal作用传递信号。研究者分别选取了TLR2缺失、TLR4缺失及MyD88/Mal缺失小鼠的巨噬细胞,用加热灭活的LPS缺失耐药菌株19606R与标准菌株ATCC19606对其进行刺激,检测TNF-α产生的量,研究固有免疫在敏感和耐药菌株中如何产生TNF-α。研究发现,缺乏MyD88/Mal时未见明显的TNF-α产生,证明与MyD88/Mal的信号转导有关。在TLR-4缺失的巨噬细胞中,LPS缺失耐药株能刺激更多的TNF-α分泌,在TLR2缺失细胞,结果相反。表明LPS缺失鲍曼不动杆菌在一定程度上通过TLR-2信号通路刺激TNF-α的分泌,但分泌水平低于敏感菌,故不会导致由TNF-α过度分泌导致的感染性休克[30]。
比较LPS缺失耐药菌株与敏感菌株引起的固有免疫的差异发现,LPS缺失使得NF-κB信号通路的激活减弱,TNF-α的分泌也有所减少,因此宿主对细菌的固有免疫应答减少。
LL-37是存在于人血清中的阳离子抗菌肽,由中性粒细胞和上皮细胞产生,可直接杀灭大量病原菌菌落,在固有免疫的调控中起重要作用。LL-37与黏菌素的抗菌作用机制有相似之处,最初都是因为静电吸引[31]。与多黏菌素不同的是,LL-37对LPS缺失耐药株有杀菌作用,且耐药株比敏感株对LL-37的敏感度更高,说明其杀菌作用不依赖于LPS,可能与膜渗透性下降有关[32]。有研究证实LL-37对许多革兰阴性菌、病毒和真菌也有杀菌作用,也证明其不依赖于LPS发挥作用[31]。
另外,存在于黏膜分泌物中的溶菌酶也对细菌有杀灭作用,其作用靶部位是肽聚糖,LPS缺失后,细菌内壁层的肽聚糖暴露,溶菌酶更易接近靶部位,水解肽聚糖,故LPS缺失耐药菌株对溶菌酶的敏感性更高,使其更易被清除[33]。
4 小结
多黏菌素耐药性的日趋严重将使得临床上治疗鲍曼不动杆菌感染面临无药可用的困境。LPS缺失所致耐药可引起细菌适应性下降,外膜合成相关基因表达增加,对其他抗生素敏感性提高,机械强度降低,细菌毒力下降,固有免疫因子水平变化等。
以脂多糖缺失所致多黏菌素耐药的鲍曼不动杆菌一系列性质的改变为出发点,进一步深入研究鲍曼不动杆菌对多黏菌素耐药机制,寻找新的有效的抗菌作用靶点或者抗菌物质,或许会获得意想不到的结果。
