下调Girdin基因表达对肺癌细胞增殖凋亡、免疫因子IL-8和TNF-α及顺铂化疗敏感性的研究①
2019-03-11李春双侯金兰张连莲李世龙
李春双 黄 娟 侯金兰 郭 红 张 蕾 白 洁 张 钊 张连莲 李世龙
(唐山市工人医院呼吸内科,唐山063500)
肺癌是在临床上常见的恶性肿瘤之一,具有较高的发病率和死亡率,近年来,我国肺癌的发病率呈上升趋势,给人民的生命及健康造成极大的威胁[1-3]。肿瘤的形成和恶性转化是一个与癌基因的激活、抑癌基因的失活等的多步骤、多基因、多阶段的过程,肺癌中已发现多个分子靶向治疗位点,但仍需寻找更多的位点[4,5]。微丝附着梁蛋白(Girders of actin filaments,Girdin)是细胞内一个重要的大分子蛋白,是2005年首次被发现的一种新的AKT下游底物,在其C端1416位具有丝氨酸磷酸化作用位点,可特异性地与AKT的C端结合协同促进其磷酸化和激酶活性[6]。以往研究显示,Girdin可影响细胞极性、神经母细胞迁移、肌动蛋白重建、血管生成、细胞自噬等,近些年的研究发现,在乳腺癌、肺癌、结直肠癌等多种肿瘤中有高表达,且多与肿瘤的预后不良有关[7-9]。恶性胶质瘤中Girdin高表达患者预后差[10];肝癌细胞中抑制Girdin表达可明显降低癌细胞的增殖及侵袭能力[11,12]。Girdin对肺癌的研究较少,有研究发现,肺癌中Girdin的高表达与转移和侵袭有关,可能是判断患者预后有价值的靶点[13,14]。顺铂是肿瘤治疗中联合化疗常用的一个药物,对肺癌的治疗起到辅助作用[15,16]。目前关于Girdin对肺癌生物学特性的影响及是否可增加肺癌的化疗敏感性还尚不清楚。本研究通过RNAi沉默肺癌细胞Girdin表达,旨在研究Girdin对细胞增殖、凋亡、免疫因子及化疗敏感性的影响,并研究是否能够通过调控PI3K/AKT信号通路起作用。
1 材料与方法
1.1材料
1.1.1试剂和仪器 顺铂购江苏豪森药业股份有限公司;胎牛血清、RPMI1640培养基均购自美国Gibco;LipofectamineTM2000购自美国Invitrogen公司;膜联蛋白V-FITC(Annexin V-FITC)/碘化丙啶(PI)细胞凋亡试剂盒、二喹啉甲酸(Bicinchoninic acid,BCA)试剂盒均购自碧云天生物技术研究所;荧光定量试剂盒及反转录试剂盒购自日本Takala;兔抗人Girdin多克隆抗体、兔抗人细胞增殖核抗原(Proliferating cell nuclear antigen,PCNA)多克隆抗体、兔抗人含半胱氨酸的天冬氨酸蛋白水解酶3(Cysteinyl aspartate specific proteinase 3,Caspase-3)多克隆抗体、兔抗人Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)多克隆抗体、兔抗人磷脂酰肌醇-3激酶(Phosphatidylinositol 3-kinase,PI3K)多克隆抗体、兔抗人磷酸化的丝氨酸苏氨酸激酶(Phosphorylated Serine/threonine kinase,p-AKT)多克隆抗体均购自美国Cell signal公司;酶标仪购自美国Bio-Rad公司;流式细胞仪购自美国BD公司。
1.1.2细胞及其培养 人胚肺成纤维细胞MRC5及肺癌A549、PC9、SPC-A-1、H322、H1299细胞均购自中国科学院上海细胞库;细胞在含有10%胎牛血清的PRMI1640培养基中,置于37℃、5%CO2饱和湿度条件下培养。实验为生长至对数期的细胞。
1.2方法
1.2.1Girdin在肺癌细胞的表达 RT-PCR简要步骤如下:细胞总RNA提取及反转录总RNA为cDNA参照总RNA提取试剂盒及反转录试剂盒说明,以cDNA为模板上实时荧光定量PCR仪进行扩增,反应体系为20 μl,PCR反应条件为:95℃预变性3 min,之后95℃、10 s,58 ℃退火30 min,共35个循环,每孔设置3个复孔。Girdin的引物序列为F:5′-GACCAACTAGAGGGAACTCG-3′,R:5′-TACTTTGTTTCTGTGCCATT-3′。内参GAPDH 的引物为F:5′-GTCACCAGGGCTGCTTTTAACTC-3′,R:5′-CAGCATCGCCCCACTTGATTTTG-3′。采用2-ΔΔCt比较法根据Ct均值对Girdin的mRNA相对含量进行定量。
Western blot简要步骤如下:细胞中加入适量的裂解液,裂解完全后离心,取上清,BCA法测定蛋白浓度,蛋白液与上样缓冲液充分混匀,100 ℃变性10 min,每泳道加入40 μg样品行SDS-PAGE分离,转膜、封闭后4℃孵育一抗过夜,Girdin和内参GAPDH抗体均按照1∶1 000稀释,洗膜,加入按照1∶2 000 稀释二抗(HRP标记的羊抗兔),室温孵育1 h,洗膜,化学发光法在紫外凝胶成像仪上进行拍照分析。Girdin的相对表达通过Girdin的灰度值除以GAPDH的灰度值计算。
1.2.2实验分组及siRNA转染SPC-A-1细胞 SPC-A-1细胞分为空白对照组(只加入脂质体)、阴性对照组(NC组,转染合成的无干扰作用的siRNA)、Girdin-siRNA(转染合成的特异性的干扰Girdin表达的siRNA)组、顺铂组(2.5 mg/L顺铂干预)和Girdin-siRNA+顺铂组,转染参照脂质体LipofectamineTM2000转染说明。通过RT-PCR及Western blot检测Girdin的siRNA转染SPC-A-1细胞效果。各组细胞培养48 h,收集细胞用于后续的实验研究。
1.2.3细胞增殖检测 收集处理48 h的各组细胞,每孔细胞中加入MTT溶液(5 mg/ml)20 μl,培养箱内继续孵育细胞4 h,吸去孔内的培养液,在每个细胞孔中加入二甲基亚砜(DMSO)150 μl,10 min后,用空白对照孔调零,酶标仪在570 nm波长测定各孔的吸光度值(OD值),以此反映细胞活力,间接反映出细胞的增殖情况。实验重复3次。
1.2.4细胞凋亡检测 通过Annexin V-FITC/PI双染法检测处理48 h的各组细胞的凋亡情况。实验过程按照试剂盒的操作进行。实验重复3次。
1.2.5细胞中免疫因子检测 通过RT-PCR检测细胞中IL-8和TNF-α的表达,方法参照1.2.1。
1.2.6增殖凋亡蛋白及PI3K/AKT信号通路蛋白表达检测 增殖相关蛋白PCNA、凋亡相关蛋白Caspase-3、Bax及PI3K/AKT信号通路PI3K和p-AKT的蛋白表达参照1.2.1方法检测。

2 结果
2.1Girdin在肺癌细胞表达 以人胚肺成纤维细胞MRC5作为对照细胞,通过RT-PCR检测Girdin在肺癌细胞的mRNA表达,Western blot检测Girdin的蛋白表达,结果如图1和表1所示,五个肺癌细胞中Girdin的mRNA及蛋白表达均明显高于在MRC5细胞表达,差异均具有统计学意义(P<0.05)。
2.2Girdin-siRNA转染SPC-A-1细胞检测结果 Girdin-siRNA转染SPC-A-1细胞48 h,Western blot检测各组细胞中Girdin的蛋白表达,结果如图2和表2所示,Girdin-siRNA组Girdin的蛋白表达显著低于空白对照组(P<0.05),而阴性对照组Girdin的蛋白表达与空白对照组差异无统计学意义(P>0.05)。

图1 Western blot检测Girdin在肺癌细胞中的蛋白表达Fig.1 Expression of Girdin protein in lung cancer were detected by Western blot
2.3Girdin对SPC-A-1细胞增殖的影响 通过MTT法检测各组细胞的吸光度值(OD值),以此反映细胞活力,间接反映出细胞的增殖情况,结果如表3所示,Girdin-siRNA组和顺铂组均能减低肺癌细胞OD值,与空白对照组差异均具有统计学意义(P<0.05),两者联合对细胞OD值影响优于Girdin-siRNA组和顺铂组(P<0.05)。
表1Girdin在肺癌细胞中的mRNA及蛋白相对表达量
Tab.1mRNAandproteinexpressionofGirdininlungcancercells

CellsGirdin mRNAGirdin proteinMRC510.051±0.008H3222.883±0.5621)0.247±0.0321)PC93.432±0.6111)0.383±0.0451)H12992.955±0.6021)0.223±0.0181)SPC-A-14.787±0.7421)0.572±0.0621)A5493.954±0.6831)0.435±0.0511)F14.15861.123P<0.05<0.05
Note:Compared with MRC5 cells,1)P<0.05.

图2 Girdin-siRNA转染SPC-A-1细胞后Girdin的蛋白表达Fig.2 Expression of Girdin protein in SPC-A-1 cells transfected with Girdin-siRNA
表2Girdin-siRNA转染SPC-A-1细胞后Girdin的蛋白表达
Tab.2ExpressionofGirdinproteininSPC-A-1cellstransfectedwithGirdin-siRNA

GroupsRelative expression of Girdin proteinBlank group0.425±0.039NC group0.437±0.041Girdin-siRNA group0.113±0.0151)F88.619P<0.05
Note:Compared with blank group,1)P<0.05.
2.4Girdin对SPC-A-1细胞凋亡的影响 通过Annexin V-FITC/PI双染法检测各组细胞的凋亡率,结果如图3和表4所示,Girdin-siRNA组和顺铂组均能诱导肺癌细胞凋亡,与空白对照组比较差异均具有统计学意义(P<0.05),两者联合对细胞凋亡影响优于Girdin-siRNA组和顺铂组(P<0.05)。
2.5Girdin对SPC-A-1细胞IL-8和TNF-α表达的影响 IL-8和TNF-α的mRNA表达检测结果如表5所示,Girdin-siRNA组和顺铂组IL-8和TNF-α的表达均显著低于空白对照组(P<0.05),两者联合对IL-8和TNF-α表达的影响优于Girdin-siRNA组和顺铂组(P<0.05)。
表3Girdin对SPC-A-1细胞增殖的影响
Tab.3EffectofGirdinonproliferationofSPC-A-1cells

GroupsOD570 nmBlank group0.693±0.058Girdin-siRNA group0.482±0.0451)2)Cisplatin group0.431±0.0441)2)Girdin-siRNA+cisplatin group0.301±0.034F37.624P<0.05
Note:Compared with blank group,1)P<0.05;compared with Girdin-siRNA+cisplatin group,2)P<0.05.

图3 Girdin对SPC-A-1细胞凋亡的影响Fig.3 Effect of Girdin on apoptosis of SPC-A-1 cells
表4Girdin对SPC-A-1细胞凋亡的影响
Tab.4EffectofGirdinonapoptosisofSPC-A-1cells

GroupsApoptosis rate(%)Blank group1.65±0.45Girdin-siRNA group7.43±0.621)2)Cisplatin group9.78±0.781)2)Girdin-siRNA+cisplatin group13.95±1.02F141.440P<0.05
Note:Compared with blank group,1)P<0.05;compared with Girdin-siRNA+cisplatin group,2)P<0.05.
2.6Girdin对SPC-A-1细胞PCNA、Caspase-3、Bax、PI3K和p-AKT表达的影响 Western blot检测各组细胞增殖相关蛋白PCNA、凋亡相关蛋白Caspase-3、Bax及PI3K/AKT信号通路PI3K和p-AKT的蛋白表达,结果如图4和表6所示,与空白对照组比较,Girdin-siRNA组和顺铂组Caspase-3、Bax表达均显著升高(P<0.05),PCNA、PI3K和p-AKT表达均显著降低(P<0.05),两者联合对Caspase-3、Bax、PCNA、PI3K和p-AKT表达影响优于Girdin-siRNA组和顺铂组(P<0.05)。
表5Girdin对SPC-A-1细胞IL-8和TNF-α表达的影响
Tab.5EffectofGirdinonexpressionofIL-8andTNF-αinSPC-A-1cell

GroupsmRNA relative expressionIL-8TNF-αBlank group11Girdin-siRNA group0.453±0.0471)2)0.523±0.0631)2)Cisplatin group0.511±0.0561)2)0.606±0.0611)2)Girdin-siRNA+cisplatin group0.301±0.0320.383±0.045F172.31986.431P<0.05<0.05
Note:Compared with blank group,1)P<0.05;compared with Girdin-siRNA+cisplatin group,2)P<0.05.

图4 Girdin对SPC-A-1细胞PCNA、caspase3、Bax、PI3K和p-AKT表达的影响Fig.4 Effect of Girdin on expression of PCNA,caspase3,Bax,PI3K and p-AKT in SPC-A-1 cellsNote: 1.Blank control group;2.Girdin-siRNA group;3.Cisplatin group;4.Girdin-siRNA+cisplatin group.
表6Girdin对SPC-A-1细胞PCNA、Caspase-3、Bax、PI3K和p-AKT表达的影响
Tab.6EffectofGirdinonexpressionofPCNA,Caspase-3,Bax,PI3Kandp-AKTinSPC-A-1cells
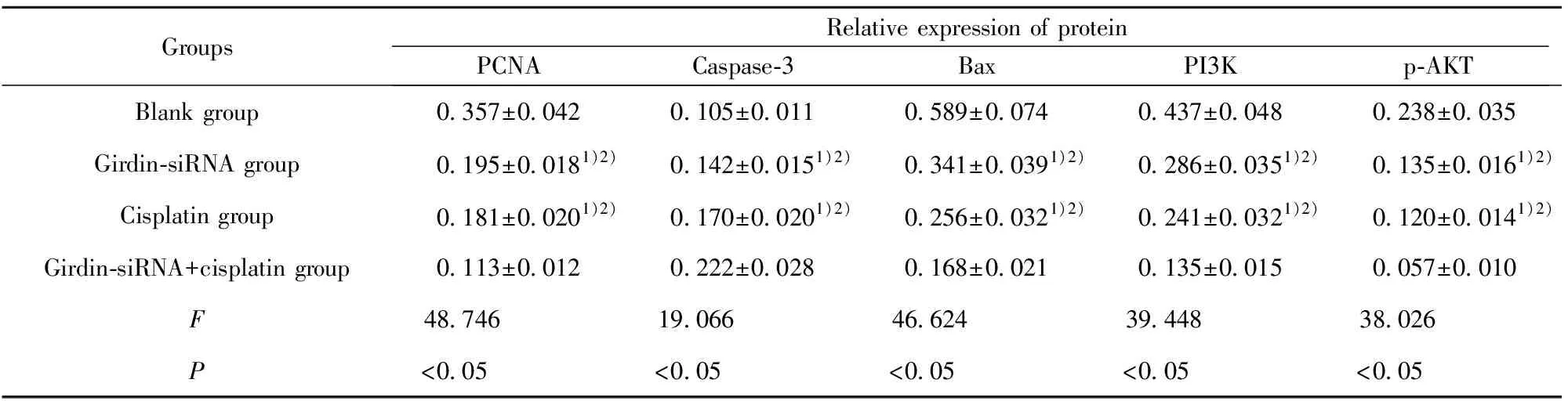
GroupsRelative expression of proteinPCNACaspase-3BaxPI3Kp-AKTBlank group0.357±0.0420.105±0.0110.589±0.0740.437±0.0480.238±0.035Girdin-siRNA group0.195±0.0181)2)0.142±0.0151)2)0.341±0.0391)2)0.286±0.0351)2)0.135±0.0161)2)Cisplatin group0.181±0.0201)2)0.170±0.0201)2)0.256±0.0321)2)0.241±0.0321)2)0.120±0.0141)2)Girdin-siRNA+cisplatin group0.113±0.0120.222±0.0280.168±0.0210.135±0.0150.057±0.010F48.74619.06646.62439.44838.026P<0.05<0.05<0.05<0.05<0.05
Note:Compared with blank group,1)P<0.05;compared with Girdin-siRNA+cisplatin group,2)P<0.05.
3 讨论
肺癌是引起肿瘤死亡的一个主要原因,遗传因素及环境对表观遗传的改变是一个重要原因[17,18]。因此,深入探究肺癌发生及发展过程中新的关键分子,并研究其机制,对于肺癌的治疗具有重要意义。PI3K/AKT信号通路是细胞内一条重要的信号途径,与包括肺癌在内的多种肿瘤发生发展中起到重要作用,可调节细胞周期、抑制细胞凋亡、促进细胞的转移和侵袭、促进细胞生成等[19-23]。Girdin是一种新型的肌动蛋白结合蛋白,位于PI3K/AKT下游,在其C端1416位具有丝氨酸磷酸化作用位点,可特异性地与AKT的C端结合协同促进其磷酸化和激酶活性[24,25]。目前在多种肿瘤包括子宫颈、胆管癌、消化道等组织样本中均发现Girdin的普遍表达,且具有程度不同的高表达,因此普遍认为Girdin对肿瘤发生发展有促进作用[26,27]。乳腺浸润性导管癌中Girdin的高表达可促进细胞的转移及侵袭过程,抑制食管鳞癌中Girdin的表达可降低癌细胞侵袭及迁移能力[28,29]。Girdin对肺癌细胞增殖及凋亡的影响及机制还未清楚。
本研究首先通过RT-PCR及Western blot方法检测不同肺癌细胞株中Girdin的表达,选择高表达肺癌细胞株SPC-A-1为研究对象,RNA干扰(RNAi)技术可使靶序列降解,从而沉默基因表达,是近些年来迅速发展起来研究基因功能的新技术,目前也得到了广泛的应用[30-32]。通过脂质体LipofectamineTM2000将Girdin的siRNA转染细胞,发现转染Girdin的siRNA后细胞中Girdin的蛋白表达明显降低,说明该序列可用于后续的实验研究。为了研究Girdin对肺癌细胞增殖凋亡的影响及是否可增强化疗敏感性,将细胞分为空白对照组、Girdin-siRNA组、顺铂组和Girdin-siRNA组+顺铂组,通过MTT检测各组细胞活力,流式细胞术检测细胞凋亡,发现Girdin-siRNA和顺铂均能抑制细胞活力,诱导细胞凋亡,两者联合效果更强。有研究显示,抑制肺癌中PI3K/AKT信号通路可通过影响下游靶基因PCNA、Caspase-3和Bax的表达而阻止肺癌进展[33]。PCNA是一个分子量为36 kD的非组蛋白,是合成DNA不可缺少的因子,可作为包括肺癌在内的多种肿瘤细胞增殖检测指标[34]。Caspase-3属于Caspase级联反应下游的一个关键成员,是发挥凋亡作用的关键酶,活化的Caspase-3可使细胞凋亡进入不可逆阶段[35,36]。研究发现,肺癌中Caspase-3表达降低,提高其表达后可诱导癌细胞的凋亡[37]。Bax为Bcl-2家族中的一员,发挥促凋亡作用,过表达Bax不仅可使多种细胞发生自发凋亡,而且可增加由多种因素引起的细胞凋亡[38,39]。IL-8和肿瘤坏死因子α(Tumor necrosis factor α,TNF-α)参与肺癌的发生发展,是反映肺癌体内免疫的重要指标[40]。为了检测Girdin对肺癌增殖、凋亡机制及免疫的影响,通过Western blot检测各组细胞PCNA、Caspase-3、Bax及PI3K/AKT信号通路PI3K和p-AKT的蛋白表达,RT-PCR检测IL-8和TNF-α的mRNA表达,发现Girdin-siRNA和顺铂均能抑制PCNA、PI3K、p-AKT、IL-8和TNF-α表达,上调Caspase-3和Bax表达,两者合用效果更强。
综上所述,抑制肺癌细胞Girdin表达通过下调PI3K/AKT信号通路降低癌细胞增殖及诱导细胞凋亡,提高免疫,并增殖顺铂对癌细胞化疗敏感性。对细胞增殖的影响是下调PCNA表达,凋亡的影响是上调Caspase-3和Bax表达。本研究结果初步证实了Girdin对肺癌增殖凋亡、免疫的影响,并可增加化疗敏感性,可能作为肺癌分子诊断及靶向治疗靶点,但本研究的内容有限,还需更多的实验研究作进一步的证实。
