硫唑嘌呤预处理对大鼠心肌缺血再灌注损伤的作用及机制的研究
2019-03-11于保旭李铁成
于保旭 李铁成
(锦州医科大学附属第三医院,锦州121000)
随着心脏介入手术的广泛开展,在治疗以急性心梗为代表的心血管疾病上取得了巨大进步,然而,再灌注损伤带来的弊端也让我们临床工作者不容忽视[1]。硫唑嘌呤(Azathioprine,AZA)是临床上常用的免疫抑制剂,其作用机制主要体现在阻碍嘌呤核苷生成。但是AZA在心肌缺血再灌注损伤是否也具有保护作用,其保护作用具体体现在哪一种机制上到目前为止尚无确切定论[2]。本研究以心肌缺血再灌注损伤为切入点,研究硫唑嘌呤预处理对MIRI大鼠模型的保护作用,探讨硫唑嘌呤在心肌缺血再灌注损伤中的分子机制和其与TLR4信号通路之间的内在联系,为硫唑嘌呤的临床疗效提供实验依据。
1 材料与方法
1.1材料
1.1.1实验动物 SPF级SD大鼠30只,12周龄、雄性、体质量180~220 g,购自锦州医科大学实验动物中心。
1.1.2主要试剂 硫唑嘌呤(C9H7N7O2S,分子量277.27)购自上海意杰生物科技有限公司;MDA、SOD、MPO、TNF-α和IL-6试剂盒购自南京建成生物工程研究所;TLR4抗体及鼠单克隆抗β-actin购自武汉博士德公司;其他试剂由锦州医科大学生命科学院实验室提供。
1.2方法
1.2.1动物模型的建立 SD大鼠用3%戊巴比妥钠以50 mg/kg剂量腹腔注射麻醉,固定四肢后安装心电监护仪,气管插管并连接动物呼吸机(潮气量为1.5 ml/100 g,频率60次/min),用针型电极记录大鼠心电图。之后切开大鼠皮肤:以胸骨中线为基准,起于胸锁关节平线止于剑突上方。钝性分离肌群,剪断胸骨左缘处第2~4根肋骨,开胸器撑开,将心包剪开暴露心脏。分离左冠状动脉前降支,用2/0-T号线在冠脉左前降支1~2 mm处穿线结扎[3]。各组(假手术组除外)用一凹形乳胶管垫在血管与结扎线之间,自心肌缺血在心电图中显示开始,30 min 后将结扎线顺着凹形乳胶管剪掉,使心肌血流恢复,随后保持120 min再灌注。结扎冠状脉期间,以心电图改变确定缺血再灌注造模成功[4]:冠状动脉左前降支结扎,ST段明显抬高;再灌注时,ST段抬高后回落,回落幅度不低于50%。
1.2.2实验分组 将SD大鼠随机分为模型组、硫唑嘌呤组和假手术组,每组10只。模型组(Model):结扎30 min以上,保持120 min再灌注,且冠脉下穿线。硫唑嘌呤组(AzA):硫唑嘌呤以3 mg/kg 剂量于手术前5 d每天灌胃给药,5 d后的处理同模型组。假手术组(Sham):保持不结扎状态,且穿线位置设定为冠状动脉左前降支1~2 mm 处。
1.2.3标本采集 造模完毕,大鼠麻醉并消毒后快速于颈总动脉处取血并摘除心脏。血液以3 000 r/min 离心10 min取上清于EP管中。
1.2.4实验指标检测
1.2.4.1心肌梗死面积测定 取心脏后,将右心室心肌和心房去除,预冷PBS清洗,-20℃ 20 min后取出心脏,按管状结扎线下方与冠状沟平行的方向将心室切成厚度相等的5片,置于0.5%NBT溶液中,在37℃水浴中染色,PBS清洗,拍摄并分析。梗死区面积(%)=梗死区面积/全部心脏面积[5]。
1.2.4.2电镜下心肌细胞超微观察 标本送至锦州医科大学实验室由科研老师帮助完成。
1.2.4.3血液检测 采用全自动生化分析仪检测血清中CK-MB、cTnⅠ含量;试剂盒检测SOD、MPO活力及MDA、TNF-α、IL-6水平。操作步骤按说明书进行。
1.2.4.4Western blot方法检测心肌组织TLR4蛋白表达 心肌组织剪碎后,加入裂解液再用超声波粉碎,4℃ 10 000 r/min离心20 min,取上清进行BSA定量。上清液100℃ 10 min蛋白变性,配制分离胶(12%)和浓缩胶(5%)。加样15 μl,电压调至80 V,电泳20 min,条带刚跑过分离胶时调电压至110 V,待所检测条带跑至适合的位置(根据marker判断)停止电泳。120 mA恒流120 min转膜,5%BSA封闭,室温1 h,摇床。加1∶500 TLR4/1∶500 β-actin一抗稀释液后,用自封袋压膜,封好后4℃摇床过夜。加1∶5 000羊抗兔IgG二抗,室温孵育1 h。ECL发光,8 bit存图。Image J软件分析。
1.2.4.5免疫组化法对TLR4定位 石蜡常规脱蜡透明;组织抗原修复:放入抗原修复仪中,内含柠檬酸Ag修复液,94℃ 20 min,PBS冲洗 5 min/次×3次;3%H2O2室温10 min,PBS冲洗5 min/次×3次;羊血清工作液室温1 h;滴加一抗TLR4(1∶200),4℃过夜;PBS冲洗5 min/次×3次;滴加PV9001二抗试剂(1)/(2),37℃ 20 min,PBS冲洗5 min/次×3次;DAB显色液约5~10 min,ddH2O洗涤5 min/次×3次;苏木素复染5~7 min,流水冲洗 5 min,根据染色情况进行1%盐酸酒精分化;酒精二甲苯透明后封片。Ipwin32软件分析。

2 结果
2.1大鼠心肌梗死面积的测定 与假手术组比较,模型组大鼠心肌梗死面积显著增大(P<0.01);与模型组比较,硫唑嘌呤组大鼠心肌梗死面积呈降低趋势(P<0.01)。由此可见,在缺血再灌注条件下,经硫唑嘌呤预处理,心肌遭受破坏的状况明显改善。见图1、表1。
2.2心肌组织电镜下改变 假手术组心肌间质正常,细胞各结构无水肿,电子分布较深且均匀,心肌纤维呈有序排列。模型组心肌细胞膜表面有致密电子阴影,细胞水肿严重,部分细胞器崩解,且心肌纤维呈无序断裂状。相较于模型组,硫唑嘌呤组心肌细胞水肿坏死状况有所改善,细胞膜表面可见少量电子阴影,心肌纤维基本正常。见图2。

图1 三组大鼠心肌梗死面积Fig.1 Myocardial infarct size in three groups of rats
2.3血清CK-MB和cTnⅠ含量 与假手术组比较,模型组SD大鼠血清CM-MB及cTnⅠ水平呈增高趋势(P<0.01);与模型组比较,硫唑嘌呤组大鼠血清CK-MB及cTnⅠ水平呈降低趋势(P<0.01)。见表2。
2.4SOD活性和MDA含量 与假手术组比较,模型组大鼠血清SOD含量均降低且MDA水平上升(P<0.01);与模型组比较,硫唑嘌呤组大鼠SOD水平升高而MDA降低(P<0.01)。见表3。
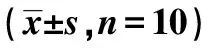
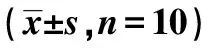

GroupsDosage(mg/kg)Infarctsize(%)Sham group-0.36±0.04Model group-32.98±4.681)AZA group3 15.13±2.142)
Note:1)P<0.01 vs sham group;2)P<0.01 vs model group.

图2 电镜下心肌超微结构变化Fig.2 Ultrastructure changes of myocardium by electr-on microscopy
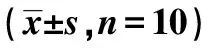


GroupsDosage(mg/kg)CK-MB(ng/ml)cTnⅠ(ng/ml)Sham group-27.41±3.703.62±0.51Model group-86.35±7.901)11.46±0.911)AZA group345.33±6.802) 5.52±0.742)
Note:1)P<0.01 vs sham group;2)P<0.01 vs model group.
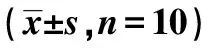


GroupsDosage(mg/kg)SOD(U/ml)MDA(nmol/ml)Sham group-178.63±22.202.21±0.32Model group-131.32±17.301)3.54±0.421)AZA group3162.37±16.802) 2.80±0.292)
Note:1)P<0.01 vs sham group;2)P<0.01 vs model group.
2.5大鼠MPO含量 与假手术组比较,模型组大鼠血清MPO水平显著增高(P<0.01);与模型组比较,硫唑嘌呤组大鼠MPO水平有一定程度的下调(P<0.01)。由此可知,硫唑嘌呤预处理方式可减轻由心肌缺血所致的心肌组织破坏程度。见表4。
2.6TNF-α和IL-6含量 与假手术组比较,模型组大鼠血清TNF-α和IL-6水平均上升(P<0.01);与模型组比较,硫唑嘌呤组大鼠TNF-α和IL-6水平呈降低趋势(P<0.01)。见表5。


GroupsDosage(mg/kg)MPO(U/g protein)Sham group-5.83±0.75Model group-15.50±1.331)AZA group3 9.31±0.852)
Note:1)P<0.01 vs sham group;2)P<0.01 vs model group.

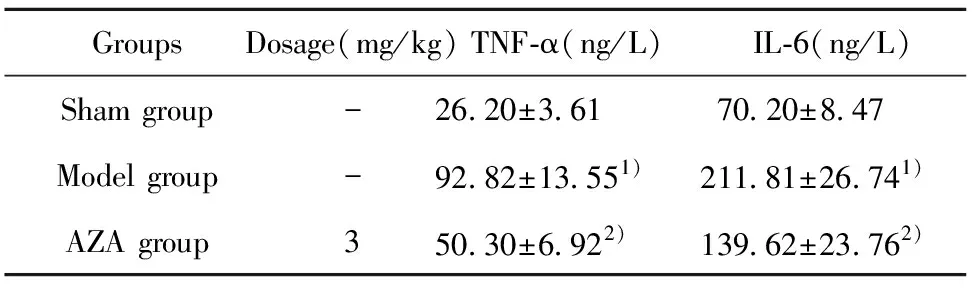
GroupsDosage(mg/kg)TNF-α(ng/L)IL-6(ng/L)Sham group-26.20±3.6170.20±8.47Model group-92.82±13.551)211.81±26.741)AZA group350.30±6.922) 139.62±23.762)
Note:1)P<0.01 vs sham group;2)P<0.01 vs model group.

图3 心肌组织TLR4定位Fig.3 Location of TLR4 in myocardial tissue

图4 心肌组织TLR4蛋白表达Fig.4 Expression of TLR4 in myocardial tissue
2.7大鼠心肌组织TLR4蛋白表达 与假手术组比较,模型组大鼠TLR4蛋白显著增高上调(P<0.01);与模型组比较,硫唑嘌呤组大鼠TLR4蛋白呈降低趋势(P<0.01)。见图3、4。
3 讨论
心肌缺血再灌注损伤的发病机制具有一定的复杂性,其病理生理因素涉及氧化应激、内皮细胞功能紊乱、炎症反应、细胞凋亡等多个环节[5]。丙二醛(MDA)是脂质过氧化的主要产物,直接反映机体氧化应激程度,并间接体现氧自由基对组织的损伤水平。超氧化物酶(SOD)作为氧自由基清除酶,能够清除氧自由基及脂质过氧化物,缓解氧自由基诱导的组织损伤,并在一定程度上修复受损组织细胞[6]。近年来研究发现,炎症反应是导致心肌缺血再灌注损伤的主要环节,TLR4/NF-κBp65通路是细胞间信息交流的主要路径,此通路活化能促进炎症因子生成,加快缺血再灌注损伤的发展进程[7]。
本研究发现,硫唑嘌呤预处理能显著降低血清中CK-MB、cTnⅠ活性及减小心肌梗死灶面积。由此可见,硫唑嘌呤能抑制心肌损伤所致的生物膜系统损伤,减少收缩蛋白cTnⅠ及肌细胞特有酶CK-MB从损伤的心肌内部进入到血液中,客观证实了硫唑嘌呤能有效改善心肌损伤情况。电镜结果显示模型组心肌纤维断裂,分列紊乱,细胞肿胀坏死,严重者局灶性坏死,并有炎性细胞侵润。硫唑嘌呤可使肌纤维排列趋于正常,降低炎性细胞侵润程度,减轻细胞肿胀和坏死,提示硫唑嘌呤预处理可改善缺血再灌注损伤的心肌形态,对MIRI大鼠的心肌具有保护作用。
有研究表明心肌缺血再灌注损伤打破机体原有的氧自由基生成和清除的动态平衡,当机体血流供应恢复之后氧自由基大幅度生成导致细胞出现急、慢性损伤[8,9]。本实验结果显示,缺血再灌注损伤导致机体自由基水平升高同时清除能力下降,而硫唑嘌呤处理降低脂质过氧化产物MDA水平,上调抗氧化物SOD活性,改善氧化应激水平,促进机体氧化-抗氧化平衡。同时硫唑嘌呤预处理使MPO含量下降,即氧化损伤明显减轻,也说明了硫唑嘌呤可能通过减轻氧化应激,进而缓解心肌缺血再灌注损伤。
近年大量研究证实TLR4信号转导通路是造成心肌缺血再灌注损伤的一项重要的信号途径,其与氧自由基的形成有十分密切的联系,同时还能够激活中性粒细胞,加强缺血区域的炎症反应强度[10,11]。本实验发现,硫唑嘌呤预处理可以明显降低由缺血再灌注导致的TLR4蛋白表达增加及细胞炎症因子TNF-α、IL-6水平,进一步说明硫唑嘌呤预处理对缺血再灌注心肌炎症反应有抑制作用。Chong等[12]研究采用野生型(C3H/HeN)小鼠和TLR4基因缺陷小鼠(C3H/Hej)建立心肌缺血再灌注损伤模型,结果发现C3H/Hej小鼠的炎症反应强度低于C3H/HeN小鼠,同时心肌梗死灶面积也减少40%。Oyama等[13]采用相同的动物建立心肌缺血再灌注损伤模型,发现基因缺陷性小鼠心肌缺血梗死灶面积、补体沉积以及脂质过氧化水平、中性粒细胞浸润水平均明显低于野生型小鼠。由此可见,TLR4参与心肌缺血再灌注损伤时中性粒细胞的聚集效应,促进缺血缺氧区域的炎症反应,激活下游细胞因子发挥损伤效应。而硫唑嘌呤预处理可以明显抑制缺血再灌注激活的TLR4通路,下调下游炎症细胞因子TNF-α、IL-6表达,改善缺血再灌注引起的心肌炎症反应,从而降低再灌注损伤。
综上所述,硫唑嘌呤预处理通过下调TLR4信号通路,抑制心肌缺血再灌注导致的过度氧化应激反应及炎症反应,促进氧化-抗氧化平衡,在一定程度上缓解缺血再灌注引起的心肌损伤进程,为心肌缺血再灌注损伤的临床治疗提供新思路。
