TWS119联合细胞因子促进CD8+记忆性T细胞分化及功能①
2019-03-11申春一田永贵
申春一 张 震 田永贵 张 毅
(郑州大学第一附属医院生物细胞治疗中心,郑州450052)
在肿瘤免疫治疗中,过继性细胞免疫治疗(Adoptive cell therapy,ACT)作为一种新兴的肿瘤治疗策略,发展迅速,T细胞免疫治疗在其中扮演着重要的角色[1]。但T细胞在体外培养过程中大部分走向终末分化状态,其抗肿瘤效应受到局限[2]。CD8+记忆性T细胞(memory T cell,Tm)包括中心记忆性T细胞(central memory T cell,Tcm)、效应记忆性T细胞(effector memory T cell,Tem)和干细胞样T细胞(T memory stem cell,Tscm)。由于其分化状态低、体内存活时间长,同时具有较强的抗肿瘤效应,因此在免疫治疗中展现出一定的优势[3,4]。其中,Tscm由静息状态的T细胞(naive T cell,Tn)发育而来,是介于Tn与Tcm之间的一群细胞,同时具有Tn细胞和Tm细胞的特性,可以分化为Tcm细胞和Tem[5]。与Tn相比,Tscm向肿瘤部位趋化及分泌细胞因子的能力较强[6];与Tem和效应性T细胞(effector T cell,Teff)相比,Tscm具有较强的增殖和自我更新能力[7]。将Tscm用于免疫治疗,能获得更好的疗效。因此,如何在体外大量扩增Tscm细胞并提高其抗肿瘤能力是目前研究的重点。T细胞的分化受多种因素的影响,记忆亚群的形成受到信号通路的调控,Wnt通路的激活可有效促进CD8+T细胞向记忆亚群分化[8]。TWS119为4,6-二取代吡咯并嘧啶,可通过抑制糖原合成酶-3β(Glycogen-sythase kinase-3β,GSK-3β)的磷酸化,激活Wnt-β-连环蛋白通路,促进Tscm亚群的形成[9]。在培养体系中加入细胞因子如IL-7、IL-15、IL-21也可有效诱导Tm细胞的产生[10]。本研究旨在探索体外采用TWS119联合不同细胞因子培养对CD8+T细胞分化及功能的影响,筛选最优组合,为记忆T细胞在临床治疗中的应用提供实验基础。
1 材料与方法
1.1材料 RPMI1640培养基、胎牛血清均购自美国HyClone公司,人外周血淋巴细胞分离液购自天津灏洋生物制品有限公司,流式荧光抗体均购自美国Biolegend公司,Human CD8 microbeads购自德国美天旎公司,Dynabeads Human T-Activator CD3/CD28购自美国Thermo Fisher Scientific公司,TWS119购自美国Selleck Chemicals公司,重组人白介素-2购自北京双鹭药业股份有限公司,重组人白介素-7、重组人白介素-15、重组人白介素-21均购自美国peprotech公司。
1.2方法
1.2.1外周血单个核细胞的分离 无菌条件下采集健康供者的外周血10 ml于肝素抗凝采血管中,室温下1 500 r/min离心10 min;将上层血清移至无菌离心管中-80 ℃保存,下层细胞移至50 ml离心管中,加入PBS稀释至30 ml;取另一支50 ml离心管,加入淋巴细胞分离液15 ml,离心管呈45°倾斜,用无菌吸管将稀释后的血液缓慢加于淋巴细胞分离液的液面上;2 500 r/min离心25 min;离心结束后用无菌吸管小心吸取白膜层置于另一无菌离心管中,加入适量PBS,1 500 r/min离心10 min,得到的沉淀即外周血单个核细胞(Peripheral blood mononuclear cells,PBMC)。
1.2.2细胞免疫磁珠分选 将分离出的PBMCs用磁分选缓冲液重悬,于显微镜下细胞计数后,1 500 r/min 离心10 min,弃上清;每1×107个细胞加入80 μl 磁分选缓冲液和 20 μl 人CD8磁珠混匀,避光4 ℃孵育20 min。孵育后加入适量磁分选缓冲液,1 500 r/min离心10 min,弃上清。将磁分选柱用配套的适配器固定于磁场中,柱下放置收集管,加入适量缓冲液润洗后,将细胞悬液缓慢加入柱内,待柱内液体滴尽后,再使用缓冲液洗柱2次。取一支50 ml离心管,将柱取下用活塞加压将细胞收集至离心管内,即为CD8+T细胞。
1.2.3CD8+T细胞体外处理及培养 CD8+T细胞重悬于含10%胎牛血清的RPMI1640培养基中,调整细胞密度为1×106ml-1,同时加入CD3/CD28活化磁珠,将细胞铺于24孔板中,每孔1×106个细胞。实验共设置10组,分别是对照组、TWS119单独处理组、IL-7+IL-15处理组、IL-7+IL-15+TWS119联合处理组、IL-7+IL-21处理组、IL-7+IL-21+TWS119联合处理组、IL-15+IL-21处理组、IL-15+IL-21+TWS119联合处理组、IL-7+IL-15+IL-21处理组、IL-7+IL-15+IL-21+TWS119联合处理组。人IL-7、IL-15重组蛋白的浓度为5 ng/ml,人IL-21重组蛋白的浓度为20 ng/ml,TWS119的浓度为5 μmol/L,处理 6 d 后进行检测。
1.2.4流式细胞术检测不同处理组CD8+T细胞分化及表面分子表达情况 CD8+T细胞经分组处理 6 d 后,将每组细胞分为2管,收集于1.5 ml离心管中,1 500 r/min 离心5 min,弃上清。用PBS洗涤细胞,离心弃上清后避光加入流式表面抗体CD8-APC-Cy7,CD45RA-PerCP,CD62L-PE,CD95-PE-Cy7,每组的2管细胞分别加入抗体CD27-FITC、CD28-APC和 PD-1-FITC、Tim-3-APC。避光4 ℃孵育20 min后使用流式细胞仪检测CD8+T细胞亚群及表面分子表达情况。以CD45RA及CD62L区分CD8+T细胞的不同亚群:CD45RA+CD62L+为CD8+Tn细胞;CD45RA-CD62L+为CD8+Tcm细胞;CD45RA-CD62L-为CD8+Tem细胞;CD45RA+CD62L+CD95+为CD8+Tscm细胞。
1.2.5细胞内因子检测 各组细胞体外培养6 d后,分别加入PMA(50 mg/L)、离子霉素(750 mg/L)和阻断剂BFA(1×),在37℃、5%CO2培养箱中培养6 h。后将每组细胞分2管收集于1.5 ml离心管中,1 500 r/min离心5 min,弃上清。用PBS洗涤细胞,离心弃上清后避光加入流式表面抗体CD8-APC-Cy7、CD45RA-PerCP、CD62L-PE、CD95-PE-Cy7,避光4 ℃孵育20 min,每管加入200 μl 4%多聚甲醛固定,4 ℃避光固定30 min后,1 500 r/min离心5 min,弃上清。加入10×破膜剂200 μl,4 ℃避光孵育1 h,1 500 r/min离心5 min,弃上清。每组的2管细胞分别避光加胞内抗体IFN-γ-APC、TNF-α-APC,4 ℃避光孵育20 min。使用流式细胞仪检测细胞因子分泌情况。实验重复3次。
1.2.6细胞抗凋亡能力检测 将各组细胞收集于1.5 ml离心管中,用PBS清洗2遍,弃上清,加200 μl Annexin V binding buffer重悬,避光加入流式抗体CD8-PE,Annexin V-APC,避光4 ℃孵育20 min,上样前加入抗体碘化丙啶(Propidium iodide,PI),使用流式细胞仪检测细胞凋亡情况。实验重复3次。

2 结果
2.1IL-7+IL-21+TWS119联合处理促进CD8+T细胞向记忆亚群分化 体外采用不同细胞因子联合TWS119培养处理CD8+T细胞6 d后,经流式细胞仪检测CD8+T细胞亚群比例(图1A)。结果显示,与对照组相比,IL-7+IL-21+TWS119联合处理组中Tcm细胞的比例明显增加(图1B)[(8.23±3.46)% vs (30.80±4.53)%,P<0.05]。进一步分析其倍数,结果显示IL-7+IL-21+TWS119组合Tcm的增殖倍数是对照组的3倍,说明该组合能有效扩增Tcm细胞。同时,Tscm细胞的比例也显著提升(图2)[(13.00±1.68)% vs (56.70±6.24)%,P<0.001]。提示采用IL-7+IL-21+TWS119处理可显著促进Tcm细胞和Tscm细胞形成,有效抑制CD8+T细胞向终末状态分化。由此可见,该组合为各实验组中促进记忆亚群形成的最优组合。

图1 CD8+T细胞经不同组合处理后各亚群变化情况Fig.1 Subsets of CD8+T cells treated with different groupsNote: A.The proportion of subsets among CD8+T cells in different groups;B.Frequencies of Tcm among CD8+T cells in different groups.Vs control group,*.P<0.05.
2.2IL-7+IL-21+TWS119联合处理对CD8+T细胞表面分子表达的影响 流式细胞分析技术检测CD8+T细胞表面激活及抑制型分子的表达情况,结果显示,经处理后,CD8+T细胞表面激活型标志CD28和CD27表达水平与对照组相比均有不同程度升高(图3),且以IL-7+IL-21+TWS119组合变化最为显著[CD28:(18.28±3.57)% vs(62.08±10.64)%,P<0.001;CD27:(15.73±4.864)% vs(70.97±2.39)%,P<0.01]。同时表面抑制型分子PD-1及Tim-3表达水平检测结果显示(图4):抑制型分子表达水平较对照组显著下调[PD-1:(11.73±3.04)% vs(3.133±0.31)%,P<0.001;Tim-3:(14.33±2.03)% vs(2.77±0.31)%,P<0.001]。结果提示:TWS119联合IL-7、IL-21可显著活化CD8+T细胞,诱导CD28和CD27表达水平升高,PD-1和Tim-3表达水平下调。
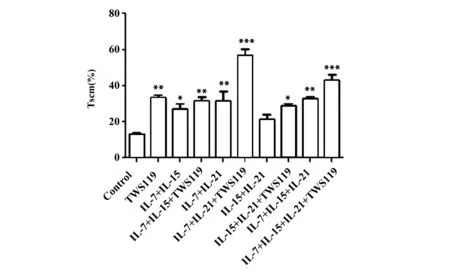
图2 CD8+T细胞经不同组合处理后Tscm亚群变化情况Fig.2 Frequencies of Tscm among CD8+T cells in different groupsNote: Vs control group,*.P<0.05,**.P<0.01,***.P<0.001.
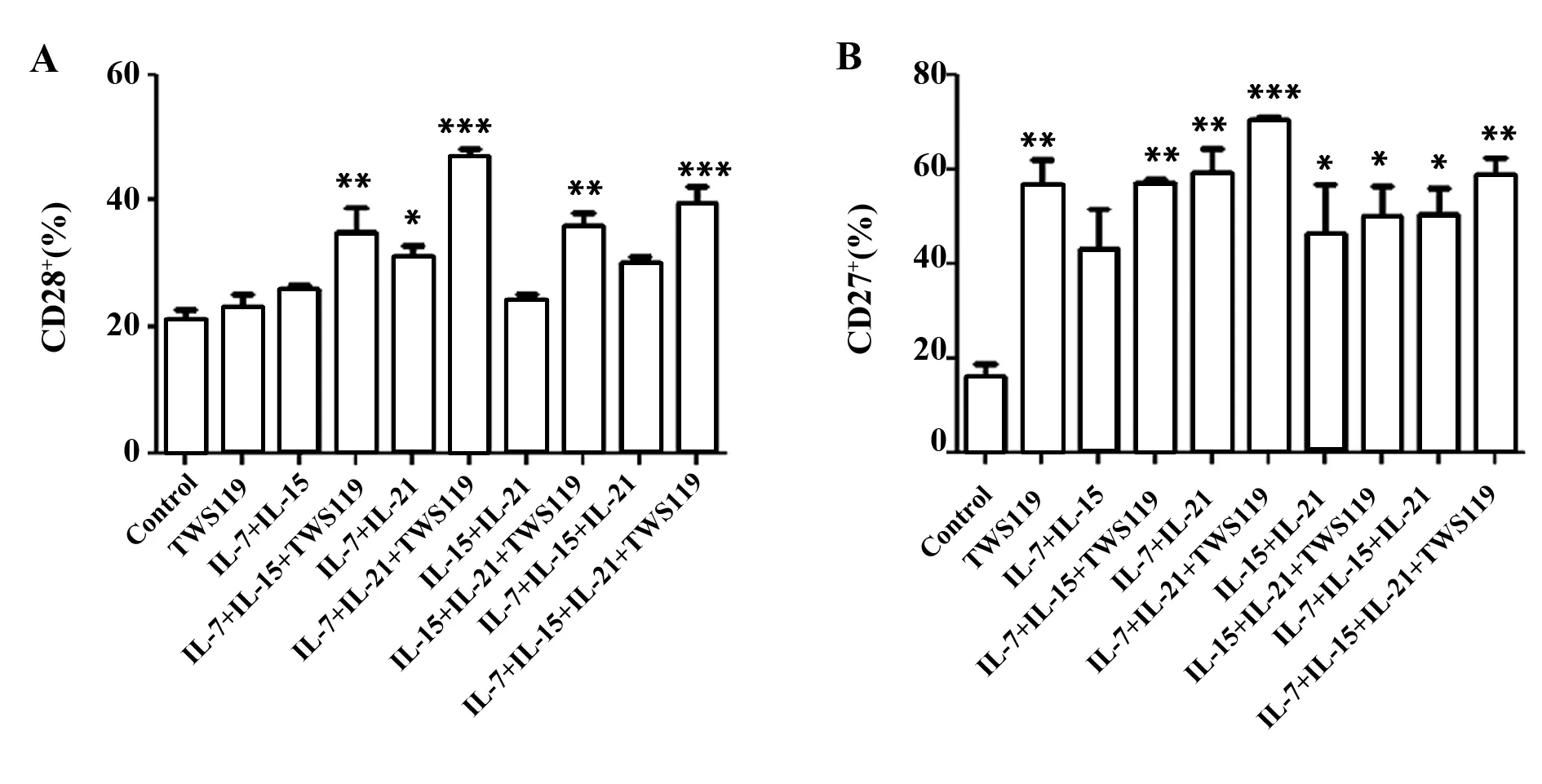
图3 CD8+T细胞经不同组合处理后表面激活型分子表达情况Fig.3 Activating markers of CD8+T cells after treated with different groupsNote: Frequencies of CD28+(A) and CD27+(B) cells in CD8+T cells.Vs control group;*.P<0.05,**.P<0.01;***.P<0.001.
2.3IL-7+IL-21+TWS119联合处理促进CD8+T细胞内因子的分泌 与对照组相比,IL-7+IL-21+TWS119处理后的CD8+T细胞IFN-γ和TNF-α的分泌水平明显提高(图5A、B)[IFN-γ:(9.65±2.56)% vs(35.98±8.04)%,P<0.001;TNF-α:(12.13±3.11)% vs(44.10±2.43)%,P<0.001]。进一步分析对照组与IL-7+IL-21+TWS119组平均荧光强度(MFI),结果显示与对照组相比,加入IL-7+IL-21+TWS119后,IFN-γ和TNF-α阳性细胞的MFI均显著升高(图5C、D)[IFN-γ:(2.97±0.83)% vs(8.43±0.87)%,P<0.05;TNF-α:(2.23±0.44)% vs(6.27±0.41)%,P<0.05]。上述结果提示:TWS119联合细胞因子IL-7、IL-21可明显增强CD8+T细胞抗肿瘤能力,IFN-γ和TNF-α等细胞因子分泌水平均显著升高。
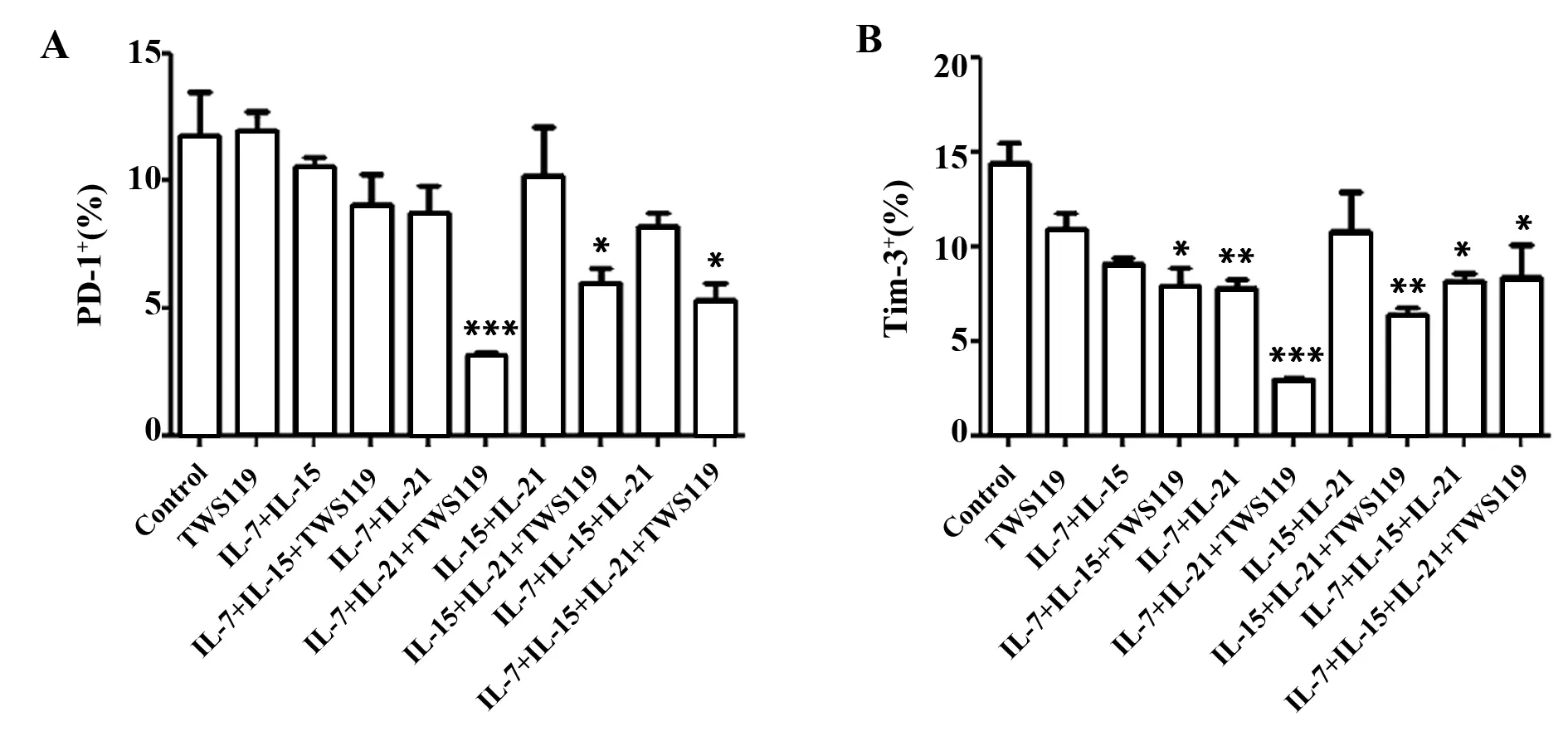
图4 CD8+T细胞经不同组合处理后表面抑制型分子表达情况Fig.4 Inhibitory markers of CD8+T cells after treated with different groupsNote: Frequencies of PD-1+(A) and Tim-3+(B) cells in CD8+T cells.Vs control group,*.P<0.05,**.P<0.01,***.P<0.001.
2.4IL-7+IL-21+TWS119联合处理增强CD8+T细胞抗凋亡能力 采用不同组合处理CD8+T细胞后,流式细胞术检测细胞凋亡情况(图6)。与未处理组相比,处理组的CD8+T细胞凋亡比例明显减少,其中IL-7+IL-21+TWS119处理组凋亡细胞比例减少最为显著[(21.28±2.25)% vs(7.80±0.82)%,P<0.001]。结果表明:采用IL-7+IL-21+TWS119处理CD8+T细胞,可使细胞存活时间在体外培养过程中延长,抗凋亡能力明显增强。

图5 CD8+T细胞经不同组合处理后细胞因子分泌情况Fig.5 Cytokine production in CD8+T cells treated with different groupsNote: The secretion of IFN-γ(A) and TNF-α(B) by CD8+T cells.The MFI of IFN-γ(C) and TNF-α(D) of control group and IL-7+IL-21+TWS119 group.Vs control group,*.P<0.05,**.P<0.01,***.P<0.001.

图6 CD8+T细胞经不同组合处理后细胞凋亡情况Fig.6 Apoptosis of CD8+T cells treated with different groupsNote: A.The percentage of apoptotic cells of CD8+T cells;B.Flow cytometry gating strategy for apoptosis of CD8+T cells.Vs control group,*.P<0.05,**.P<0.01,***.P<0.001.
3 讨论
T细胞在肿瘤免疫治疗中发挥巨大的作用。细胞毒性T细胞(Cytotoxic T lymphocyte,CTL)在激活后,可通过分泌颗粒酶、穿孔素、细胞因子等介质介导肿瘤细胞裂解死亡;另外,CTL细胞表面的FASL可结合肿瘤细胞表面的FAS分子,诱导肿瘤细胞凋亡[11]。在ACT治疗过程中,T细胞在体外培养会大量向终末期分化,这类细胞在体内存活能力较弱,影响免疫治疗的疗效[2,12]。因此如何在体外获得寿命较长且抗肿瘤能力较强的CD8+记忆性T细胞尤为重要。本研究发现TWS119联合细胞因子可有效诱导CD8+T细胞向记忆亚群分化,经最优组合IL-7+IL-21+TWS119处理后可获得大量具有更强抗肿瘤能力的CD8+记忆性T细胞。
有研究报道,TWS119作为Wnt-β-连环蛋白通路的激活剂,可有效诱导CD8+记忆性T细胞,尤其是Tscm亚群的产生。Forget等[13]研究发现,将TWS119作用于健康人PBMC和肺癌患者肿瘤浸润淋巴细胞,Tscm亚群形成增多。但是该研究的内因子检测发现,经TWS119处理后,CD8+T细胞分泌促炎因子减少。本研究结果显示,经处理后CD8+T细胞内因子分泌水平升高,可能由于同时联合细胞因子处理可更有效增强CD8+T细胞的抗肿瘤效应。除激活Wnt通路外,Scholz等[14]的研究证实了TWS119可同时抑制mTOR通路并促进Tscm细胞的形成。为我们揭示了TWS119诱导Tscm形成的另一条通路。
T细胞的体外培养需要细胞因子的参与,加入不同细胞因子可影响T细胞的增殖和分化。IL-7是非造血干细胞来源的一类细胞因子,与其受体IL-7Rα结合后,激活Jak3-Stat5通路,上调抗凋亡基因Bcl-2和Mcl-1的表达,抑制Bax和Bak等促凋亡蛋白的形成,维持Tn和Tm细胞的生存[15]。IL-15是一种免疫刺激因子,具有促进T细胞增殖,诱导其活化,并有助于抗原特异性CD8+Tm细胞的形成和其表型的维持[16]。有研究显示,IL-7联合IL-15在体外培养Tn细胞,得到大量存活时间长且抗肿瘤能力强的Tscm细胞,并在免疫缺陷小鼠中进行了体内功能验证[17]。Chapuis等[18,19]将来源于恶性黑色素瘤患者的CTL细胞用IL-21处理后,功能得到增强并诱导记忆性T细胞形成,同时联合CTLA-4单抗用于难治性恶性黑色素瘤的治疗,肿瘤得到有效控制。在Zoon等[20]的工作中,将乳腺癌小鼠引流淋巴结的淋巴细胞分别用IL-2、IL-21、IL-2+IL-21、IL-7+IL-15和IL-7+IL-15+IL-21培养。结果显示,与其他组合相比,IL-7+IL-15+IL-21培养体系可诱导大量Tcm细胞形成,IL-21及IL-2+IL-21的培养体系可促进大量Tn细胞产生,并显著提高IFN-γ分泌水平。在本研究中,采用IL-7+IL-21组合或IL-7+IL-15+IL-21组合联合TWS119培养CD8+T细胞,均可显著促进CD8+T细胞记忆表型的形成,同时增强其抗肿瘤效应,但是两组合之间并无差异,因此IL-7+IL-21联合TWS119在本研究中为最优组合。
嵌合抗原受体(Chimeric antigen receptors,CAR)T细胞是免疫治疗在肿瘤治疗应用中的重大突破之一,于2017年8月已被FDA批准应用于急性淋巴细胞白血病的治疗。Sabatino等[21]采用IL-7+IL-21联合TWS119在体外诱导出大量Tscm细胞,再进行目的基因的转染,获得了可用于临床的CD19-CAR-Tscm细胞。与普通CAR-T细胞相比,经处理的CD19-CAR-Tscm细胞具有更强的抗肿瘤能力。研究表明,利用低分化状态细胞制备CAR-T细胞可获得更好疗效,展现了细胞因子和信号通路激活剂在CAR-T细胞临床应用中的广阔前景。
本研究发现,细胞因子联合小分子化合物TWS119可诱导记忆性CD8+T细胞分化,特别是Tscm亚群的形成,并有效增强T细胞功能。根据前期结果我们筛选出最优组合:IL-7+IL-21+TWS119。本研究优化CD8+T细胞体外培养体系,获得大量存活时间长、抗肿瘤能力强的记忆性CD8+T细胞,并为其临床应用提供实验基础。
