肉苁蓉苷A通过TGF-β1/VEGF通路对放射性肺炎小鼠肺部氧化应激和炎症指标影响的研究①
2019-03-11许东风杨东明冯云枝杨明生
许东风 杨东明 冯云枝 杨明生
(南阳医专第一附属医院,南阳473000)
放疗性肺损伤是癌症放疗最常见的并发症,包括早期的放射性肺炎和晚期的放射性肺纤维化[1-3]。研究表明,超过30%接受放疗的肺癌、乳腺癌和淋巴瘤患者都会出现放射性肺损伤,其高发病率极大地限制了放疗的剂量并增加了胸部恶性肿瘤患者的死亡风险[4]。大量研究表明,氧化应激和大量炎症因子的释放与放射性肺损伤密切相关,其参与了放疗诱导的肺炎及肺纤维化[5-8]。因此,寻找新的药物抑制放疗后肺部氧化应激及炎症因子的释放对减轻放疗并发症具有重要意义。肉苁蓉是我国传统的补药[9],现代研究表明其具有增强机体免疫力、抗衰老、抗炎、抗氧化和抗脂质过氧化的功能[10-12]。肉苁蓉A是肉苁蓉的活性成分之一,也有研究表明其具有抗炎和抗氧化活性[13]。本研究将通过复制放射性肺损伤小鼠模型,探讨肉苁蓉苷A对肺部氧化应激和炎症反应的作用及机制。
1 材料与方法
1.1材料
1.1.1试验药物 肉苁蓉苷A购自成都瑞芬思生物科技有限公司。分子式为C36H48O20,分子量为800.755(见图1),纯度>98%,使用时用吐温-80助溶,吐温-80终浓度不超过1%。
1.1.2动物 45只清洁级C57BL/6小鼠购自成都达硕实验动物有限公司。自由进食进水,适应性喂养3 d后用于实验。
1.1.3试剂 吐温-80购自美国Sigma公司。谷胱甘肽过氧化物酶 (Glutathione peroxidase,GSH-PX)、丙二醛 (Malondialdehyde,MDA)、总抗氧化能力 (Total antioxidant capacity,T-Aoc) 和超氧化物歧化酶 (Superoxide dismutase,SOD) 试剂盒购自南京建成生物工程研究所。白介素-6 (Interleukin-6,IL-6)、IL-10和IL-1β ELISA试剂盒购自美国Millipore公司。抗转化生长因子-β1 (Transforming growth factor-β1,TGF-β1)、抗血管内皮细胞生长因子 (Vascular endothelial growth factor,VEGF) 和抗血管内皮细胞生长因子受体2 (Vascular endothelial growth factor receptor 2,VEGFR2) 抗体购自英国Abcam公司,生物素标记二抗和HRP标记二抗购自美国Millipore公司。
1.1.4仪器 Precise直线加速器购自瑞典ELEKTA公司。HBS-1096B酶标仪购自南京德铁公司。垂直电泳仪和凝胶成像系统购自美国Bio-Rad公司。生物显微镜购自德国Leica公司。
1.2方法
1.2.1动物模型 将45只C57BL/6小鼠随机分为健康组、肉苁蓉苷A组、放射组和放射+肉苁蓉苷A组。用10%水合氯醛麻醉小鼠,放射组和放射+肉苁蓉苷A组小鼠均采用加速器X射线单次照射,总剂量为20 Gy。X射线照射4 h后,肉苁蓉苷A组和放射+肉苁蓉苷A组小鼠灌胃给予肉苁蓉苷A,0.5 g/kg;健康组和放射组小鼠给予等量溶媒,每天一次,30 d后处死小鼠,进行后续检测。

图1 肉苁蓉苷A的化学结构式Fig.1 Chemical structure formula of Cistanoside A
1.2.2Tunel检测细胞凋亡 用4%多聚甲醛室温固定肺组织2 h后制作肺组织冰冻切片,并置于-80℃冰箱保存备用。临用前取出相同部位切片,于室温放置45 min后,用缓冲液清洗3次,每次10 min。根据Tunel试剂盒说明书检测小鼠肺组织凋亡小体形成情况。
1.2.3GSH-PX、MDA、T-Aoc、SOD、IL-6、IL-1β和IL-10浓度检测 取各组小鼠相同部位肺组织,制作肺匀浆,3 000 r/min离心20 min,取上清液,根据试剂盒说明书检测肺匀浆中GSH-PX、MDA、T-Aoc、SOD、IL-6、IL-1β和IL-10浓度。
1.2.4免疫组化检测TGF-β1的表达 取冰冻切片复温后,用PBS缓冲液清洗3次,加入柠檬酸钠进行抗原修复。待切片自然冷却并清洗后,滴加5%封闭用山羊血清室温封闭切片2 h。封闭完成后,滴加抗TGF-β1抗体于4℃孵育过夜,抗体浓度为1∶200。第2天滴加生物素标记二抗,室温孵育1 h,洗涤3次,滴加辣根酶标记的链霉卵白工作液,37℃孵育15 min,用DAB显色,苏木精复染、封片,用生物显微镜拍片记录,每片选取5个视野进行计数统计。
1.2.5Western blot检测蛋白表达 取相同部位肺组织并剪碎,用RIPA裂解液提取肺组织蛋白,BCA试剂盒对其进行定量分析。用10%SDS-PAGE分离蛋白、转移蛋白至PVDF膜后,用5%BSA室温封闭蛋白2 h,加入一抗4℃封闭过夜。第二天洗去一抗(TGF-β1,1∶1 000;VEGF,1∶1 200;VEGFR2,1∶1 000),加入二抗室温封闭1 h后,将膜洗净,滴加化学发光液,用凝胶成像系统获取蛋白条带图片,并用ImageJ软件对蛋白条带灰度值进行定量分析。

2 结果
2.1肉苁蓉苷A对放射性肺损伤小鼠肺组织细胞凋亡的影响 Tunel实验结果表明,与健康组比较,肉苁蓉苷A组小鼠肺组织凋亡小体数目无明显变化 (P>0.05,图2),放射组小鼠肺组织凋亡小体数明显增多 (P<0.05,图2);与放射组比较,放射+肉苁蓉苷A组小鼠凋亡小体明显减少,差异有统计学意义 (P<0.05,图2)。
2.2肉苁蓉苷A对放射性肺损伤小鼠肺组织氧化应激的影响 与健康组比较,放射组小鼠肺组织GSH-PX、T-Aoc和SOD的浓度明显降低(P<0.05,图3),肉苁蓉苷A组小鼠肺组织GSH-PX、T-Aoc和SOD的浓度无明显变化 (P>0.05,图3);与放射组比较,放射+肉苁蓉苷A组小鼠肺组织GSH-PX、T-Aoc和SOD的浓度明显升高 (P<0.05,图3);此外,放射组小鼠肺组织MDA浓度与健康组比较明显升高 (P<0.05,图3),放射+肉苁蓉苷A组小鼠肺组织MDA浓度显著低于放射组,差异具有统计学意义(P<0.05,图3)。
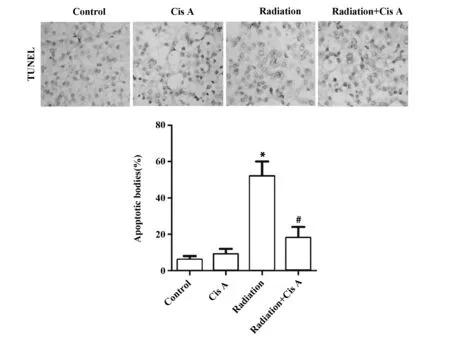
图2 肉苁蓉苷A对放射性肺损伤小鼠肺组织细胞凋亡的影响Fig.2 Effect of Cis A on cell apoptosis of radiation-induced lung injury in miceNote: *.P<0.05 vs control group;#.P<0.05 vs radiation group.
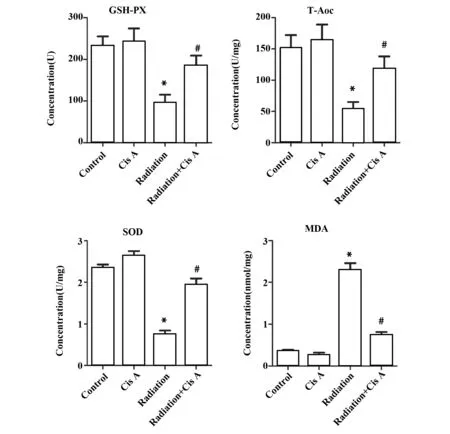
图3 肉苁蓉苷A对放射性肺损伤小鼠肺组织氧化应激的影响Fig.3 Effects of Cis A on oxidative stress of radiation-induced lung injury in miceNote: The concentrations of GSH-Px,T-Aoc,SOD and MDA were measured by kits.*.P<0.05 vs control group;#.P<0.05 vs radiation group.
2.3肉苁蓉苷A对放射性肺损伤小鼠肺组织炎症反应的影响 ELISA实验结果表明,肉苁蓉苷A对正常小鼠肺匀浆IL-6 、IL-1β和IL-10浓度无明显影响 (P>0.05,图4);照射后30 d,放射组小鼠肺匀浆IL-6和IL-1β的浓度显著高于健康组 (P<0.05,图4),IL-10浓度与健康组比较明显降低 (P<0.05,图4);放射+肉苁蓉苷A组小鼠肺匀浆IL-6和IL-1β的浓度明显降低 (P<0.05,图4),IL-10浓度明显升高 (P<0.05,图4),与放射组比较,差异具有统计学意义。

图4 肉苁蓉苷A对放射性肺损伤小鼠肺组织炎症反应的影响Fig.4 Effect of Cis A on inflammation of radiation-induced lung injury in miceNote: The concentrations of IL-6,IL-1β and IL-10 were determined by ELISA assay.*.P<0.05 vs control group;#.P<0.05 vs radiation group.

图5 肉苁蓉苷A对TGF-β1表达的影响Fig.5 Effect of Cis A on expression of TGF-β1Note: *.P<0.05 vs control group;#.P<0.05 vs radiation group.
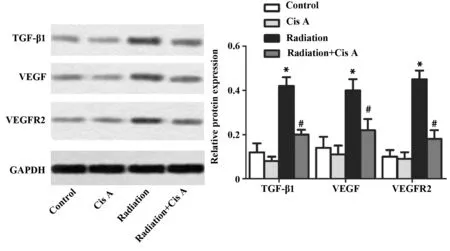
图6 肉苁蓉苷A对TGF-β1/VEGF信号通路的影响Fig.6 Effect of Cis A on TGF-β1/VEGF signaling pathwayNote: The protein levels of TGF-β1,VEGF and VEGFR2 were measured by Western blot,GAPDH was used as loading control.*.P<0.05 vs control group;#.P<0.05 vs radiation group.
2.4肉苁蓉苷A对TGF-β1/VEGF信号通路的影响 与健康组比较,放射组小鼠肺组织TGF-β1阳性细胞数明显增多(P<0.05,图5),肉苁蓉苷A组TGF-β1阳性细胞数无明显变化 (P>0.05,图5);与放射组比较,放射+肉苁蓉苷A组小鼠肺组织TGF-β1阳性细胞数明显减少(P<0.05,图5);此外,放射组小鼠肺组织TGF-β1、VEGF和VEGFR2的蛋白表达水平均显著高于健康组 (P<0.05,图6);放射+肉苁蓉苷A组小鼠肺组织TGF-β1、VEGF和VEGFR2的蛋白表达水平与放射组比较均明显降低,差异具有统计学意义(P<0.05,图6)。
3 讨论
放射性肺损伤是胸部恶性肿瘤放疗最常见的并发症,其高发病率严重限制了放疗在癌症中的应用[14]。目前,对于放射性肺损伤的机制还不完全清楚,并且缺乏安全有效的治疗药物。肉苁蓉苷A具有抗炎、抗氧化活性,且具有肝细胞保护功能,但其能否影响放疗诱导肺损伤的发展尚未见报道[13,15]。研究表明,电离辐射诱导细胞凋亡是放疗治疗癌症的主要机制,但同时也会造成正常细胞大量死亡[16,17]。本文研究发现,放疗能明显诱导小鼠肺组织正常细胞凋亡,表明放疗可造成小鼠肺损伤。肉苁蓉苷A能显著减弱放疗对肺组织凋亡小体形成的诱导作用,减少肺组织正常细胞凋亡,提示肉苁蓉苷A可能对放射性肺损伤模型小鼠具有肺保护作用。
放射性肺损伤是由多个细胞因子共同介导的病理过程[18]。研究表明,放疗可导致肺泡上皮细胞和内皮细胞损伤,从而诱导白细胞黏附和炎症因子的大量释放,如IL-6、TNF-α和IL-1β等[19,20]。其中,IL-6是一类成纤维细胞生长因子,研究表明其与肺功能不全、肺部感染和呼吸道炎症等多类肺部疾病的发生发展密切相关[21-24]。也有研究发现,IL-6在放射后表达水平呈上升趋势,且基本与放疗性肺损伤同时出现,因此常被作为放疗后肺损伤发生的标志。IL-1β在放射后表达水平也明显升高[25]。本文研究也表明,放射能显著升高小鼠肺组织IL-6和IL-1β浓度,同时还能抑制IL-10的表达。IL-10是一类炎症抑制因子,其高表达能抑制炎症反应的发生。提示放疗能诱导肺组织炎症反应。肉苁蓉苷A能显著减弱放疗对IL-6和IL-1β分泌的促进作用,同时还能升高放疗性肺损伤小鼠IL-10的分泌量,表明肉苁蓉苷A能够通过调控炎症因子的释放减轻放射性肺损伤小鼠肺组织炎症反应,从而减轻小鼠放射性肺损伤。
氧化应激是造成放射性肺损伤的重要机制之一[26]。放疗可通过作用于机体水分子和诱导的炎症细胞聚集而促进活性氧的产生,从而诱导氧化应激,造成DNA损伤,最终导致细胞损伤和死亡[27,28]。研究表明,约有60%~70%的放疗诱导的细胞损伤都与氧化自由基的产生有关[26,29,30]。SOD是机体最主要的自由基清除剂。在肺组织中主要由肺泡Ⅱ型肺细胞分泌产生,其可通过催化超氧阴离子和过氧化氢发生歧化反应而减少活性氧含量[31]。同时,SOD还能对抗炎症反应,抑制肺组织纤维化,SOD过表达能明显减轻放射性肺损伤小鼠肺部炎症反应和氧化损伤[32]。本研究实验结果表明,肉苁蓉苷A能显著升高放射性肺损伤小鼠肺组织SOD的浓度,同时还能促进GSH-PX和T-Aoc的分泌,抑制放射性肺损伤小鼠肺组织氧化产物MDA的产生。GSH-PX是一类过氧化物分解酶,T-Aoc反映了机体的抗氧化能力,提示肉苁蓉苷A能增强放射性肺损伤小鼠抗氧化能力,抑制肺组织氧化应激的发生。
TGF-β1是参与放射性肺损伤的纤维增生因子,主要由炎性细胞、间叶细胞和上皮细胞合成分泌[33,34]。TGF-β1过表达可促进炎症反应,还能通过诱导活性氧的释放诱导氧化应激,在放射性肺损伤发生发展过程中发挥重要作用[35]。抑制TGF-β1表达可减缓肺纤维化进程[36]。肉苁蓉苷A能显著减少放疗诱导的小鼠肺组织TGF-β1的阳性表达,同时还能抑制放射性肺损伤小鼠肺组织TGF-β1、VEGF和VEGFR2的蛋白表达。VEGF是血管新生的主要诱导因子。研究表明,放疗诱导的肝纤维化通常都伴有血管的新生,并且TGF-β1可通过调控VEGF表达诱导活性氧的产生,从而调控肺组织氧化反应[4,37]。结合实验结果表明,肉苁蓉苷A缓解放射性肺损伤小鼠肺部氧化应激和炎症反应可能与抑制TGF-β1/VEGF信号通路激活有关。
综上所述,肉苁蓉苷A能抑制放射诱导的小鼠肺组织细胞凋亡、氧化应激和炎症因子的释放,并且其机制可能与抑制TGF-β1/VEGF信号通路激活有关。本文仅初步探讨了肉苁蓉苷A对放疗诱导的肺损伤的作用及作用机制,可能为临床治疗放射性肺损伤提供了一新的候选药物,但其作用机制还有待进一步研究。
