RNA干扰LOXL2 基因对头颈部鳞状细胞癌凋亡及 PD-L1表达的影响
2019-03-11田双莲漆楚波朱润清
田双莲 漆楚波 朱润清
(湖北省肿瘤医院头颈放疗科,武汉430079)
头颈部鳞状细胞癌(Head and neck squamous cell carcinoma,HNSCC)是常见的原发于头颈部口腔颌面部的人类恶性肿瘤之一,近些年对该病的手术、放、化疗等综合措施虽有很大提高,但有部分肿瘤特别是下咽癌5年的生存率仍然很低,给人类的生命健康造成严重威胁[1]。近些年通过分子靶向治疗肿瘤成为热点,在HNSCC中也发现多个靶点,但仍需要寻找更多有效的靶点[2,3]。赖氨酰氧化酶样蛋白2(Lysyl oxidase-like 2,LOXL2) 基因定位于8p21.2-p21.3,是LOX家族的一个成员,是一类细胞外的修饰酶,生物学功能较广泛。近些年的研究表明,LOXL2 与胃癌、胰腺癌等多种肿瘤的发生发展密切相关。胃癌中抑制LOXL2 表达可降低癌细胞增殖,胰腺癌细胞中抑制LOXL2 表达可降低细胞增殖及侵袭能力,诱导细胞凋亡[4]。LOXL2 对HNSCC生物学特性的影响及机制研究相对较少,有研究发现LOXL2在HNSCC中高表达,高表达患者易发生早期转移,且预后差,抑制LOXL2表达可降低HNSCC细胞的侵袭转移能力[5],但对其凋亡及机制研究的尚未明确。PD-L1是一种重要的负性协同刺激分子,可介导肿瘤发生免疫逃逸[6]。LOXL2是否可影响PD-L1而对HNSCC免疫产生影响也尚未清楚。因此,本研究旨在抑制LOXL2表达对HNSCC细胞凋亡及PD-L1表达的影响及机制。
1 材料与方法
1.1材料 LipofectamineTM2000、RPMI1640培养基、MEM培养基、胎牛血清均购自美国Invitrogen;LOXL2、PD-L1、STAT3、p-STAT3、PCNA和Bax抗体均购自美国CST;BCA试剂盒购自上海碧云天;CCK8购自日本同仁研究所;Annexin V-FITC/PI细胞凋亡试剂盒、流式细胞仪均购自美国BD;酶标仪购自美国Bio-TEK,人HNSCC细胞YCU-H891(下咽鳞癌细胞)、YCU-N861(鼻咽鳞癌细胞)和KB(口腔鳞癌细胞)细胞均购自美国ATCC。
1.2方法
1.2.1细胞培养 细胞常规复苏后,YCU-H891和YCU-N861细胞用RPMI1640培养液,KB细胞用MEM培养液,培养液中均含有10%胎牛血清及青、链霉素双抗,于5%体积分数CO2培养箱37℃培养,细胞为单层贴壁生长。实验为生长至对数期的细胞。
1.2.2Western blot 适量裂解液提取细胞总蛋白,BCA试剂盒对蛋白浓度进行测定,蛋白煮沸变性5 min,取变性蛋白等量(40 μg),经10%的SDS-PAGE,蛋白分离后电转PVDF膜,用5%的脱脂奶粉将已转好的PVDF膜封闭1 h,洗膜,加入一抗稀释液(1∶1 000稀释的LOXL2 、PD-L1、STAT3、p-STAT3、PCNA和Bax抗体),4℃平缓摇动过夜,洗膜,室温加入二抗稀释液(1∶2 000稀释的HRP标记的抗体)孵育1 h,洗膜,经化学发光剂显影曝光摄片。以GAPDH为内参,以LOXL2 、PD-L1、STAT3、p-STAT3、PCNA和Bax与内参GAPDH的吸光度比值作为各蛋白的相对表达量。实验重复3次。
1.2.3siRNA转染 根据NCBI GenBank中提供的人LOXL2 的mRNA序列,遵循siRNA的设计原则,设计LOXL2的siRNA及无关对照序列,分别标记为si-LOXL2组和NC组,siRNA序列如下(均列出正义链):si-LOXL2:5′-GAAGGAGACAUCCAGAAGATT-3′,NC组:5′-CCCUUCUCUGUUUGUAAAGAGACAU-3′。按照LipofectamineTM2000说明制备siRNA-Lip2000混合物,经过优化实验,选择40 pmol/L的siRNA为转染浓度。转染前1 d以1×105个/孔细胞接种生长至对数期的KB细胞于6孔板,细胞达70%生长融合时,将siRNA转染细胞,并设置空白对照组,培养箱内孵育5~6 h,更换为不含抗生素的培养液。继续培养48 h用于实验研究。
1.2.4CCK8法检测细胞活力 胰酶消化、重悬生长至对数期的KB细胞,以每孔5 000个细胞接种于96孔板,每孔加入100 μl,培养24 h后,参照1.2.3方法转染siRNA,每组设置5个复孔,于转染的48 h加CCK8溶液,每孔中加入10 μl,37℃孵育2 h,酶标仪检测吸光度值(A值,450 nm)。实验重复3次。
1.2.5流式细胞仪检测细胞凋亡率 将生长至对数期的KB细胞制备成为单细胞悬液,以2×105孔-1接种于12孔板,培养24 h后转染siRNA,于转染后的48 h收集细胞,预冷的PBS洗涤细胞,结合缓冲液重悬细胞,分别加入AnnexinV-FITC和PI各5 μl,4℃避光放置10~15 min,加入400 μl结合缓冲液,流式细胞仪检测。分析各组细胞的凋亡情况。

2 结果
2.1LOXL2 在HNSCC细胞表达 以Western blot检测人HNSCC细胞YCU-H891、YCU-N861和KB中LOXL2 的蛋白表达,结果如图1所示,三个细胞中LOXL2 的蛋白表达分别为0.273±0.032、0.345±0.038、0.659±0.056,LOXL2 在KB细胞中的表达最高,选择作为研究对象。
2.2LOXL2 siRNA转染KB细胞的效果 LOXL2 siRNA转染KB细胞48 h,Western blot检测转染后的细胞中LOXL2的蛋白表达,结果如图2和表1所示,转染LOXL2 siRNA的KB细胞LOXL2的蛋白表达显著低于空白组(P<0.05),而在NC组中的表达与空白组无明显差异(P>0.05),这提示抑制LOXL2表达的KB细胞建立成功。

图1 LOXL2 在HNSCC细胞表达Fig.1 LOXL2 expression in HNSCC cells
2.3LOXL2 siRNA对KB细胞活力及凋亡率的影响 各组细胞活力及凋亡率检测结果如图3和表2所示,与NC组比较,si-LOXL2 组细胞活力明显降低,凋亡率明显升高,差异均具有统计学意义(P<0.05)。

图2 LOXL2 siRNA转染KB细胞的效果Fig.2 Effect of LOXL2 siRNA transfection on KB cells
表1LOXL2siRNA转染KB细胞后效果
Tab.1EffectofLOXL2siRNAtransfectiononKBcells

GroupsRelative expression of protein in KBBlank group0.502±0.043NC group0.526±0.047si-LOXL2 group0.087±0.0101)F131.862P0.000
Note:1)P<0.05 vs blank group.

图3 LOXL2 siRNA对KB细胞凋亡率的影响Fig.3 Effect of LOXL2 siRNA on apoptosis rate of KB cells
表2LOXL2siRNA对KB细胞活力及凋亡率的影响
Tab.2EffectofLOXL2siRNAonapoptosisrateofKBcells
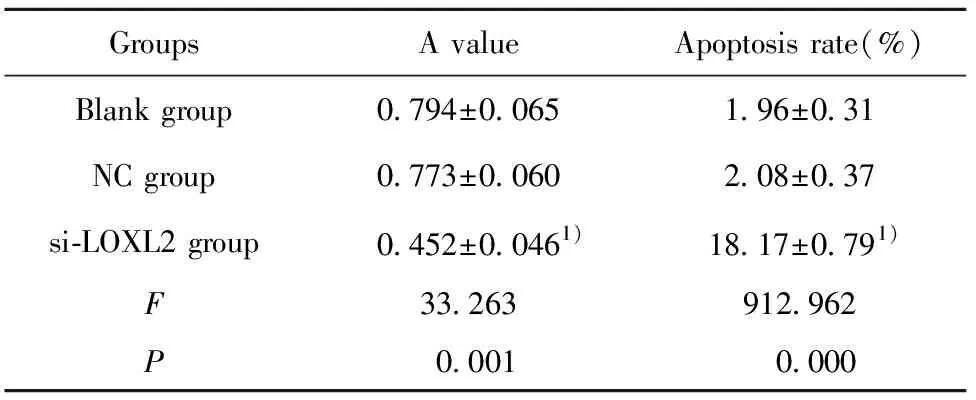
GroupsA valueApoptosis rate(%)Blank group0.794±0.0651.96±0.31NC group0.773±0.0602.08±0.37si-LOXL2 group0.452±0.0461)18.17±0.791)F33.263912.962P0.0010.000
Note:1)P<0.05 vs NC group.
2.4LOXL2 siRNA对KB细胞免疫逃逸相关基因PD-L1表达的影响 各组细胞PD-L1的蛋白表达结果如图4和表3所示,与NC组比较,si-LOXL2组PD-L1的蛋白表达明显降低,差异具有统计学意义(P<0.05)。
2.5LOXL2 siRNA对KB细胞STAT3信号通路的影响 各组细胞中STAT3、p-STAT3及STAT3信号通路下游增殖相关蛋白PCNA及凋亡相关蛋白Bax的表达结果如图5和表4所示,与NC组比较,si-LOXL2 组p-STAT3和PCNA蛋白表达明显降低,Bax蛋白表达明显升高,差异均具有统计学意义(P<0.05)。三组细胞中STAT3的蛋白表达差异无明显统计学意义(P>0.05)。

图4 LOXL2 siRNA对KB细胞PD-L1表达的影响Fig.4 Effect of LOXL2 siRNA on expression of PD-L1 in KB cells
表3LOXL2siRNA对KB细胞PD-L1表达的影响
Tab.3EffectofLOXL2siRNAonexpressionofPD-L1inKBcells

GroupsRelative expression of protein in KBBlank group0.489±0.054NC group0.472±0.051si-LOXL2 group0.125±0.0141)F66.478P0.000
Note:1)P<0.05 vs NC group.

图5 LOXL2 siRNA对KB细胞STAT3信号通路的影响Fig.5 Effect of LOXL2 siRNA on STAT3 signaling pathway in KB cells
表4LOXL2siRNA对KB细胞STAT3信号通路的影响
Tab.4EffectofLOXL2siRNAonSTAT3signalingpathwayinKBcells
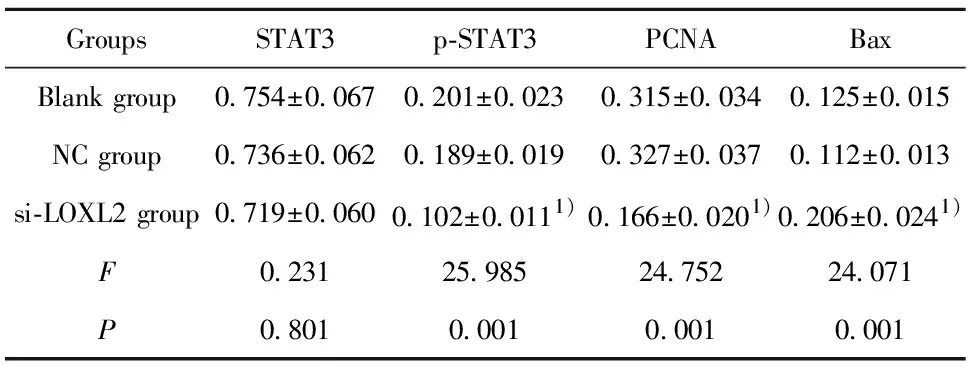
GroupsSTAT3p-STAT3PCNABaxBlank group0.754±0.0670.201±0.0230.315±0.0340.125±0.015NC group0.736±0.0620.189±0.0190.327±0.0370.112±0.013si-LOXL2 group0.719±0.0600.102±0.0111)0.166±0.0201)0.206±0.0241)F0.23125.98524.75224.071P0.8010.0010.0010.001
Note:1)P<0.05 vs NC group.
3 讨论
LOX是一类细胞外基质修饰酶,LOXL、LOXL2、LOXL3和LOXL4是4个与LOX结构同源和相似的酶,统称为LOX家族。LOXL2是LOX家族成员之一,在胎盘组织、子宫、前列腺中高表达,而在肾、心、肺等组织中呈现出低表达[7]。近些年研究发现LOXL2与多种肿瘤发生发展密切相关。如LOXL2的高表达与乳腺肿瘤的侵袭、转移相关[8];在HNSCC、食管癌中LOXL2的高表达不仅与恶性表型有关,还可对肿瘤侵袭转移起促进作用[9,10],这提示LOXL2影响HNSCC的发生发展。RNAi是一项基因功能研究的新技术,可在转染后表达沉默基因,阻断基因表达具有高效性、高稳定性和高特异性的特点[11,12]。有研究表明,通过RNAi技术抑制LOXL2表达可通过降低CD44、MMP-9表达介导胆管癌的侵袭和转移能力[13],通过RNAi技术抑制LOXL2表达可降低HNSCC细胞侵袭转移能力[5]。本研究旨在通过RNAi抑制LOXL2表达对HNSCC细胞凋亡及机制研究。通过Western blot分别检测下咽鳞癌细胞YCU-H891、鼻咽鳞癌细胞YCU-N861及口腔鳞癌细胞KB中LOXL2的表达,发现LOXL2在KB细胞中的表达最高,因此选择作为研究对象。将合成的LOXL2的siRNA转染KB细胞,发现LOXL2表达受到抑制后KB细胞活力明显降低,凋亡率增加,这提示抑制LOXL2表达可诱导HNSCC细胞凋亡。
STAT3是JAK/STATs信号通路重要成员之一,是一种具有致癌功能的转录因子,可被多种配体激活,如IL-6、IL-10等细胞因子等,EGF、HGF等生长因子类[14]。在多种肿瘤中出现过度激活,如HNSCC、白血病等[15,16],STAT3并不直接引起肿瘤的发生,而是通过诱导凋亡抑制因子、细胞周期调整因子等高表达,促进细胞增殖和抑制凋亡从而影响肿瘤发生发展,从而抑制STAT3信号通路可降低肿瘤的发生发展[17]。PCNA是DNA复制过程中的必需物质,与细胞增殖密切相关,已作为检测肿瘤细胞增殖活性的指标[18]。Bax是Bcl-2家族的促凋亡基因,其表达升高可对肿瘤细胞凋亡起促进作用[19]。PD-L1是CD28-B7受体家族的一个成员,主要在肿瘤细胞膜表面、NK细胞、B细胞和T细胞表达。在包括口腔鳞状细胞癌在内的多种恶性肿瘤中均有表达,其表达可介导肿瘤免疫逃逸[20]。而有研究指出,抑制其表达可逆转肿瘤的免疫抑制,达到抗肿瘤目的[21]。抑制STAT3信号通路可下调肺癌细胞PD-L1表达[22]。本研究中检测PD-L1、STAT3、p-STAT3、PCNA和Bax的蛋白表达,发现LOXL2表达受到抑制后p-STAT3、PCNA和PD-L1表达明显降低,Bax表达升高,这提示LOXL2可通过下调STAT3信号抑制HNSCC细胞生长及介导免疫逃逸。
综上所述,LOXL2在HNSCC细胞表达升高,抑制其表达可降低癌细胞活力,诱导细胞凋亡,降低免疫逃逸,机制可能与下调STAT3信号通路有关。本研究提示LOXL2可能是HNSCC治疗的一个有效的分子靶点。
