晚期肺腺癌胸苷酸合成酶和亚甲基四氢叶酸还原酶基因多态性与培美曲塞化疗的临床效果
2019-03-08白丽艳韩军王冬梅祁玉娟
白丽艳 韩军 王冬梅 祁玉娟
1青海省人民医院肿瘤内科(西宁810007);2青海大学(西宁810016)
肺癌位列全球发病率和死亡率的首位[1],预计美国在2018年将有15 万人死于肺癌[2]。非小细胞肺癌(non small-cell lung cancer,NSCLC)占肺癌患者的75%,腺癌占非小细胞肺癌患者的60%,肺癌预后较差,对于早期行根治性手术患者其5年生存率仍低于60%[3]。故晚期NSCLC 治疗的主要方式是多学科治疗为主的综合治疗[4]。培美曲塞是一种新型的抑制细胞生长的药物,作为多靶点抗叶酸制剂,参与嘧啶及嘌呤合成[5],在NSCLC和恶性胸膜间皮瘤[4]的治疗中具有较好疗效。培美曲塞联合铂类为晚期肺腺癌一线治疗首选[6]。胸苷酸合成酶(thymidylate synthase,TS)和亚甲基四氢叶酸还原酶(methylene tetrahydrofolate reductase,MTHFR)是培美曲塞的叶酸代谢的关键酶,本研究目的为探讨晚期肺腺癌TS、MTHFR 基因多态性与培美曲塞+铂类的疗效相关性研究。
1 材料与方法
1.1 研究对象 收集2014年9月至2017年5月的晚期肺腺癌58 例,男28 例,女30 例,中位年龄为55 岁(表1)。入组标准:所有入组病人病理诊断及分期检查明确的晚期肺腺癌,EGFR 及ALK 均无突变;年龄≥18 岁,ECOG 评分标准为评分0 ~1分,化疗前肝肾功能及心电图均正常,化疗前向患方签署化疗知情同意书及入组知情同意告知书。58 例按要求完成随访。其中25 例患者外周血标本提取DNA,按要求完成随访。
1.2 研究方法 全组患者一线化疗应用培美曲塞+铂类(顺铂、卡铂)方案(培美曲塞500 mg∕m2,d1,顺铂75 mg∕m2或卡铂AUC 5,d2),1 个周期为21 d,化疗前用维生素B12 及叶酸、地塞米松预处理。根据实体瘤疗效评价标准(RECIST 1.1)进行疗效评价:(1)所有目标病灶均消失且持续4 周为完全缓解(complete response,CR);(2)目标病灶肿瘤的最大径减少≥30%,持续时间>4 周为部分缓解(partial response,PR);(3)缩小未达到PR 或增加未达到PD(progressive disease,PD)为病灶稳定(stable disease,SD);(4)基线病灶最大径之和增大≥20%或有新发病灶为疾病进展。CR+PR+SD=DCR。PFS 以开始用药时间作为起点,疾病进展和∕或随访结束作为终点。每化疗2个周期行疗效评价,4 ~6 个周期化疗后疗效评价为SD 或PR 者继续以培美曲塞单药维持化疗,期间若病情进展临床表现需要提前进行疗效评价。
1.3 TS、MTHFR 基因多态性的检测
1.3.1 主要试剂 DNA 是用QIAamp DNA 试剂盒提取外周血细胞(Qiagen 公司,德国,批号:10402606),基因多态性通过聚合酶链反应(polymerase chain reaction,PCR)结合凝胶电泳的方法及测序。引物是上海捷瑞生物工程有限公司合成,测序是上海美吉生物医药科技有限公司完成的。
1.3.2 方法 采集3 mL 血液样本提取白细胞层,根据DNA 试剂盒说明书步骤提取基因组DNA 冻存于-80 ℃备用。
1.3.3 TS、MTHFR 基因型分析多态性通过聚合酶链反应(PCR)分析 反应条件如下:TS 基因多态性25 μL 的反应体系,预变性94 ℃3 min,变性94 ℃30 s,退火60 ℃1 min,72 ℃延伸至30 s,40 个循环后72 ℃延伸5 min。MTHFR 基因多态性25 μL 的反应体系,预变性为95 ℃15 min,变性94 ℃30 s,退火60 ℃30 s,72 ℃延伸30 s,35 个循环后72 ℃延伸10 min。TS 基因型用3%的琼脂糖凝胶电泳约30 min,进行凝胶图像分析(图1),经PCR 法分析TS 基因多态性(图2),经基因测序分析MTHFR 基因多态性(图3)。
1.4 统计学方法 采用软件SPSS 21.0 进行统计学分析。χ2检验比较率值,采用Kaplan-Meier 法计算生存曲线,以P<0.05 为差异有统计学意义。
2 结果
2.1 TS、MTHFR 基因型分布 TS 基因多态性的判断标准为双串联重复系列纯合子基因型2R∕2R 基因扩增产物片段大小215 bp,另一个产物片段大小245 bp 三串联重复系列纯合子基因型3R∕3R,杂合子2R∕3R产物片段大小分别为215、245 bp(图2)。MTHFR 基因多态性见测序结果(图3)。

图1 PCR 扩增Fig.1 PCR amplification

图2 TS 基因多态性检测Fig.2 TS gene polymorphism
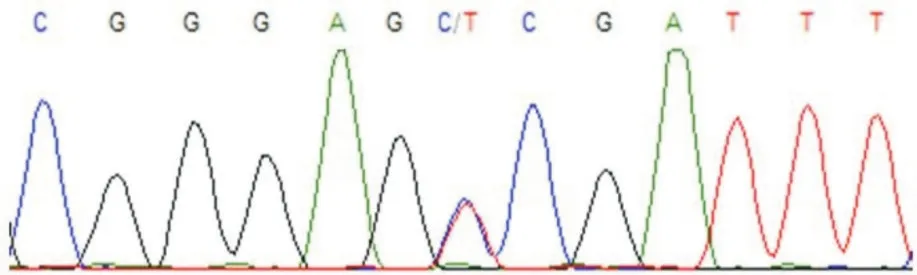
图3 MTHFR(rs1801133)(C∕T)基因测序结果Fig.3 MTHFR(rs1801133)(C∕T)gene sequencing results
2.2 TS、MTHFR 基因型与化疗疗效的关系
2.2.1 TS 基因型与化疗疗效的关系 全组患者58 例均至少完成2 个周期以上化疗,疾病控制率(DCR)38%,中位无进展生存期(PFS)8.1 个月。TS 基因2R∕2R 型理论频数小将其与性质相似2R∕3R 基因型合并并进行了统计,3R∕3R、2R∕2R+2R∕3R 基因型化疗的DCR 率分别为53.8%、91.7%,结果提示不同基因型与化疗疗效间差异有统计学意义(P<0.05,表2)。
2.2.2 MTHFR 基因型与临床化疗疗效的关系MTHFR 基因分布的结果T∕T 基因型的理论频数小将其与性质相近的基因型C∕T 基因型合并;C∕C、C∕T + T∕T 基因型DCR 率依次为70%、73.3%,二者差异无统计学意义(P>0.05,表2)。
2.3 TS、MTHFR 基因型与PFS 的关系
2.3.1 TS 基因型与PFS 的关系 将25 例患者进行TS 基因多态性分析,3R∕3R 型PFS 为9.3 个月,2R∕3R+ 2R∕2R 型PFS 为10.4 个月(P>0.05),结果提示TS 基因与PFS 未发现相关性;MTHFR 基因C∕C 基因型PFS 为10 个月;C∕T + T∕T 基因型其中位PFS 为9.7 个月(10 个月vs.9.7 个月),MTHFR 基因与PFS 未发现相关性,其生存曲线见图4。
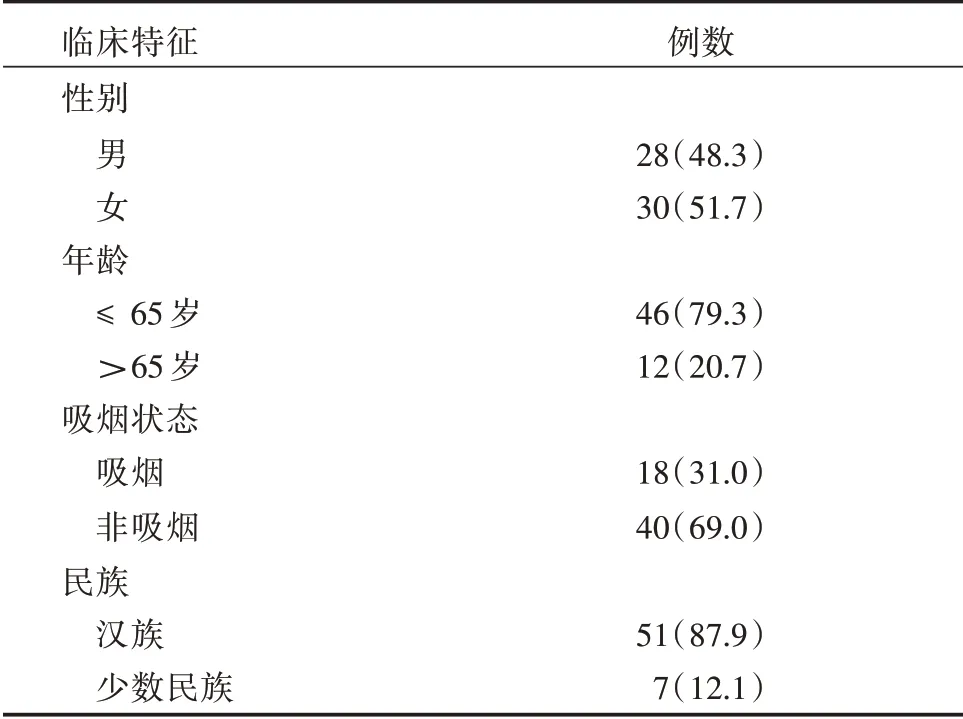
表1 晚期肺腺癌患者临床特征(n=58)Tab.1 Clinical features with advanced lung adenocarcinoma例(%)
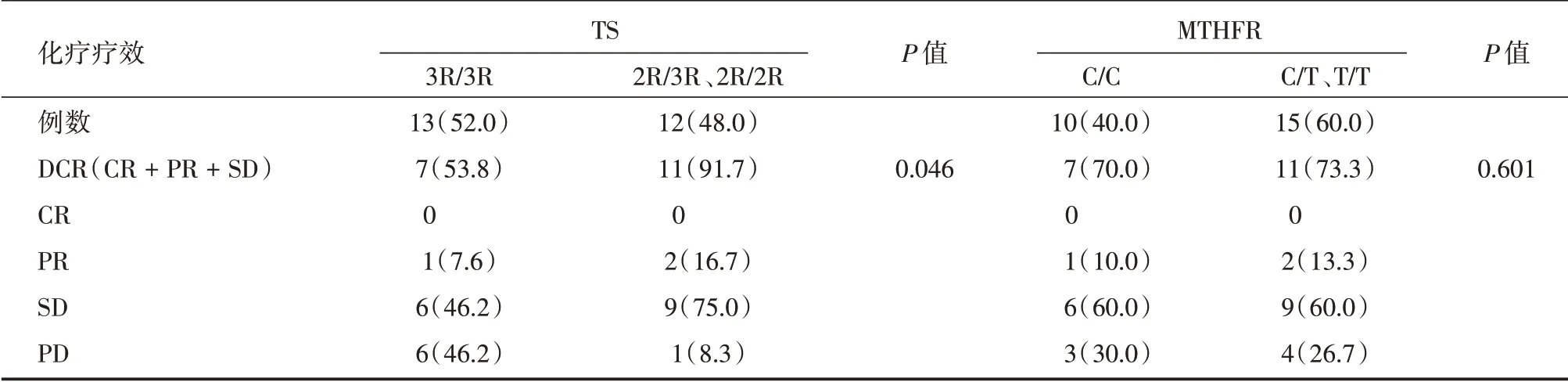
表2 晚期肺腺癌患者TS、MTHFR 基因多态性与化疗疗效相关性Tab.2 Correlation of TS and MTHFR genotypes with the response rates to chemotherapy in patients with advanced lung adenocarcinoma例(%)
3 讨论
培美曲塞是一种抗叶酸代谢的药物,批准用于晚期肺腺癌一线和二线化疗药物;作用于叶酸代谢途径的多个靶点,通过抑制多种DNA 合成酶包括TS、二氢叶酸还原酶(dihydrofolate reductase,DHFR)从而抑制叶酸的代谢[7]。TS 在细胞中是胸苷唯一来源,其主要作用为细胞生长和DNA 复制。TS 在多种肿瘤组织中均有代谢活性,研究表明TS 为叶酸抑制剂包括培美曲塞等多种化疗药主要靶点[8]。MANDOLA 等[9]研究了不同种族的单核苷酸多态性的分布,亚洲人群携带2R∕2R 基因型和2R∕3R 及3R∕3R 基因型分别为2%、34%和64%,此基因多态性结果与本研究类似。
波兰KRAWCZYK 等[10]研究一线培美曲塞+铂类化疗晚期的非鳞NSCLC 患者,TS 基因多态性携带3R∕3R 的患者比携带2R∕2R 和2R∕3R 的PFS缩短,TS 基因多态性可能是NSCLC 一线培美曲塞联合铂类化疗预测因子之一,该研究结果与本研究的结果是一致的。吴毓优等[11]研究TS rs34743033 及rs34489327 与培美曲塞治疗海南黎族肺腺癌患者疗效与预后的相关性。TS 基因5′端非编码区rs34743033 多态性位点3R∕3R、2R∕3R、2R∕2R 基因型在肺腺癌患者所占的比例分别为67. 3% 、17.3%和15.4%。TS 基因多态性可能与培美曲赛治疗海南黎族肺腺癌的疗效和预后无关。
ARÉVALO 等[12]研究TS 基因多态性3R∕3R 基因型患者未达到中位OS,而2R∕3R 基因型患者中位PS 为70 个月;3R∕4R 和2R∕2R 基因型中位OS 分别为15 和13 个月(P=0.019)。HIDETAKA URAMOTO 等[13]研究非鳞状非小细胞肺癌细胞中的TS、DHFR 和GARFT 表达与培美曲塞治疗的关系,应用实时PCR 和免疫组织化学(IHC)染色分析原发性肿瘤TS∕DHFR mRNA 和蛋白表达。发现TS、DHFR、GARFT mRNA 的表达水平与NSCLC 的临床反应之间无显著相关性。
LI 等[14]分析了TS 基因启动子增强子区域的遗传多态性。“低表达”基因多态性(2R ∕2R,2R ∕3C 或3C∕3C)中位PFS 较“高表达”基因多态性(2R∕3G,3C∕3G 或3G∕3G)PFS 延长(6.8 个月vs.3.8 个月,P=0.036)。但没有观察到OS 的差异(10.3 个月vs. 10.1 个月,P=0.638)。最近,NICOLSON等[15]已经证实了TS 表达水平和培美曲塞疗效之间的相关性。这项单臂2 期临床试验晚期非鳞NSCLC 患者接受诱导培美曲塞联合顺铂化疗,随后在非进展期予培美曲塞维持治疗。低表达组中位PFS为7.1个月,高表达组为2.6个月(P=0.001 5)。P值分别为0.09 和0.05。本研究显示,TS 基因多态性以3R∕3R 型为主;2R∕2R+2R∕3R 型DCR 高于3R∕3R 型,差异有统计学意义,但培美曲塞联合铂类化疗PFS 分别为9.3 和10.4 个月(P>0.05),差异无统计学意义。
MTHFR 是叶酸代谢过程的关键酶[16],MTHFR 在肺癌领域的相关研究较少,LAN 等[17]研究MTHFR 基因C677T 多态性非鳞非小细胞肺癌患者41.2%携带C∕C 型。C∕T 杂合子51 例非小细胞肺癌患者中,21 例(41.2%)携带C∕C。携带T∕T 野生型20 例(39.2%),携带C∕T 杂合子,基因型占19.6%;MTHFR 基因C677T 多态性与培美曲塞化疗疗效差异无统计学意义(P>0.05)。赵蕴伟等[18]研究晚期肺腺癌患者MTHFR 基因C677T 野生型(C∕C)的分布为61.4%,纯合突变型(T∕T)为13.6%,杂合突变型(C∕T)为25. 0%。C∕C 型患者的TTP 显著长于T∕T 型患者和C∕T 型患者。野生型(C∕C)NSCLC 患者可能是使用培美曲塞联合顺铂化疗的有效人群。
本研究显示,MTHFR 基因多态性C∕C 型、C∕T型、T∕T 型分别为40%、52%和8%;MTHFR 基因多态性与培美曲塞联合铂类治疗晚期肺腺癌DCR、PFS 未发现相关性。本研究结果与国内研究基本吻合,与国外研究存在差异。这也体现出恶性肿瘤是多基因的疾病,肿瘤分期不同治疗选择亦不同,多种因素均影响着肿瘤发生、发展、疗效及预后,临床工作需权衡利弊,有效治疗。
