血小板与淋巴细胞比值在表皮生长因子受体突变型非小细胞肺癌靶向治疗疗效与预后评价中的价值
2019-03-08江冠铭刘克军谭钦全曾溢蕻袁海姬林顺欢
江冠铭 刘克军 谭钦全 曾溢蕻 袁海姬 林顺欢
东莞市人民医院肿瘤内科(广东东莞523029)
随着对肺癌驱动基因研究的深入,研究[1]发现表皮生长因子受体(epidermalgrowth factor receptor,EGFR)与非小细胞肺癌(non-small cell lung cancer,NSCLC)关系密切,肺腺癌患者EGFR 突变率高达52%,鳞癌患者突变率约为1%~15%。现有的多种指南推荐EGFR-酪氨酸激酶抑制剂(EGFR tyrosinekinase inhibitors,EGFR-TKIs)治疗晚期NSCLC 的范围涵盖一线、二线和三线治疗甚至维持治疗[2],但EGFR-TKIs 耐药问题影响了治疗效果,且其耐药机制尚不明确,因此寻找能早期预测其疗效与预后的评价指标具有积极的临床意义。越来越多的证据[4]表明,外周血血小板与淋巴细胞比值[3](platelet-to-lymphocyte ratio,PLR)与胃癌、结直肠癌、卵巢癌等患者的预后具有明显的相关性。目前关于PLR 在NSCLC 中的研究结论尚不一致,为进一步阐释PLR 在NSCLC 中的作用,本文探讨了PLR 在EGFR 突变型NSCLC 靶向治疗疗效与预后评价中的价值,本课题在具有较高的创新性,可以为NSCLC 的靶向诊疗提供参考,现报告如下。
1 资料与方法
1.1 一般资料 2015年9月至2016年4月在东莞市人民医院肿瘤内科选取符合条件的受试者90例。纳入标准:(1)经病理学确诊的晚期(ⅢB、Ⅳ期)非鳞、NSCLC 患者;(2)具有可测量病灶(肿瘤病灶CT 扫描长径≥10 mm,淋巴结病灶CT 扫描短径≥15 mm,扫描层厚不大于5 mm),可测量病灶未接受过放疗、冷冻等局部治疗;(3)经基因检测,证实为EGFR 突变型,且拟接受一线分子靶向治疗;(4)体力状况(ECOG)评分0~2 分;(5)年龄18~75 岁;(6)预计生存期≥3 个月;(7)受试者自愿加入本研究,并签署知情同意书,依从性好,配合随访。排除标准:(1)活动性的脑转移、癌性脑膜炎、脊髓压迫患者,或筛选时影像学CT 或MRI发现脑或软脑膜的疾病;(2)具有明显影响口服药物吸收的因素,如无法吞咽、慢性腹泻和肠梗阻等;(3)曾接受抗肿瘤治疗;(4)已经证实的ALK、ROS1 基因异常(发生基因融合或突变);(5)既往或同时患有其他未治愈的恶性肿瘤(已治愈的皮肤基底细胞癌、宫颈原位癌和浅表性膀胱癌除外);(6)研究者判断其他可能影响临床研究进行及结果判定的情况。剔除∕中止∕脱落标准:(1)退出研究或失访;(2)未遵既定方案诊疗;(3)资料不全影响观察指标评价。本研究获得医院伦理委员会审议批准。
1.2 方法
1.2.1 外周血细胞计数和PLR 的计算 于靶向治疗前,在清晨空腹状态下抽取患者肘静脉血3 mL,应用SYSMEX-ME2100 血细胞分析仪(希森美康医用电子上海有限公司),进行淋巴细胞计数、血小板计数,通过血小板与淋巴细胞计数比值计算出PLR。试剂为仪器原装配套试剂。
1.2.2 受试者分组 根据靶向治疗前患者外周血PLR 水平,统计数据得到PLR 中位数,以PLR 中位数作为截点进行分组,其中PLR 作中位数者归入A 组(低PLR 组),PLR>中位数者归入B 组(高PLR 组)。
1.2.3 靶向治疗 给予患者一线EGFR-TKIs 治疗,药物选用吉非替尼250 mg,每天1 次或厄洛替尼150 mg,每天1 次或埃克替尼150 mg,每天3 次。
1.3 观察指标及评价标准
1.3.1 一般资料与临床病理指标 记录患者的性别、年龄、既往吸烟史等一般资料,以及肿瘤部位、组织分化、TNM 分期等临床病理指标,对外周血PLR 与NSCLC 患者临床病理特征的关系进行单因素分析。
1.3.2 疗效评价 参照RECIST《可测量病灶疗效评价标准》评价近期疗效。(1)阳性病灶全部消失,并维持4 周以上,为完全缓解(CR);(2)最大长径缩小30%以上,并维持4 周以上,为部分缓解(PR);(3)增加30%以上(多个靶病变最大径之和增加20%以上)为进展(PD);(4)介于PR 和PD 之间为疾病稳定(SD)。客观缓解率(ORR)包括至少相隔4 周确认的CR 和PR,疾病控制率(DCR)包括CR、PR 和初次服用药物至少6 周后的SD 者。
1.3.3 无进展生存期(PFS)与总生存期(OS) 患者出院后,每3 个月进行1 次随访,随访方式包括门诊复查、电话随访。随访至靶向治疗后满2年或疾病进展、患者死亡。PFS 指从诊断日期到影像学提示疾病进展或因任何原因死亡的时间间隔(以发生在先的事件计算)。OS 指从诊断日期到因任何原因死亡的时间。
1.4 统计学方法 采用SPSS 21.0 统计软件进行数据分析,计数资料及率的比较用χ2检验,采用Kaplan-Meier 法绘制生存曲线,组间比较采用Logrank 检验。检验水准α = 0.05,P<0.05 为差异有统计学意义。
2 结果
2.1 PLR 与临床病理特征的关系 靶向治疗前,90 例受试者外周血PLR 为45.39~273.50,PLR 中位数为139,A 组(低PLR 组,PLR ≤139)44 例,B组(高PLR 组,PLR>139)46 例。对外周血PLR 与NSCLC 患者临床病理特征的关系进行单因素分析,结果显示:A 组与B 组在是否吸烟(P=0.019)、肿瘤部位(P= 0.022)、组织分化(P= 0.036)、T 分期(P= 0.002)、临床分期(P= 0.031)方面的比较,差异有统计学意义(P<0.05),而在性别、年龄、N分期方面的比较,差异均无统计学意义(P<0.05),见表1。
2.2 客观疗效、ORR 及DCR A 组、B 组均无CR患者,A 组PR、ORR、DCR 率均高于B 组(χ2PR、ORR=4.590,P= 0.043;χ2DCR= 5.441,P= 0.036),PD 率低于B组(χ2= 4.590,P= 0.043);而两组在SD 率方面比较,差异无统计学意义(χ2= 0.052、P=9.102),见表2。
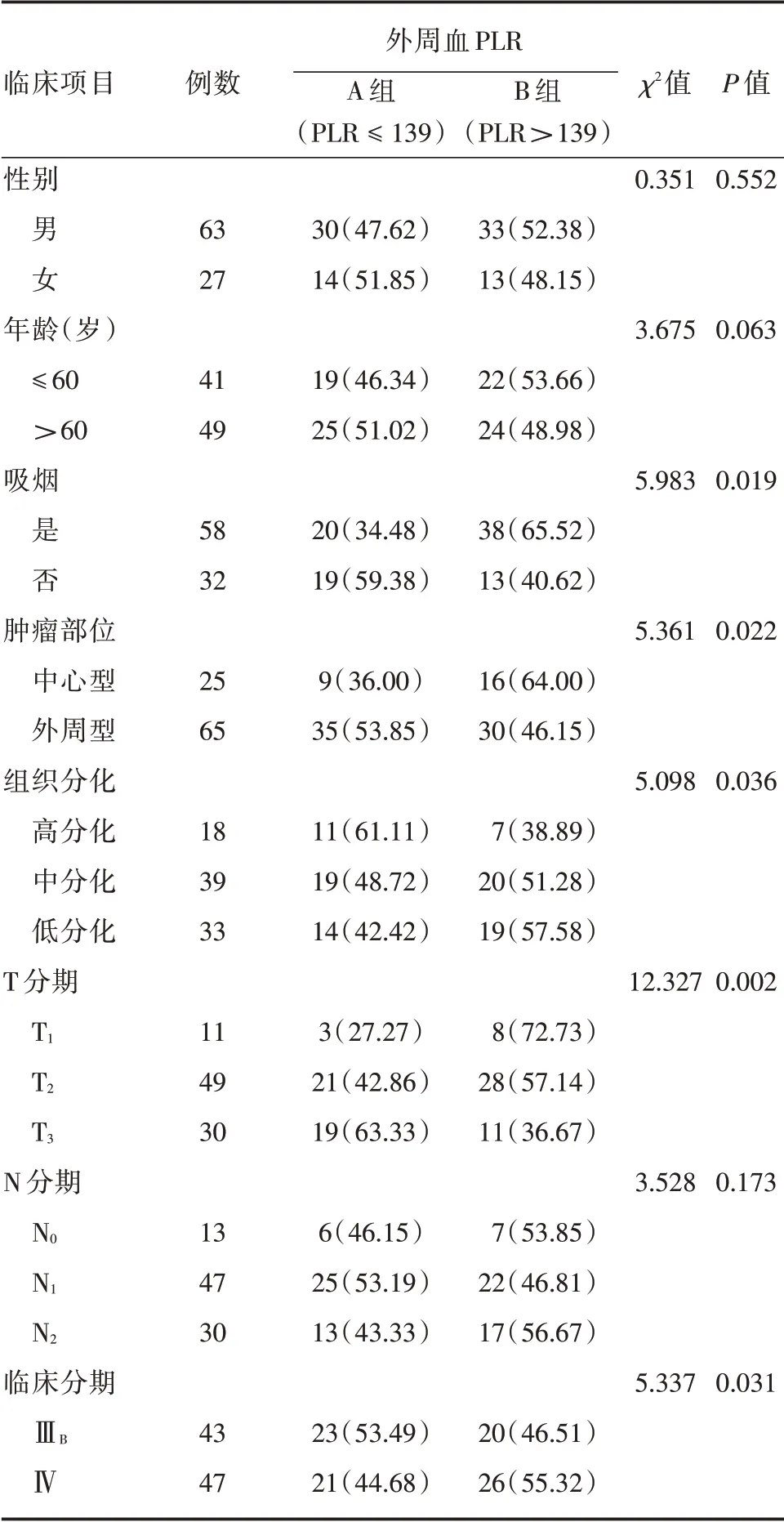
表1 靶向治疗前外周血PLR 与NSCLC 患者临床病理特征的相关性Tab.1 Relationship between PLR and clinicopathological features before EGFR-TKIs 例(%)

表2 A、B 组客观疗效、ORR 及DCR 比较Tab.2 Comparision on Objective efficacy,ORR and DCR between two groups 例(%)
2.3 生存情况 末次随访时间截至2018年4月30日,A 组44 例患者均获随访,随访率100%,随访时间为4~24 个月,中位随访时间为14 个月,16 例患者数据截尾,其中15 例患者到截点时仍健在,1 例患者因突发脑出血死亡;中位OS 为8.5个月(95%CI:5.2~24 个月),中位PFS 为7.4 个月(95%CI:4.6~24 个月)。B 组46 例患者中,43 例获得随访,随访率93.48%,随访时间为2~24 个月,中位随访时间为10 个月,11 例患者数据截尾,其中9 例患者到截点时仍健在,2 例患者因肺部感染、心功能衰竭死亡;中位OS 为6.3 个月(95%CI:3.8~24 个月),中位PFS 为4.5 个月(95%CI:3.3~24 个月);经Log-Rank 检验,A 组中位OS、中位PFS 均长于B 组,差异有统计学意义(P =0.001)。
3 讨论
美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)临床实践指南以及我国的肺癌诊疗指南推荐,对于检测证实的EGFR 突变患者,可采用分子靶向药物治疗,能明显延迟EGFR 突变阳性NSCLC 患者的疾病进展,如延长中位PFS 至7~10 个月[5-6]。然而,在临床实践中,部分接受靶向治疗的晚期NSCLC 患者的疗效不甚理想,甚至中位PFS 只有1~2 个月。通过检测患者的EGFR 基因,并未发现基因20 号外显子发生插入突变,即不存在原发性耐药,具体机制尚待阐明。
病理学研究表明[7],恶性肿瘤的发生、发展与多种内外因素密切相关。有研究表明[7]肿瘤微环境的炎症、免疫和癌症之间关系密切,炎症反应在肿瘤发生、进展及预后的作为成为研究的热点,如关于PLR 的研究。在肿瘤发生发展的内环境中,病灶内浸润的淋巴细胞与肿瘤细胞互相作用,在肿瘤微环境中发挥着影响肿瘤生长、增殖的作用,炎症恶性转化是多种细胞、基因、非编码RNA 等要素共同参与且形成动态网络的生物学过程。肿瘤免疫编辑学说[9](cancer immunoediting)认为,炎性反应的各个阶段均有助于肿瘤的产生,同时肿瘤的发生及发展又可促进血液中的炎性细胞数目发生相应改变。PLR 在一定程度上反映着体内的炎症水平,PLR 升高反映了血小板计数的相对增加或淋巴细胞计数的相对减小,均可影响肿瘤患者的预后。恶性肿瘤常合并血小板增高,血小板分泌血小板源性生长因子(PDGF)、血管内皮生长因子(VEGF)、凝血酶敏感蛋白-1 等一些生长因子,这些生长因子能刺激肿瘤细胞的增殖、与其他细胞的黏附,进而促使肿瘤的生长、转移[10-11]。一些促炎症反应细胞因子(如IL-1、IL-6)可促使巨核细胞增殖,进一步导致血小板增多。高血小板血症被认为是影响许多肿瘤预后的重要指标。与此同时,血小板聚集、脱颗粒过程中伴随释放于肿瘤微血管中的血小板源性促血管生成介质也可能是促进肿瘤生长的重要决定因素。另一方面,淋巴细胞在抑制肿瘤发展的免疫监视中发挥着重要的作用。淋巴细胞可特异性识别而通过直接或间接途径激活抗肿瘤免疫,淋巴细胞的减少为肿瘤浸润转移提供了有利环境。STOTZ 等[12]发现PLR 是影响术后胃肠道间质瘤患者复发和生存的独立预测因素。新近文献[13]表明,PLR 作为反应机体炎症反应程度和免疫状态的指标已证实和多种肿瘤预后相关,如PLR 对胃癌、乳腺癌、结肠癌等均具有一定的独立预后预测的作用。在肺癌方面,TODA 等[14]研究发现PLR 是NSCLC 患者化疗预后的独立预测因素,高PLR 提示患者预后不佳;而对于EGFR 突变型的晚期NSCLC,截至目前国内外尚未见到类似的文献报道。
本研究分析了EGFR 突变型NSCLC 患者不同PLR 与临床病理特征之间的相关性,并进行了单因素分析,分析了高低PLR 组间患者的疗效与生存情况,结果显示,低PLR 患者在客观疗效与生存方面更具优势,PLR 可作为其独立的预后因素。这也充分说明系统性炎症反应和机体的免疫系统在NSCLC 患者的预后中扮演重要角色。再结合吸烟既往史、病理学资料、临床分期等,PLR 能够更好地判断预后。由于PLR 为绝对值计数,稳定性更高,不易受其他因素的影响,更能反映体内的炎性反应状态,因此在临床应用中更为便捷、实用。本研究数据仅来源于单一中心,这是本研究的不足之处,在下一步的研究中如开展多中心的研究则更具有说服力。
综上所述,PLR 在EGFR 突变型NSCLC 靶向治疗疗效与预后评价中具有一定的参考价值,低PLR 的EGFR 突变型NSCLC 患者经靶向治疗后具有更高的疗效和更长的存活期,是独立的预后评估因素,可用于肿瘤科医师进一步优化诊疗策略。但是,本研究样本量相对较少,且样本选择可能存在一定的偏倚,还需要多中心、大样本的临床研究进一步验证。
