CD28-T细胞亚群在多发性硬化患者外周血中的变化及临床意义
2019-02-11蒋觉安刘翠平薛群方琪俞立强张陆陆蒋建华
蒋觉安 刘翠平 薛群 方琪 俞立强 张陆陆 蒋建华
多发性硬化(multiple sclerosis,MS)是中枢神经系统最常见的炎症性脱髓鞘疾病,T淋巴细胞功能异常在其免疫病理进程中发挥重要的作用,导致疾病反复发作和进行性神经功能缺损[1]。
CD28是表达于T淋巴细胞表面的共刺激分子,与抗原提呈细胞上的CD80/CD86相互结合产生第二信号调控T细胞的活化[2]。近年来缺失CD28(CD28-)的T淋巴细胞由于其独特的生物学特点,受到广泛的关注。其中CD4+CD28-T细胞在自身免疫性疾病中被视作记忆性的自身反应性T细胞[3],而CD8+CD28-T细胞则表现出细胞毒性或免疫抑制等不同的生物学特点[4]。CD45RA和CD45RO是鉴定初始性和记忆性T细胞的主要免疫标记[5],CD25可反映T细胞近期的活化情况[6]。在目前MS的研究中,CD4+CD28-和CD8+CD28-T细胞的临床意义尚未完全阐明,两者之中究竟何种细胞具有记忆性T细胞的特性亟待进一步揭示。
为深入研究CD28-T淋巴细胞在MS疾病进程中的变化,本研究采用流式细胞技术检测MS患者外周血CD4+CD28-和CD8+CD28-T细胞亚群的数量以及表面CD25、CD45RA和CD45RO的表达,揭示CD28-T淋巴细胞亚群的免疫表型特点及其在MS中的临床意义。
1 对象和方法
1.1 观察对象选择苏州大学附属第一医院神经内科2013年6月至2018年10月收治的37例MS患者(MS组)。患者均符合2017年McDonald诊断标准[7]。并排除:(1)半年内接受糖皮质激素(下文简称“激素”)和疾病修正治疗(包括环磷酰胺等免疫抑制剂、干扰素-β和那他珠单抗等);(2)合并其他免疫性疾病:如系统性红斑狼疮、类风湿性关节炎等自身免疫性疾病和肿瘤等;(3)合并颅内外感染,如脑膜脑炎;(4)脑卒中等。患者中男11例、女26例,年龄(39.65±14.40)岁。病程2~240个月,中位病程(上、下四分位数)为38.0(9.5,80.0)个月。扩展残疾状况评分量表(Expanded Disability Status Scale,EDSS)[8]评分为(3.77±2.00)分。临床分型:3例是首次起病,34例为复发缓解型,无进展型;临床分期:复发期23例,缓解期14例。
同时选择33名健康志愿者作为对照组,均不伴有自身免疫性疾病、肿瘤和过敏性疾病史,近期无感染性疾病,半年之内未曾使用过激素和免疫调节药物,其中男10名、女23名;年龄(40.03±11.54)岁。对照组与MS组成员年龄、性别构成差异无统计学意义(P>0.05)。本研究经苏州大学附属第一医院伦理委员会批准,所有成员均签署知情同意书。
1.2 方法
1.2.1主要试剂及实验仪器:FITC标记的小鼠抗人CD4、CD8抗体,PE标记的小鼠抗人CD25、CD45RA和CD45RO抗体,以及红细胞裂解液、流式细胞仪、温控离心机(BECKMAN);PE-Cy5标记的小鼠抗人CD28抗体,FITC、PE-Cy5和PE标记的小鼠IgG(BD Biosciences)。
1.2.2流式细胞检测:复发期患者接受甲泼尼龙静脉滴注治疗,在其中随机抽取7例检测CD28-T细胞亚群的变化。治疗方案:甲泼尼龙500 mg/d,静滴4 d后调整剂量为80 mg/d,静滴7 d。
MS组于入院第2 天清晨、对照组于体格检查时空腹采集肘静脉血2 mL/人,置乙二胺四乙酸(EDTA)抗凝管中。复发期患者于入院第2天和治疗第12天清晨空腹采集肘静脉血各2 mL/人,置EDTA抗凝管中。
设立以下检测管,取全血50 μL/管用于流式细胞检测:(1)CD4/CD28双色荧光检测管(1管):同时加入FITC标记的小鼠抗人CD4和PE-Cy5标记的小鼠抗人CD28抗体各4 μL/管;(2)CD8/CD28双色荧光检测管(1管):同时加入FITC标记的小鼠抗人CD8和PE-Cy5标记的小鼠抗人CD28抗体各4 μL/管;(3)CD4/CD28/(CD25、CD45RA或CD45RO)三色荧光检测管(共3管):同时加入FITC标记的小鼠抗人CD4、PE-Cy5标记的小鼠抗人CD28和PE标记的小鼠抗人CD25(或CD45RA或CD45RO)抗体各4 μL/管;(4)CD8/CD28/(CD25或CD45RA或CD45RO)三色荧光检测管(共3管):同时加入FITC标记的小鼠抗人CD8、PE-Cy5标记的小鼠抗人CD28和PE标记的小鼠抗人CD25(或CD45RA或CD45RO)抗体各4 μL/管。同时设立同型对照管,另取全血50 μL/管用于流式细胞检测:(1)双色荧光同型对照管(1管):同时加入FITC和PE-Cy5标记的小鼠IgG各4 μL/管;(2)三色荧光同型对照管(1管):同时加入FITC、PE-Cy5和PE标记的小鼠IgG各4 μL/管。各管加入抗体或小鼠IgG后室温避光孵育20 min,再加入红细胞裂解液250 μL/管,40℃水浴10 min后加入磷酸盐缓冲液4 mL/管终止红细胞裂解反应,于离心半径10 cm、1600 r/min离心5 min。弃上清后在细胞沉淀中加入磷酸盐缓冲液500 μL/管,轻微震荡后制成细胞悬液,上机进行流式细胞检测。各检测管和同型对照管以前向角和侧向角设门,选择淋巴细胞群,去除单核细胞、粒细胞和细胞碎片,每管获取30×103个淋巴细胞。以相应双色荧光同型对照管去除背景荧光,在双色荧光检测管中,圈出CD4+或者CD8+T细胞,然后在该群细胞中圈出CD28-T细胞,由流式细胞仪自动计算CD4+CD28-或CD8+CD28-T细胞百分比。同样以相应三色荧光同型对照管去除背景荧光,在三色荧光检测管中,圈出CD4+CD28-和CD4+CD28+以及CD8+CD28-和CD8+CD28+T细胞,由流式细胞仪检测和自动计算各T细胞亚群中CD25+或CD45RA+或CD45RO+细胞的百分比。按阳性细胞百分比中位数判定表达强弱,标准为:高表达(high):百分比>66.6%,中等表达(medium):33.3%<百分比≤66.6%,低表达(low):10.0%<百分比≤33.3%;弱表达(weak):2.0%<百分比≤10.0%;阴性表达(negtive):百分比≤2.0%。
比较分析MS患者外周血CD28-T细胞亚群的变化情况,MS患者外周血CD28-T细胞亚群表面CD25、CD45RA和CD45RO的表达情况,以及MS患者不同疾病分期及激素治疗前后CD28-T细胞亚群变化情况,并分析CD28-T细胞亚群变化与MS患者神经功能缺损(EDSS评分)及年龄的相关性。
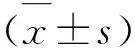
2 结果
2.1 MS患者外周血CD28-T细胞亚群变化与对照组比较,MS患者外周血CD4+CD28-T细胞数量明显升高(P=0.000),CD8+CD28-T细胞数量明显下降(P=0.001)。结果见表1、图1A。

表1 MS组与对照组外周血CD28- T细胞亚群表达比较
注:MS:多发性硬化,图1、表2-4同
2.2 MS患者外周血CD28-T细胞亚群表面CD25、CD45RA和CD45RO的表达CD25仅在CD4+CD28+T细胞表面呈弱表达,但明显高于CD4+CD28-T细胞(P=0.000);在CD8+CD28+和CD8+CD28-T细胞之间比较,CD25均为阴性表达,两者间差异无统计学意义(P=0.185)。CD45RA在CD4+CD28-T细胞表面低表达,与CD4+CD28+T细胞比较明显降低(P=0.000);在CD8+CD28+和CD8+CD28-T细胞表面CD45RA均为中等表达,两者间差异无统计学意义(P=0.270)。CD45RO在CD4+CD28-T细胞表面高表达,与CD4+CD28+T细胞比较明显升高(P=0.000);在CD8+CD28-T细胞CD45RO弱表达,与CD8+CD28+T细胞比较明显降低(P=0.000)。结果见图1B、表2。
2.3 MS患者不同疾病分期及激素治疗前后CD28-T细胞亚群变化与缓解期患者和对照组比较,复发期患者CD4+CD28-T细胞数量均明显升高(P=0.002,P=0.000);CD8+CD28-T细胞数量均明显降低(分别P=0.012、P=0.000);缓解期患者CD4+CD28-和CD8+CD28-T细胞数量和对照组比较差异无统计学意义(分别P=0.365、P=0.307);结果见表3。复发期MS患者甲泼尼龙治疗后CD4+CD28-T细胞数量与治疗前比较差异无统计学意义(P=0.128);而CD8+CD28-T细胞数量在治疗后明显升高(P=0.028);结果见表4。
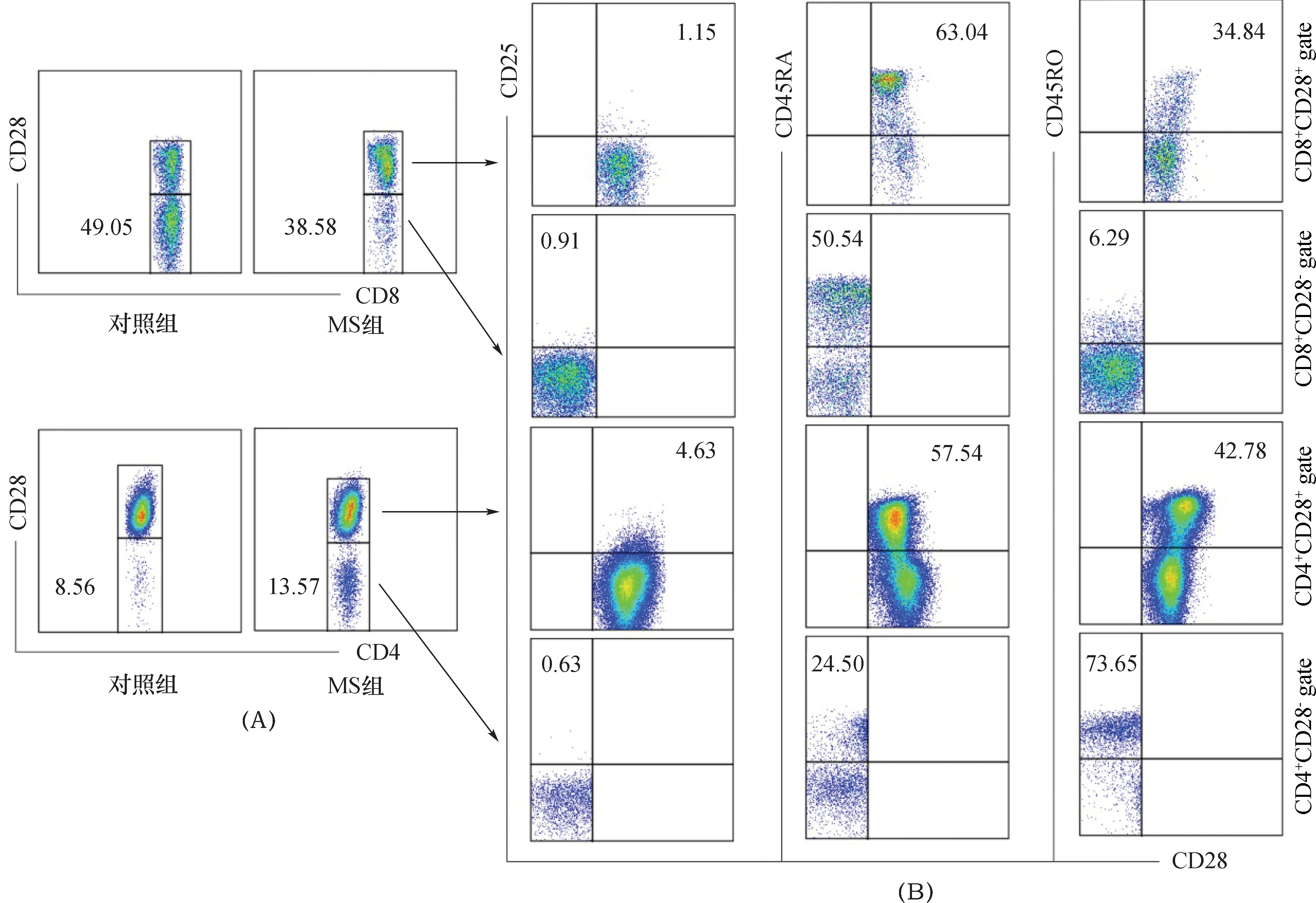
注:A:CD28- T细胞亚群;B:MS患者T细胞亚群CD25、CD45RA和CD45RO的表达;图中数值为阳性细胞百分比中位数 图1 外周血CD28- T细胞亚群的变化及其表面CD25、CD45RA和CD45RO表达的流式细胞仪检测图
表2MS患者外周血T细胞亚群CD25、CD45RA和CD45RO的表达〔n=9,M(QL,QU),%〕

T细胞亚群CD25CD45 RACD45 ROCD4+CD28+组4.63(3.50,6.18)57.54(43.59,70.01)42.78(30.46,49.59)CD4+CD28-组0.63(0.47,0.90)24.50(20.12,31.04)73.65(66.36,80.84)Z值-3.576 -3.488-3.576P值0.0000.0000.000T细胞亚群CD25CD45 RACD45 ROCD8+CD28+组1.15(0.89,1.41)63.04(49.20,72.80)34.84(27.79,41.97)CD8+CD28-组0.91(0.66,1.18)50.54(40.10,66.71)6.29(4.86,8.94)Z值-1.325-1.104-3.576P值0.1850.2700.000

表3 MS组复发期和缓解期外周血CD28- T细胞亚群的比较
注:与对照组比较,*P< 0.05;与MS组缓解期比较,△P<0.05
2.4 CD28-T细胞亚群变化与MS患者神经功能缺损及年龄的相关性MS患者EDSS评分与CD4+CD28-T细胞数量呈正相关(r=0.621,P=0.000),与CD8+CD28-T细胞数量呈负相关(r=-0.364,P=0.027);MS患者年龄与CD4+CD28-T细胞数量呈正相关(r=0.386,P=0.018),与CD8+CD28-T细胞数量无相关性(r=0.120,P=0.479)。

表4 MS患者甲泼尼龙治疗前后外周血CD28- T细胞亚群的变化〔n=7,M(QL,QU)〕
注:EDSS:扩展残疾状况评分量表
3 讨论
研究显示,记忆性CD4+T细胞的活化并不依赖CD28的参与[3]。本次研究发现MS患者外周血中同样也存在异常升高的CD4+CD28-T细胞亚群,与Broux等的研究结果一致[9],进一步印证了该T细胞亚群在MS中作为记忆性T细胞的论断。虽然CD8+T细胞在缺失CD28后的生物学特性具有不确定性[4],但类似于Mikulkova等[10]的发现[9]。本研究中MS患者CD8+CD28-T细胞数量下降,提示其在MS中可能是作为具有抑制功能的调节性T细胞(regulatory T cells,Treg)而存在的。记忆性T细胞和Treg是维持免疫稳态的主要组成部分,本研究以CD28分子为切入点,分析两者的数量变化,期望有助于更全面的深入研究MS的免疫病理机制。
CD45RA、CD45RO和CD25是区分初始和记忆性T细胞以及T细胞近期活化的重要标记分子[5-6],为进一步确定CD28-T细胞亚群的免疫表型,本研究通过三色荧光标记测定T细胞亚群上这三个分子的表达。结果显示CD4+CD28-T细胞表现为CD45ROhighCD45RAlow的免疫表型,证实该T淋巴细胞具有记忆性T细胞的特征。而与之相应的CD4+CD28+T细胞表面CD45RA和CD45RO皆为中等水平表达,因此该T细胞亚群由初始和记忆性T细胞共同构成。同时CD25仅在CD4+CD28+T细胞表面检测到,说明该T细胞亚群具有近期活化的特性。由此推测,CD4+CD28+初始性T细胞初次接触自身抗原,以CD28依赖的方式活化,部分分化成CD45RO+记忆性T细胞,少部分保留CD25+近期活化的特征。随着患者年龄的增长,CD4+CD28+CD45RO+T细胞反复接触自身抗原,逐渐丢失CD28形成CD4+CD28-记忆性T细胞。长期存活的CD4+CD28-记忆性T细胞随年龄增长数量逐渐增多,因而与MS患者的年龄呈正相关,与既往的研究结果一致[11]。比较CD8+CD28-和CD8+CD28+T细胞亚群发现,CD45RA+初始性T细胞在两个亚群中所占的比例相当,而CD8+CD28-T细胞亚群中CD45RO+记忆性T细胞数量明显减少,CD45RO-T细胞数量明显增多。有研究显示CD45RO也是Treg的重要标记分子,CD45RO表达上调可以削弱其免疫调节功能,而表达下调则增强Treg的免疫抑制效应[12]。由此推断在CD8+CD28+初始T细胞初次活化后部分形成记忆性T细胞,而在丢失CD28的过程中,并未保留原有的记忆性T细胞的特征,随之产生的CD8+CD28-T细胞亚群CD45RO表达下调,提示这群细胞可能是Treg。CD8+CD28-T细胞亚群并不具有记忆性T细胞的免疫表型,无长期存活的生物学特性,在本研究中其不随患者年龄增长而增多,符合其生物学特性,与Mikulkova等[9]的研究结果一致。
在MS的临床特征中,复发是评估MS疾病进程的主要临床参数之一,记忆性T细胞和Treg功能和数量异常是MS复发的重要原因[13]。长期存活的记忆性T细胞在病程中反复接触自身抗原导致异常活化,从而引起疾病复发。因此,在本研究中CD4+CD28-T细胞数量在复发期患者中明显升高,而随着疾病的缓解,记忆性T细胞的数量下降接近至健康对照水平。因此,CD4+CD28-T细胞的异常升高对于预测MS的复发具有一定的临床意义。在免疫调节中,CD8+Treg的数量和功能下调是评估自身免疫性疾病严重程度的重要指标[14],同时Treg和效应性T细胞的失衡可能导致MS的复发和病情进展[15]。由于CD8+CD28-T细胞并不具有长期存活的特性,其数量减少后不能对CD4+CD28-记忆性T细胞形成长期有效的免疫调控。本研究中CD8+CD28-T细胞数量随着疾病的复发明显减少,提示其在MS免疫病理进程中的负性调控作用被削弱,与其生物学特性相符。EDSS是反映MS疾病严重程度的重要临床指标,记忆性T细胞增多和Treg减少可以导致疾病的复发,加重神经功能缺损[13]。因此,在本研究中CD4+CD28-和CD8+CD28-T细胞的数量分别与患者EDSS呈现不同的相关性,借此有助于病情轻重及预后的评估。激素是治疗MS急性复发最常用的药物,研究表明激素可以下调CD28的表达以及恢复CD8+Treg的数量和功能,从而降低自身免疫性疾病的活动度[14]。然而在本研究中MS患者CD4+CD28-T细胞数量在激素治疗后未发生明显的变化,可能与记忆性T细胞对激素反应的差异性有关[16]。由于CD4+CD28-T细胞可能是MS复发的根源之一,因此也进一步提示延长激素用药并不能减少MS患者的复发,激素在MS急性复发期的治疗作用可能是通过升高CD8+CD28-Treg的数量而实现的。由于在MS病程中CD8+CD28-T细胞亚群并无长期存活的特性,不能形成长期的免疫调控作用,也间接提示糖皮质激素治疗提高Treg的数量无法有效减少疾病的复发。目前MS患者减少复发的有效措施是缓解期的疾病修正治疗,其机制与调控T细胞的活化有关[17],深入探讨干预措施对CD4+CD28-记忆性T细胞的影响可能为MS的临床研究提供新的线索。
综上所述,MS患者外周血中存在异常变化的CD4+CD28-和CD8+CD28-T细胞亚群,具有不同的免疫表型,与患者的复发、治疗和神经功能缺损有关,提示CD28-T细胞亚群失衡可能在MS的免疫病理进程中有一定的作用,确切情况需要进一步深入研究证实。
