癫痫患者皮质兴奋性评价指标的研究进展
2019-02-11王兰朱海芳刘春晖彭淑孙妍萍
王兰 朱海芳 刘春晖 彭淑 孙妍萍
癫痫作为一种以中枢神经系统突然、反复和短暂的功能失常为特征的慢性脑部疾患,其发病率位居神经系统疾病的第二位,发病机制非常复杂。国内外的学者采用各种方法进行了大量研究,但尚未有统一的观点[1]。目前普遍认为脑兴奋和抑制失衡引起的皮质兴奋性(cortical excitability,CE)增加在癫痫的病理生理过程中起着重要作用[2]。CE的变化不仅仅对癫痫的诊断有提示作用,还可以通过对癫痫患者CE的动态监测来评估抗癫痫药物或者手术治疗的有效性及预后[3]。
1 CE的病理生理机制
CE取决于神经元静息膜电位与阈值之间的差值,其静息电位通过离子通道对膜内外离子浓度的调节作用保持相对稳定。影响CE的离子主要是K+、Na+、Ca2+、 H+、Mg2+、 Cl-和 HCO3-。离子通道是神经细胞兴奋的基础,通过电-化学信号的转换参与兴奋的传布。递质作为神经元兴奋性传递过程中的化学信号参与CE调节,目前已知影响CE的主要抑制性递质是γ-氨基丁酸(GABA),兴奋性递质是谷氨酸[4]。当神经细胞膜去极化时,Ca2+内流到细胞内引起神经递质释放,作用于其他神经元和其他离子通道,进而产生级联反应,引起相应的生理生化改变,产生复杂的相互作用。
2 用于CE评价的指标及其特点
限于技术的发展,CE尚不能在活体水平进行直接检测。当前研究均通过运动阈值(motor threshold,MT)、运动诱发电位(motor evoked potential,MEP)、皮质静息期(cortical silent period,CSP)、短间隔皮质内抑制(short-interval intracortical inhibition,SICI)、长间隔皮质内抑制(long-interval intracortical inhibition,LICI)、皮质内易化(intracortical facilitation,IFC)等测量值间接进行CE的评价。现将相关指标的测量方法及与其对CE的评估,总结为表1。
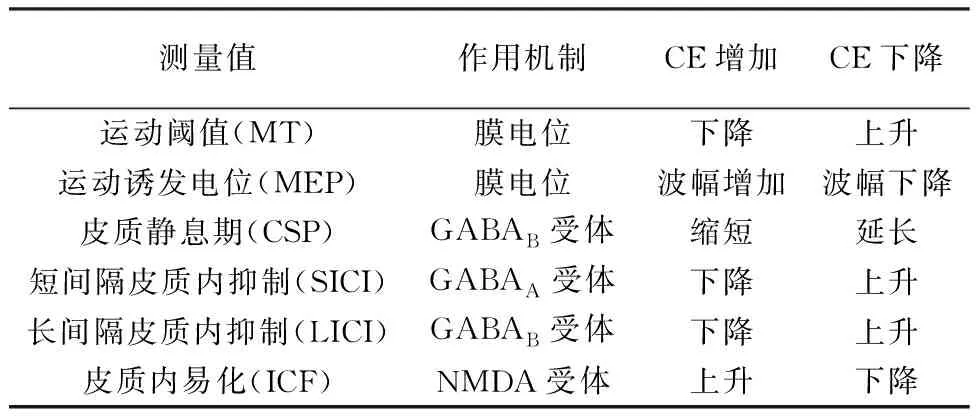
表1 不同测量指标及其对CE的反映
注:CE:皮质兴奋性;GABA:γ-氨基丁酸;NMDA:N-甲基-D-天冬氨酸
2.1 MTMT是指磁刺激运动皮质区,在相应靶肌收集到MEP后记录的刺激强度,通常以最大刺激强度的百分比表示。MT可分为静息运动阈值(resting motor threshold,RMT)和活动运动阈值(active motor threshold,AMT)。RMT指在靶肌放松的状态下给予不少于10次连续的刺激,过程中至少有50%的刺激诱发出波幅大于50 μV的MEP所需的最小刺激强度[5]。目前这种测量方式已得到公认。AMT则是在肌肉轻微的等长收缩时进行测定,被定义为在连续的刺激过程中至少有50%的刺激诱发出波幅不低于200 μV的MEP所需的最小刺激强度。通常情况下,RMT测量值比AMT要高,这源于脊髓的易化作用[6]。
MT被广泛用于CE的评价,是一种重复性好且可靠的CE评价指标。与AMT相比,RMT具有测量简单、重复性强的优点,这一特点源于RMT对神经元膜兴奋性的直接反映,排除神经递质的变化对测量值的影响。一项关于癫痫患者药物相关研究证实了这一论点,该研究发现,当受试者应用钠通道阻滞剂后Na+内流减少,RMT值明显升高,但不受苯二氮卓受体激动剂或抗谷氨酸药物的影响[7]。与之相应的是,能够影响神经元动作电位的因素同样会对MT的测定产生影响,如不同个体间的差异、神经元损伤及影响细胞膜及离子通道的药物因素等。
2.2 MEP当TMS以适当的刺激强度作用于运动皮质时,在对侧肢体靶肌表面记录到的电信号变化,其振幅和潜伏期均可反映CE的变化。MEP的振幅测量是从峰值到峰值的波幅变化,大小随着刺激强度的增加而增加,但当刺激强度较高时,多次刺激后所得的MEP振幅会变小,即刺激强度与MEP振幅间的关系呈“S”形曲线[8]。一般情况下,周围神经完整的情况下测得的MEP振幅及潜伏期可反映皮质脊髓束的完整性及运动皮质和脊髓前角α神经元的兴奋性。
MEP的振幅除与刺激强度有关外,还与激活的皮质运动神经元的数量、脊髓易化的神经元数量、单次刺激引发的多次神经元放电、运动神经元放电的同步性以及靶肌肉的收缩状态有关[9]。由于脊髓的易化作用,在肌肉收缩状态下测得的MEP振幅高于肌肉放松时的测定值。相比而言,MEP的潜伏期变化较小,但仍会受到诸多因素影响。靶肌的自主收缩会产生易化作用,使得测得的潜伏期缩短、振幅增加[5]。MEP影响因素繁杂,且个体间差异较大,针对其生理机制的研究近年来亦未获得进展。目前的研究仍停留在个体水平,尚未取得特定人群中的分布规律,期待未来大样本的研究数据能提供更多的信息。但有一点可以肯定,MEP作为评价皮质脊髓束完整性的基础指标在CE相关研究中仍可作为有力的辅助工具,其测量值的异常提示潜在的上运动神经元传导障碍。
2.3CSP当靶肌肉轻微收缩时肌电图可以检测到持续的肌电活动,此时于其相应皮质运动区给予单脉冲磁刺激诱发MEP波形,刺激后的一段时间内原本肌电活动中断,这段时间在刺激强度较高时可持续数百毫秒,称为CSP[10]。CSP的长度明显延长,并不能用神经元的不应期来解释。一些研究认为CSP可能是GABA介导的局部抑制性神经环路激活的结果。脊髓GABAA受体介导的抑制机制参与CSP前50~75 ms,后部分则被认为主要经延续时间较长的皮质GABAB受体调控[11]。CSP的持续时间体现皮质性抑制的强弱,测量值可随着刺激强度的增加而增大,呈S形曲线。
CSP体现皮质抑制性通路的整合,对许多神经系统疾病的诊治有着重要的提示意义,结合MRI等影像学检查更能够具体的提示病变部位及可能的影响。但CSP的测量依赖于受试者肌肉的主动收缩程度,在实际应用中,肌肉的主动收缩不可能完全一致,为测量结果带来更多的不确定性。
2.4 双脉冲磁刺激(paired-pulse transcranial magnetic stimulation,ppTMS)模式下的评价指标ppTMS每次配对输出两个脉冲,之间的间歇不等。间歇期(inter stimulus interval,ISI)可以自由调节。第一个刺激为条件刺激(conditioning stimulus,CS),第二个刺激为实验刺激(test stimulus,TS),在检测不同的指标时,CS、TS的强度以及ISI的长短各有不同。其结果均为相应靶肌上记录到的MEP振幅的改变,可以用CS与TS共同作用下的MEP振幅与单独TS产生的MEP振幅比值进行描述[10]。
ppTMS可以用来研究同侧皮质内或者双侧皮质间兴奋性易化现象和抑制现象[12],常用的测量值包括SICI、LICI及ICF。
2.4.1SICI和LICI:SICI测量时两个脉冲刺激同一部位,阈下的CS与阈上的TS配对先后出现,ISI较短,约为1~6 ms。而LICI的测量参数则为两个阈上刺激加上长约50~400 ms的ISI。SICI 由GABAA型受体介导,LICI 由 GABAB型受体介导,两者的变化均反映了脑皮质内抑制机制对CE的影响[13]。
2.4.2ICF:对ICF来说,同样是阈下的CS与阈上的TS配对先后出现,与SICI不同的是ISI约为6~30 ms,间隔较长。有研究显示,ICF是N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)受体介导谷氨酸能神经元的强易化作用与GABAA型受体介导的弱抑制作用综合之后的结果。
2.4.3相关特性:相对于sTMS对皮质及脊髓兴奋性的联合研究,ppTMS能够更有针对性的提示CE的改变,测量值也可以采用百分比的方式进行记录,便于不同研究间的相互比较。ppTMS模式下的测量值作为近年CE研究的热点,大量研究中均显示其具有重复性佳、特异度高及便于横向比较等优点,其不足在于测量要求较高且受神经递质水平的影响较大。
3 CE测量指标在不同类型癫痫中的表现
3.1 特发性全面性癫痫(idiopathic generalized epilepsy,IGE)IGE相关研究中,MT是普遍采用的观测指标,大部分研究均证实IGE患者存在RMT值下降、皮质兴奋性升高的表现[14],这一现象在未服用抗癫痫药的青少年肌阵挛(juvenile myoclonic epilepsy,JME)患者中尤为明显[14]。但仍有部分研究显示IGE患者RMT与正常对照之间无显著差异,这并不符合通常印象中癫痫患者皮质兴奋升高的表现,可能的原因是大脑自身的保护机制激活了GABA受体介导的抑制作用[15]。
在以CSP作为观测值的IGE相关研究中尚未取得统一结果,大部分研究存在CSP延长的现象。一份纳入14项IGE研究的荟萃分析证实了这一现象,提示在大多数IGE患者中存在皮质抑制的增强[16]。这一结果并不符合通俗意义上癫痫患者皮质兴奋性升高的表现,相关研究者认为可能源于抗癫痫药物的应用及皮质内抑制机制的激活。
相对于上述指标,SICI和LICI在IGE患者中存在明显的抑制降低表现,与之相对的是ICF亦被发现存在升高表现,这一结果已在多项研究中得到验证。出乎意料的是,在一项关于JME患者ppTMS刺激的研究结果显示SICI和LICI均升高,有人认为这可能是抗癫痫药物对患者皮质兴奋性的抑制作用,亦有人认为这与JME病例中存在GABAA受体亚单位突变,导致皮质抑制作用增强有关[17]。
3.2 局灶性癫痫(focal epilepsy)癫痫患者相关研究中,大多数学者分别研究癫痫病灶侧及对侧的RMT,结果显示双侧并未出现明显差异[17]。但部分研究并未阐明其服药及发作控制情况,这使得最终的统计结果无法获得公认。在接受抗癫痫药物治疗的受试者中,其双侧的RMT值较正常对照均增加。上述研究结果并不统一,导致这种矛盾结论的原因可能与数据的统计分析以及抗癫痫药物的应用有关[16]。
局灶性癫痫患者CSP的研究结果大部分未发现有意义的CSP变化[15]。其中,Kim及Cincotta的研究发现CSP延长,与之相反的结果来自于de Goede等[10]的研究。
SICI在未应用抗癫痫药物的局灶性癫痫患者中大多数是降低的,这一结果在病灶侧半球更加明显,在这些研究中,病灶侧ICF同样为增加趋势。但仍有一些研究得出了不同的结果。在纳入了不同控制程度的癫痫患者和正常对照的研究中显示,控制不良患者的ICF12、ICF15低于正常受试者,而与中度控制患者相比,控制不良患者50 ms时的LICI更高。上述结果并不符合预期中控制较差的患者CE较高这一印象,且研究结果与预期之间的差异并不能用抗癫痫药物的CE抑制作用或神经元放电后相对不应期来解释。故此,有研究者认为这一差异可能与癫痫患者CE随时间的演变有关[18],但这一结论仍处于猜想,尚无直接证据证明。
IGE患者的RMT较低,CSP较长,存在CE升高的表现。而局灶性癫痫患者病灶侧皮质兴奋性升高的表现尚未明确,有待于进一步证实。多项采用SICI和LICI作为观测值的研究显示,不管是IGE还是局灶性癫痫患者,均存在CE增加的表现。这表明上述测量值在不同研究中重复性较高,预示在未来的研究中SICI及LICI可能成为CE分析最为理想的观测值之一[19]。
总体来说,未应用抗癫痫药物的IGE患者中CE增加的趋势最为显著。局灶性癫痫的CE分析则有待于进一步研究。纵观目前成果,试验的设计从简单的病例对照逐渐推进至各测量值间的综合分析,已取得显著进展。但研究中仍存在患者发作控制情况不明、服药方案各异及测量时间点不一致等影响因素,给最终的统计结果带来不可避免的影响。繁多的影响因素在临床研究中不可避免,但通过细化分组标准、严格纳入受试者、规范操作流程、完善受试者资料库及大量的研究样本等方式可以弱化这些因素可能带来的偏倚,从而得到更加令人信服的结论。
CE作为癫痫病理生理机制研究及预后评估的有力切入点,除去前文所述各测量值对CE变化的评价,越来越多的研究者将CE的变化与脑电图(electroencephalogram,EEG)和功能磁共振(functional MRI,fMRI)等手段结合起来进行脑部结构和高级功能的定位研究。 这种新的组合不仅在癫痫病灶的定位、外科手术切除致痫灶的精准化引导以及脑功能分区的深度解读方面具有广阔的前景,同样给后续的癫痫相关研究带来新思路。
