视神经脊髓炎谱系疾病中的肌肉损害
2019-02-11孙慧武雷黄德晖
孙慧 武雷 黄德晖
视神经脊髓炎(neuromyelitis optica,NMO)是以突出累及视神经、脊髓的和颅内特殊部位为特点的中枢神经系统炎性脱髓鞘疾病。2004年Lennon等[1]发现了NMO特异性的标志物即水通道蛋白4抗体(auquaporin 4 antibody,AQP4 Ab)。2017年Wingerchuk等[2]第一次提出了视神经脊髓炎谱系疾病(neuromyelitisoptica spectrum disorders,NMOSD)的概念,并认为其诊断标准以血清AQP4 Ab阳性为前提。但后来的研究不断发现临床上有部分AQP4 Ab阴性患者,临床特点与NMO高度相似,在治疗策略方面与NMO无显著差别,且绝大部分最终发展成为NMO,因此国际NMO协助组在2015年对NMOSD诊断标准进行了修订[3]。目前认为,AQP4 Ab阳性的NMOSD的发病机制是抗体选择性的与中枢神经系统星形胶质细胞足突上的水通道蛋白4(AQP4)结合,继而诱发抗体依赖和补体依赖的细胞毒性反应,造成CNS炎性脱髓鞘。最初研究者认为,AQP4 Ab仅引起中枢神经系统AQP4高表达部位的损伤,外周表达有AQP4的组织器官则被赦免。但最近,国内外一些学者相继发现了AQP4相关外周组织器官,如骨骼肌[4-5]、前庭蜗神经[6]、胃肠道[7]、血液系统[8]、肾脏[8]、肺[9]和胎盘[10]受累的临床证据。
绝大部分的出现肌肉损害的NMOSD患者无特异性临床症状,因而较难发现。肌肉组织损害的标志表现之一是血液中肌酸激酶(creatine kinase,CK)含量升高。CK又称肌酸磷酸激酶,以骨骼肌、心肌、平滑肌含量为多。血液中CK升高是CK含量高的组织损伤的标志,如骨骼肌疾病、肌炎和心肌炎,还可发生在包括物理损伤、药物滥用等情况下[11]。故本文拟通过对NMOSD伴CK增高的文献进行检索、分析,对其临床表现、实验室指标、电生理表现、肌肉影像学特点及病理学特点以及肌肉损害可能的发生机制进行综述。
1 检索策略及方法
应用Pubmed数据库,采用“Neuromyelitis Optica”或“Neuromyelitis Optica Spectrum Disorders”或“Devic disease”和“hyper CK emia”或“myelopathy”或“Creatase”或“Muscle enzyme”或“Creatine kinase”或“Muscle”或“Sarcous”或“Creatine kinase isoenzyme”或“Creatine kinase MB”作为关键词,进行文献检索(2010-01-01—2019-02-28),将有明确病因导致肌酶升高的病例排除,共检索文献13篇[4-5,9,12-21],NMOSD患者共计16例。并以“视神经脊髓炎”或“视神经脊髓炎谱系疾病”和“肌肉损害”或“肌酶”为关键词在国内三个资料相对较全、范围较广的数据库(CNKI数据库、维普及万方数据库)里进行文献检索(截止到2019-02-28),未获取到相关文献。
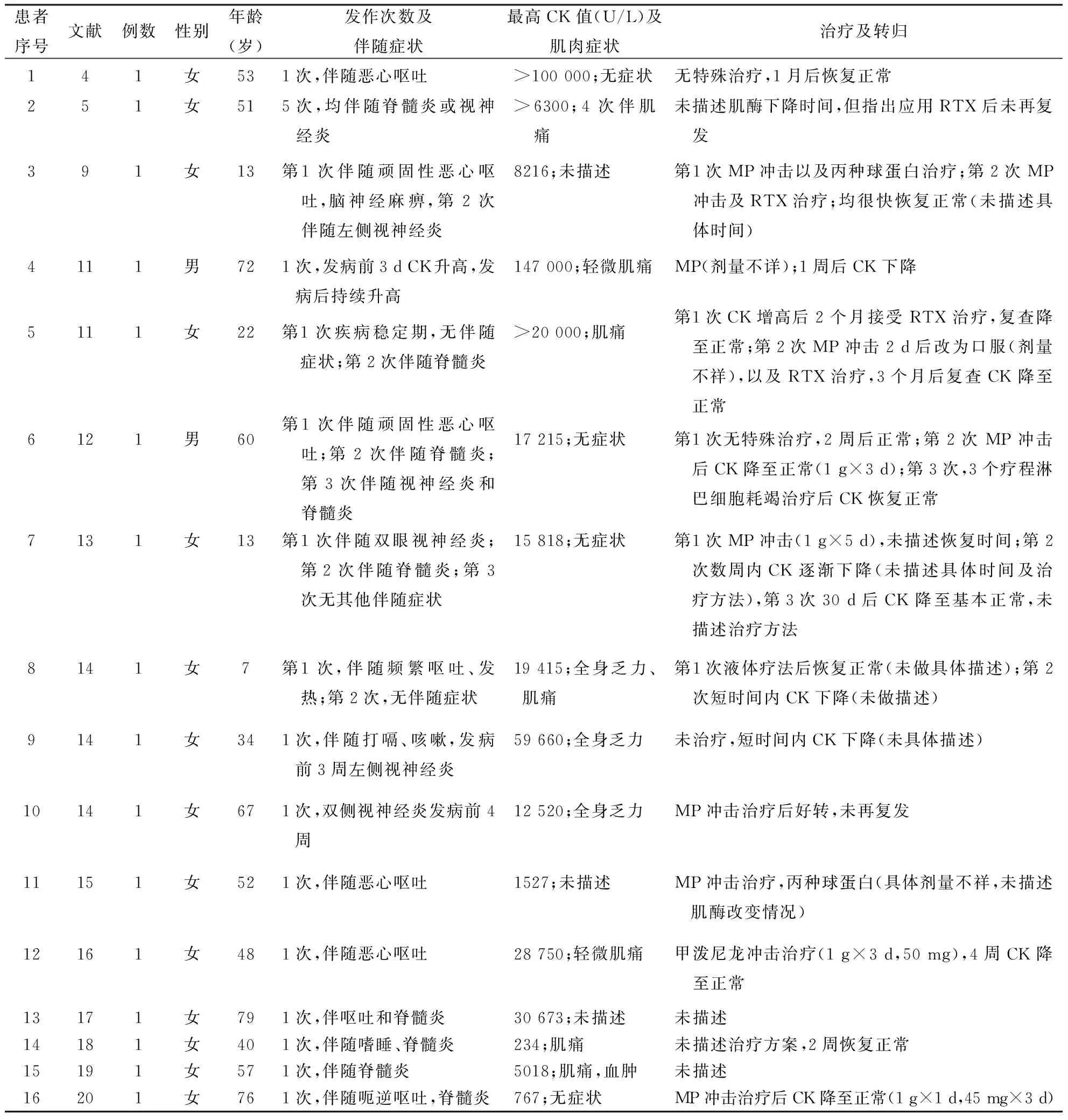
表1 NMOSD患者肌肉损害的相关文献报道
注:NMOSD:视神经脊髓炎谱系疾病;CK:肌酸激酶,表2同;MP:甲泼尼龙;RTX:利妥昔单抗
2 肌肉酶学
16例NMOSD相关的肌肉损害病例统计见表1。其中男2例、女14例,年龄7~79岁,平均年龄为(44.5±5.8)岁,这些患者除表现为经典的视神经炎及脊髓炎的临床症状外,还有7例(50%)患者在临床中出现了极后区症状。所有患者的血清AQP4 Ab均为阳性,CK水平均显著升高。CK升高的次数共26次,每人1~5次,平均为(1.64±0.31)次,报道中CK最低者(患者14)为234 U/L[19],此例患者同时伴有心肌损害(肌钙蛋白为3013 ng/L)。CK最高的1例(患者4)为147 000 U/L[12],此例患者连续4年应用辛伐他汀,并在发病前有增加剂量的病史,其余患者均未发现其他肌肉损害因素。4篇文献[4,9,12,22]对所报道的5例患者的肌酶持续升高的时间进行了追踪,发现持续1周至3个月不等。
3 肌肉影像学特点
肌肉磁共振(MRI)对软组织良好的分辨率,可以清晰地显示肌肉受累的范围及炎性浸润、水肿及病变部位的纤维化和钙化的情况[23]。T1加权高信号能显示肌肉萎缩和脂肪浸润,而T2加权和STIR序列高信号能较好地显示病变部位的炎性活动度等[24],且信号强度与肌力变化有良好的一致性[25-26]。所检索文献中,患者10骨盆MRI显示髂腰肌STIR序列高信号改变[19],患者16股部MRI 示显示双侧股四头肌T2WI序列弥漫性高信号[20]。Malik等[12]对患者6(CK 17 215 U/L并伴有轻微肌痛)进行MRI检查发现双侧股部肌群弥漫性水肿,并由此认为,AQP4 Ab造成的肌肉损害可能是弥漫性的而不是局部的。但也有研究发现在肌酶升高的NMOSD患者中,肌肉MRI没有异常改变[13],这可能与检查时此患者CK水平已经明显降低有关(由17 215 U/L降至2387 U/L)。具体见表2。
由上可见,对肌肉损害进行多维度的监测,尤其在CK上升期进行肌肉MRI检查,可能更有助于早期发现异常。
4 病理学表现
肌肉组织活检是诊断肌肉疾病的重要手段之一。光学显微镜下,肌酶升高的NMOSD患者的组织病理学未见异常改变[12,14],或仅显示出一些微小的非特异性改变,如Ⅱ型肌纤维的萎缩、再生,肌内膜和血管周围间隙内淋巴细胞和嗜酸性粒细胞的渗出,但没有肌纤维坏死的表现[5]。免疫组化染色检查显示Ⅱ型肌纤维肌膜上AQP4表达减少或活性降低:Guo等[5]对1例患者的三角肌和股外侧肌活检标本进行免疫组织化学检测发现,Ⅱ型肌纤维肌膜上的AQP4免疫活性降低,伴局部肌膜IgG结合性增加及活化的补体沉积,Malik等[12]对2例患者的股四头肌和肱二头肌分别进行AQP4的免疫印迹分析显示,2例患者Ⅱ型肌纤维肌膜上AQP4蛋白表达均减少,伴有AQP4超分子聚合物的增多。但Di Filippo等[14]对1例肌酶为7828 U/L的NMOSD患者的股外侧肌肉进行活检发现,光镜下同样未见组织病理学改变,免疫荧光染色显示了正常的肌膜反应性,未发现Ⅱ型肌纤维肌膜AQP4的丢失,同时也没有发现其他可以解释肌酶升高的病理改变,作者认为这可能与以下原因有关:AQP4的丢失可能不是弥漫性的,局灶性的病灶限制了免疫荧光的检出率;另外作者也指出,这可能与30%无症状性肌酶升高的患者肌肉活检结果是完全正常的有关[27]。具体见表2。

表2 所检文献中NMOSD患者肌肉损害相关辅助检查情况
注:MRI:磁共振;EMG:肌电图;—:代表未行相关检查
5 肌肉损害的发生机制
NMOSD肌肉损害的发病机制仍不完全清楚。众所周知,骨骼肌纤维分Ⅰ型肌纤维和Ⅱ型肌纤维两种类型,人类四肢的大多数骨骼肌中Ⅰ型纤维和Ⅱ型纤维大约各占50%。水通道蛋白(AQPs)是参与水和甘油跨膜运动,维持渗透梯度的跨膜蛋白家族,其中,AQP4在骨骼肌中含量丰富,其作用可能与骨骼肌纤维糖酵解代谢有关[28]。在哺乳动物中,AQP4选择性的表达于Ⅱ型肌纤维上[29]。根据所检文献中的报道,NMOSD患者的AQP4 Ab作用于Ⅱ肌纤维膜上的AQP4,造成其减少或丢失,但不引起光学显微镜下结构的改变。然而,CK主要存在于肌纤维的细胞质中[30],在没有肌纤维坏死的情况下,AQP4 Ab是如何造成肌酶升高的呢?有学者认为其原因有以下两点:(1)AQP4 Ab是镶嵌在肌膜上AQP4蛋白的结合,造成肌纤维膜结构的紊乱,从而引起CK泄露[31];(2)AQP4参与肌肉细胞内钙动力学和生物能量的代谢途径,引起肌膜上的AQP4丢失,破坏了Ⅱ型肌纤维中钙的稳态,进而可能引起肌纤维代谢和结构损害,导致CK大量渗漏入血液[5]。近期更有学者认为,CK升高造成了肌纤维膜上AQP4抗原的暴露,诱发了AQP4抗体的形成,从而诱发了NMOSD发生[31]。笔者认为,NMOSD患者的肌酶升高多伴随疾病出现,或在疾病确诊后被发现,故肌肉损害很可能是AQP4抗体阳性NMOSD的一个组成部分,需要临床医生给予更多的关注和更深入研究。
6 治疗和预后
目前对于NMOSD肌肉损害的主要治疗方法仍为糖皮质激素、血浆置换或免疫抑制治疗。在上述报道文献中,除1例患者治疗无效死于呼吸衰竭以外[12],其他NMOSD患者CK值均随着激素的使用而逐渐恢复至正常水平。其中,Guo等[5]所报道的患者在病程中共发生5次CK升高,其中3次单独发生,2次伴随脊髓炎发生,每次均在应用糖皮质激素和血浆置换治疗后恢复至正常水平,且在使用利妥昔单抗预防治疗后1年内未再出现临床发作及CK增高,因此作者认为,针对体液免疫的治疗是可以预防NMOSD中枢神经系统外靶器官受累的。这也充分印证了肌肉及其他的中枢神经系统外富含AQP4的器官很可能也是AQP4抗体的攻击对象,其治疗方案与中枢神经系统组织损害一致。
综上,NMOSD相关肌肉损害并不常见但却值得关注。绝大部分的出现肌肉损害的患者无特异性临床症状,因此NMOSD患者的肌肉损害较难发现,肌酶检查及肌肉影像学可能是发现肌肉损害的必要手段。AQP4抗体阳性的NMOSD患者肌肉或其他表达AQP4的中枢神经系统外器官的受累,也进一步证实了AQP4抗体在发病过程中的重要性,但具体机制仍不是十分清楚,需要临床医生给予更多的关注和更深入研究,以提高对其更全面的认识。
