红曲黄酒传统酿造用曲中的微生物菌群及挥发性风味组分分析
2019-01-28吕燕霖郭伟灵潘雨阳洪家丽赵立娜饶平凡李秋艺吕旭聪
李 路,吕燕霖,郭伟灵,潘雨阳,洪家丽,赵立娜,倪 莉,饶平凡,李秋艺,吕旭聪,,
(1.福建农林大学 国家菌草工程技术研究中心,福建 福州 350002;2.泉州经贸职业技术学院,福建 泉州 362000;3.福州大学食品科学技术研究所,福建 福州 350108;4.福州外语外贸学院,福建 福州 350202)
黄酒是世界上最古老的发酵型酒精饮料之一[1],富含氨基酸,具有独特的香气和低酒精含量,深受人们的喜爱[2]。酒曲是黄酒酿造的动力,具有糖化、发酵和生香三大功能,对黄酒风味组分的形成起到至关重要的作用[3-4]。作为中国黄酒中颇具特色的典型代表,红曲黄酒是以糯米为主要原料,添加红曲和白曲作为糖化发酵剂,经多种微生物酿造而成的一种低度黄酒,以色红、味醇、香浓而著称[5-6]。红曲又称丹曲,主要是以大米为原料经红曲霉等微生物发酵而制成的一种米曲[7-8]。白曲是以米粉或米糠为原料,添加少量中草药接入曲母培养而成,它是以根霉和酵母菌为主的酒曲[9]。红曲黄酒独特挥发性风味组分的形成与酒曲中的微生物发挥的功能密切相关[10]。然而,至今为止,红曲和白曲中的微生物菌群及挥发性风味组分尚不明确。课题组前期研究发现红曲和白曲对红曲黄酒挥发性风味组分形成存在显著差异,由此推测该差异可能与红曲和白曲中的微生物菌群及其挥发性风味组分有关。本研究采用顶空固相微萃取(head space-solid phase microextraction,HS-SPME)结合气相色谱-质谱(gas chromatography-mass spectrometry,GCMS)联用技术分析红曲和白曲的挥发性风味组分,通过主成分分析(principal component analysis,PCA)和正交偏最小二乘法判别分析(orthogonal partial least squares discrimination analysis,OPLS-DA)模型确定红曲和白曲中的特征挥发性风味组分;同时,通过高通量测序分析红曲和白曲中微生物菌群结构,确定红曲和白曲中的优势微生物菌群结构。研究结果将为提升红曲黄酒风味和改良红曲黄酒传统酿造工艺提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
红曲、药白曲 当地红曲黄酒酿造酒厂;2-辛醇(内标,色谱纯) 美国Sigma公司;NaCl(分析纯)国药集团化学试剂有限公司;其他试剂均为国产色谱纯或分析纯。
1.2 仪器与设备
7890A/5975MSD型GC-MS联用仪、DB-5MS弹性石英毛细管管柱(30 m×0.25 mm,0.25 μm) 美国Agilent公司;SPME装置、50/30 μm DVB/CAR/PDMS萃取头 美国Supelco公司;15 mL顶空钳口样品瓶上海安谱公司;电子分析天平 梅特勒-托利多仪器(上海)有限公司;DF-1型号集热式磁力搅拌器 金坛市鑫渃实验仪器厂;QYSW-10B纯水机 重庆前沿水处理设备有限公司。
1.3 方法
1.3.1 HS-SPME
萃取头的预处理:将新购置的萃取头插入气相色谱仪(进样口250 ℃)老化1 h。
样品HS-SPME:称取2.0 g NaCl加入到15 mL的钳口样品瓶中,加入0.6 g样品(研磨后)与5.4 mL超纯水混匀,再加入5 μL内标溶液(2-辛醇质量浓度为10 mg/L),用封盖器封好。50 ℃磁力搅拌器上预热10 min后,将萃取头插入样品瓶顶空部分,50 ℃萃取30 min。
1.3.2 GC-MS分析香气组分
将萃取头从顶空瓶中取出,迅速插入气相色谱仪进样口,250 ℃解吸5 min,进行GC-MS检测分析。气相色谱条件:高纯度氦气作为载气,流速:1 mL/min;色谱柱:DB-Wax色谱柱(30 m×0.25 mm,0.25 μm);进样模式:不分流进样;进样口温度:250 ℃;升温程序:起始温度40 ℃,保持5 min,以5 ℃/min升至120 ℃,然后以10 ℃/min升至240 ℃,保留5 min;后运行温度:240 ℃;后运行时间:5 min。质谱条件:接口温度:280 ℃;连接杆温度:150 ℃;电子离子源:电子能量70 eV;离子源温度:230 ℃;质量扫描范围:m/z 35~450;ACQ方式:Scan。
1.3.3 GC-MS数据分析
定性和定量分析:由GC-MS得到的色谱图,经计算机在标准谱库NIST11和Wiley中比对检索,确定挥发性组分的化学成分,并准确地鉴定出红曲和白曲的挥发性成分,同时采用2-辛醇(10 mg/L)为内标进行进行半定量分析,得到各组分的质量浓度。利用R语言绘制热图,可直观观察到红曲和白曲挥发性风味组分含量的差异。将处理后的数据进一步通过SIMCA 14.1软件进行多变量分析处理。进行PCA检测两组红曲和白曲样品的聚类趋势。通过OPLS-DA模型快速准确地筛选出红曲和白曲样品中的差异挥发性风味组分。
1.3.4 酒曲微生物总DNA提取
红曲和白曲样品冻干后各取10 g研磨,分别加入90 mL超纯水混匀,用4 层纱布过滤后保留各自上清液,利用低温离心机离心(8 000 r/min、4 ℃、10 min),收集沉淀(菌体)。将收集的菌体利用OMEGA公司试剂盒Mag-Bind Soil DNA Kit (50) M5635-01提取菌体DNA。
1.3.5 微生物菌群高通量测序及数据分析
采用细菌引物Pro340F(5’-CCTACGGGNBGCASCAG-3’)和Pro805R(5’-GACTACNVGGGTATCTAATCC-3’)对细菌菌群16S的V3-V4高变区进行扩增[11];采用真菌引物ITS2F(5’-GTGAATCATCGARTC-3’)和ITS2R(5’-TCCTCCGCTTATTGAT-3’)对真菌菌群ITS2区域进行扩增[12]。将扩增产物送至上海派森诺生物科技有限公司进行高通量测序。测序结果采用Qiime软件分析,将序列归类、去除标签、引物和接头序列,并且去除长度小于110 bp、模糊碱基大于2和序列平均质量小于30的序列,最后使用UCLUST把高质量的序列根据97%序列相似度聚成不同的操作性分类单元,分析鉴定不同酿造用曲中的微生物菌群分布[13-16]。
2 结果与分析
2.1 红曲和白曲样品中挥发性风味组分的测定
采用50/30 μm DVB/CAR/PDMS萃取头对红曲和白曲样品中的挥发性风味组分进行HS-SPME结合GC-MS分析,其总离子流色谱图见图1。

图1 白曲(a)和红曲(b)中挥发性组分的GC-MS总离子流色谱图Fig.1 GC-MS total ion chromatogram of volatile components in Baiqu (a) and Hongqu (b)
通过数据库的比对,鉴定出红曲和白曲样品中的挥发性组分共70 种,并用R语言绘制成热图,可以直观地显示两种样品挥发性风味组分的差异。由图2可知,红曲和白曲样品分别有48 种和40 种,其中,有24 种是2 种酒曲共有的挥发性风味组分,如异戊醇(F3)、正己醇(F7)、己醛(F53)等;28 种是红曲样品特有,如草蒿脑(F48)、4-乙基愈创木酚(F66)、2-甲酚(F64)等;18 种是白曲样品特有,如2-乙基己醇(F8)、2-庚醇(F18)和2-壬酮(F23)等。

图2 红曲和白曲中挥发性风味组分的热图分析Fig.2 Heat-map analysis of volatile components in Hongqu and Baiqu
2.2 红曲和白曲挥发性风味组分PCA
PCA是一种无监督的多元变量统计分析方法,可以从多维空间反映各组样本之间的代谢差异和组间样本差异,是原始数据最初呈现的一种基本原始状态[17-19]。从图3可以看出,两组样本区分非常显著,且样本均处于95%置信区间内。
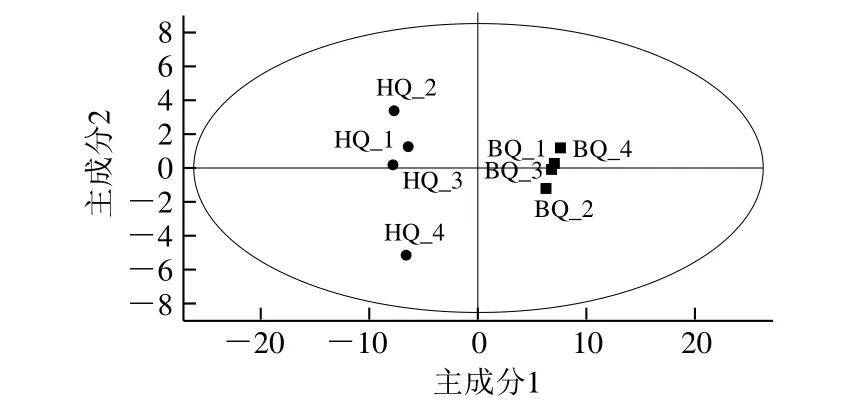
图3 基于PCA解析红曲和白曲的挥发性风味组分Fig.3 PCA of volatile flavor components in Hongqu and Baiqu
2.3 红曲与白曲中挥发性风味组分的差异分析

图4 红曲和白曲挥发性风味组分OPLS-DA模型的置换检验结果Fig.4 Permutation test of OPLS-DA model for volatile flavor components in Hongqu and Baiqu

图5 红曲和白曲挥发性风味组分OPLS-DA的分数散点图Fig.5 Score scatter plot based on OPLS-DA model for volatile flavor components in Hongqu and Baiqu
在OPLS-DA模型中,两组之间的分类可以采用分数散点图和S型载荷图的形式进行可视化。通过OPLSDA,可获取更加可靠的代谢物组间差异与实验组的相关程度信息,而构建模型的可信度通过置换检验得出[20]。如图4所示,横坐标表示置换检验的置换保留度(置换保留度等于1处的点即为原模型的R2和Q2值),R2接近1,说明建立的模型符合样本数据的真实情况;Q2接近1,说明如果有新样本加入模型,会得到近似的分布情况[21-22]。由此,从分数散点图(图5)可见,红曲与白曲两组样本区别非常显著,样本全部处于95%置信区间内。
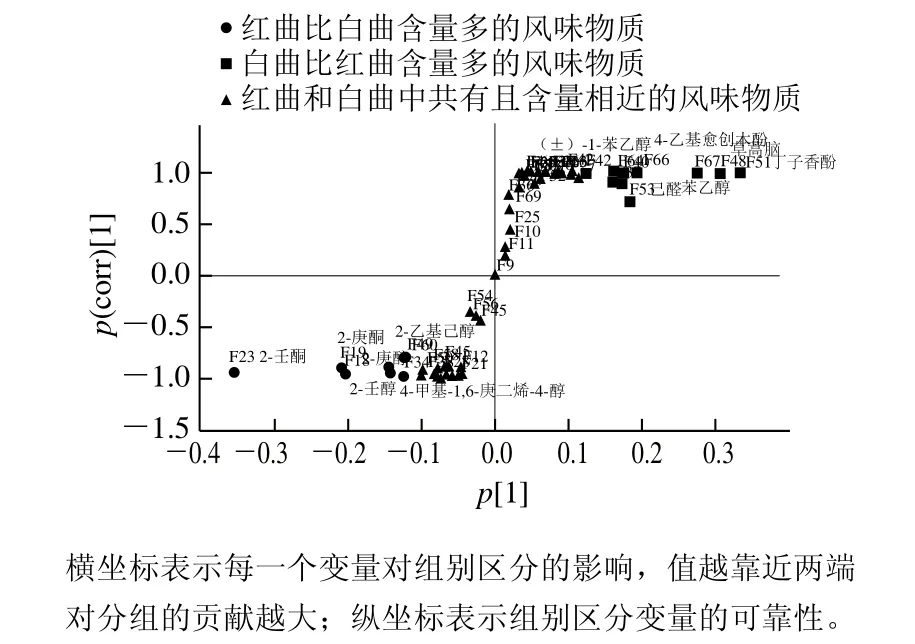
图6 基于OPLS-DA模型分析的S型载荷图Fig.6 S-shaped loading plot based on OPLS-DA model analysis
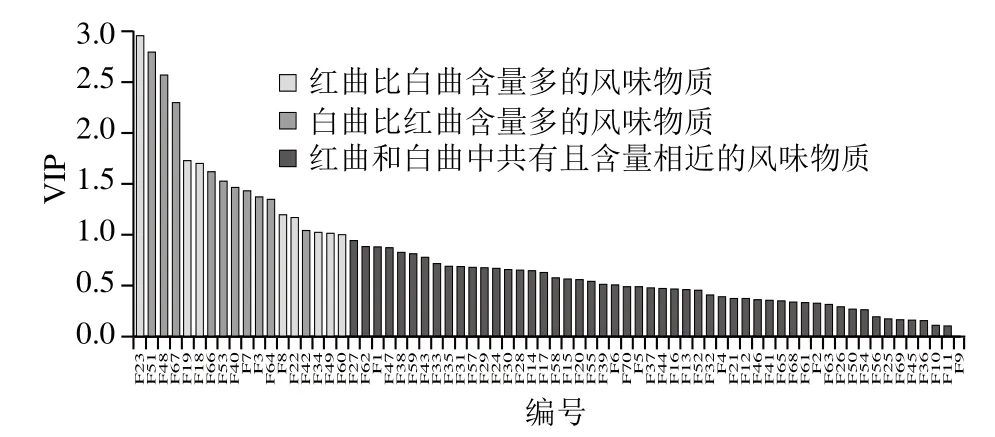
图7 基于OPLS-DA模型分析的VIP预测值分布图Fig.7 Distribution of VIP forecast values based on OPLS-DA model analysis
S型载荷图通过组合OPLS-DA预测模型组件的协方差分布和权重的相关性来改善分类变量的可视化,具有较高相关值和协方差的物质与原点相距较远,表示差异较大[23]。通过OPLS-DA模型第1主成分的变量投影重要度(variable importance in the projection,VIP)大于1,来筛选红曲与白曲之间具有显著差异的挥发性风味物质(图6、7)。
红曲与白曲之间显著差异的挥发性风味物质有18种,其中相比较白曲,红曲中的特征挥发性风味物质为:2-壬酮(F23)、2-庚酮(F19)、2-庚醇(F18)、2-乙基己醇(F8)、2-壬醇(F22)、4-甲基-1,6-庚二烯-4-醇(F34)、乙酸乙酯(F49)、N-羟基苯甲酰亚胺甲酯(F60);而相比较红曲,白曲中的特征挥发性风味物质为:丁子香酚(F51)、草蒿脑(F48)、苯乙醇(F67)、4-乙基愈创木酚(F66)、己醛(F53)、苯甲醛(F40)、正己醇(F7)、异戊醇(F3)、2-甲酚(F64)和(±)-1-苯乙醇(F42)。
2.4 红曲和白曲中的微生物菌群结构分析
2.4.1 细菌菌群结构分析

表1 红曲和白曲中的细菌组成比例Table1 Bacterial community composition of Hongqu and Baiqu
由表1可知,红曲中的优势细菌菌群为芽孢杆菌属(62.791%)、魏斯氏菌属(6.944%)、片球菌属(17.290%)、葡糖醋杆菌属(2.931%)等,其中葡糖醋杆菌属、细球菌科、葡糖杆菌属等为红曲特有菌群。芽孢杆菌属具有较强的分泌蛋白酶、淀粉酶和纤维素酶等酶类的能力,可分解大分子物质形成双乙酰、含氮化合物等芳香物质,对黄酒风味物质的形成有巨大的贡献作用[24]。刘芸雅等[25]通过对绍兴黄酒发酵中微生物群落结构研究时,同样发现芽孢杆菌属与乙酸己酯相关性极强。白曲中的优势细菌菌群为泛生菌属(34.749%)、肠杆菌属(29.680%)、魏斯氏菌属(21.609%)、克雷白氏杆菌属(7.199%)和阪崎肠杆菌属(2.063%)等,其中而阪崎肠杆菌属、肠杆菌科、变形杆菌属和柠檬酸杆菌属则为白曲特有菌群。肠杆菌属细菌多为不致病菌或条件致病菌,但有部分是人体内的正常微生物,能够产生短链脂肪酸和有机酸并能利用糖酵解和戊糖磷酸途径对糖进行降解[26]。
2.4.2 真菌菌群结构分析
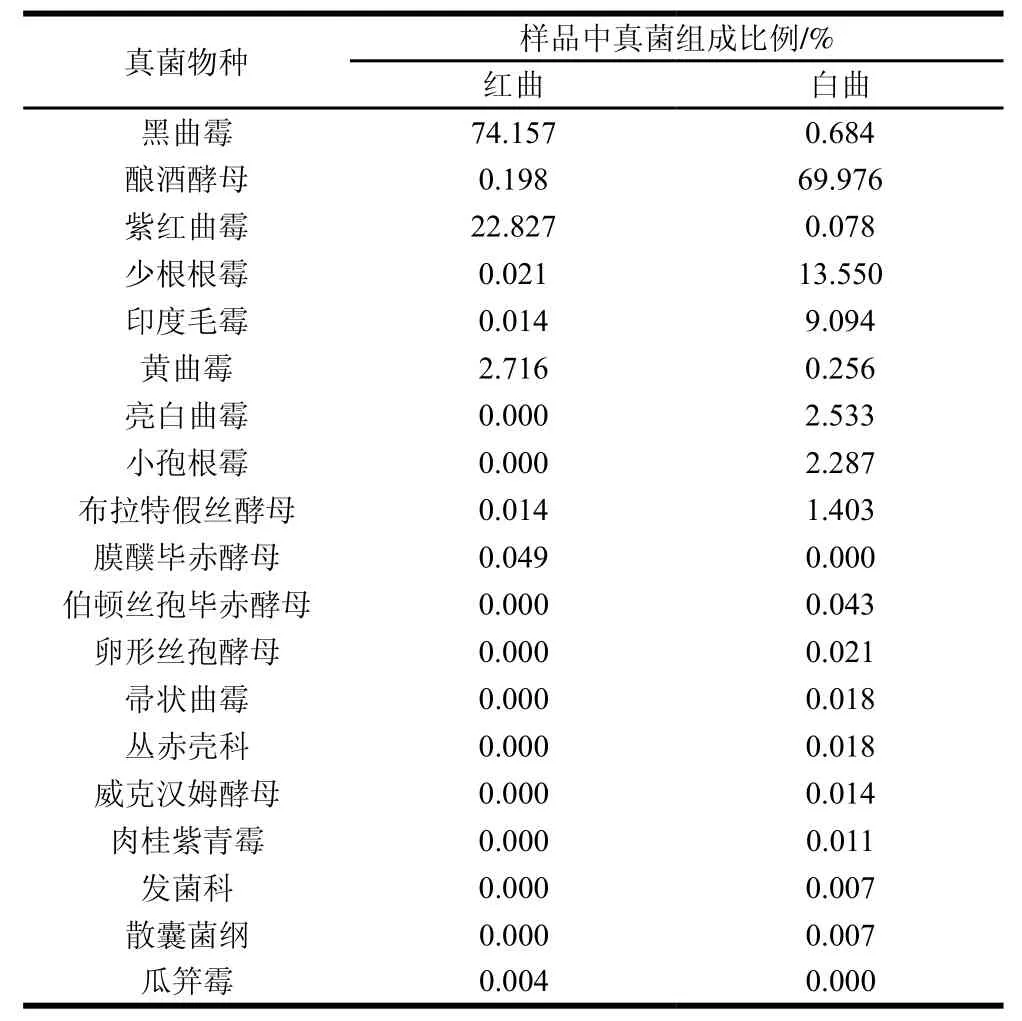
表2 红曲和白曲中的真菌组成比例Table2 Fungal community composition Hongqu and Baiqu
如表2所示,在红曲中的优势真菌菌群为黑曲霉(74.157%)、紫红曲霉(22.827%)、黄曲霉(2.716%)和酿酒酵母(0.198%)等,特有的菌群为膜醭毕赤酵母和瓜笄霉;而白曲中的优势真菌菌群为酿酒酵母(69.976%)、少根根霉(13.550%)、印度毛霉(9.094%)、亮白曲霉(2.533%)等,特有的菌群为亮白曲霉、小孢根霉、伯顿丝孢毕赤酵母、卵形丝孢酵母、帚状曲霉和丛赤壳科等。由于根霉含有丰富的糖化型淀粉酶,能将大米淀粉结构中的α-1,4键和α-1,6键切断,促进绝大部分淀粉转化为可发酵糖,因此在白曲中的少根根霉和小孢根霉具有提高糖化率和淀粉利用率的作用[27-28]。酿酒酵母在酿酒过程中,将可发酵性糖分转化为乙醇及二氧化碳的同时伴随着大量副产物的生成,如醇类、醛酮类、酸类、酯类、含硫化物等,这些副产物形成了黄酒风味的主体成分[29-30]。此外,余培斌[31]也发现曲霉属、芽孢杆菌属、根霉属等是产生生淀粉葡萄糖淀粉酶的主要优势菌群,对酿酒产生各种风味物质具有重要的作用。
3 结 论
HA-SPME结合GC-MS、PCA和OPLS-DA实验结果表明:从红曲与白曲中检测到的挥发性物质共70 种,红曲与白曲之间显著差异的挥发性风味物质有18 种,其中红曲中的特征挥发性风味物质包括2-壬酮、2-庚酮、2-庚醇、2-乙基己醇、2-壬醇、4-甲基- 1,6-庚二烯-4-醇、乙酸乙酯和N-羟基苯甲酰亚胺甲酯,而白曲中的特征挥发性风味物质包括丁子香酚、草蒿脑、苯乙醇、4-乙基愈创木酚、己醛、苯甲醛、正己醇、异戊醇、2-甲酚和(±)-1-苯乙醇。菌群高通量测序结果表明:红曲中的优势细菌主要是芽孢杆菌属、魏斯氏菌属、片球菌属、葡糖醋杆菌属、细球菌科和芽孢杆菌科等,优势真菌主要是黑曲霉、紫红曲霉、黄曲霉和酿酒酵母等;白曲中的优势细菌主要是泛生菌属、肠杆菌属、魏斯氏菌属、克雷白氏杆菌属、阪崎肠杆菌属和大肠杆菌志贺菌属等,优势真菌主要是酿酒酵母、少根根霉、印度毛霉、亮白曲霉、小孢根霉和布拉特假丝酵母等。研究分析了红曲和白曲中微生物菌群及挥发性风味组分,对进一步解析红曲黄酒产香机理和提升红曲黄酒的风味品质都具有重要的理论指导价值。
