高效液相色谱-串联质谱联用技术快速分析稻米中毒死蜱和丁硫克百威及其代谢产物的残留量
2019-01-28马有宁秦美玲柴爽爽张涵彤牟仁祥
杨 欢,马有宁,秦美玲,柴爽爽,何 巧,张涵彤,牟仁祥
(中国水稻研究所农业部稻米及制品质量监督检验测试中心,农业部稻米产品质量安全风险评估实验室,浙江 杭州 310006)
稻米是人类口赖以生存的主食之一[1],水稻在中国种植面积约占世界水稻种植面积的23%,而我国水稻产量超过世界总产量的30%,排名世界第一[2]。水稻产量受真菌和昆虫影响,至少有70 种昆虫被记录为水稻害虫,严重影响水稻产量[3-4]。因此,在现代农业中农药被广泛用于提高作物的生产力和质量,但对人体健康有害的农药残留物是不可避免的[5-6]。
毒死蜱和丁硫克百威是近年来常用的低毒杀虫剂,对水稻等经济作物中的咀嚼式和刺吸式口器害虫有较好的防治效果[7-8]。毒死蜱和丁硫克百威两种农药的作用机理都是通过抑制乙酰胆碱酯酶的活性来影响昆虫正常的神经传导[9]。两种杀虫剂在土壤和植物中易于降解,其代谢物的毒性远高于母体。毒死蜱的主要代谢产物是3,5,6-三氯-2-吡啶醇(3,5,6-trichloro-2-pyridinol, 3,5,6-TCP)是一种有毒化学物质,会导致男性睾丸激素水平降低[10];丁硫克百威主要代谢产物为克百威、3-羟基克百威[11],克百威与胆碱酯酶抑制的结合不可逆决定了其对人类及动物体的毒性极高[12]。同时,两种农药的主要代谢产物水溶性好,渗透能力强,对环境污染比较严重[13]。为严格把控稻米质量安全,日本规定丁硫克百威、克百威和毒死蜱在糙米中的残留限量分别为0.2、0.1 mg/kg和0.1 mg/kg,我国规定稻谷中毒死蜱和丁硫克百威的限量为0.5 mg/kg,糙米中克百威的残留限量为0.1 mg/kg。但国内外对3,5,6-TCP和3-羟基克百威还未制定残留限量,因此有必要开展毒死蜱和丁硫克百威及主要代谢物在水稻中残留的研究。
目前,已报道的检测方法主要有气相色谱法[14]、液相色谱法[15-16]、气相色谱-质谱法[17-20]、液相色谱-串联质谱法[21-23]和生物传感器法[24],但同时测定2种农药及主要代谢物的方法报道较少。本实验采用QuEChERS前处理方法与高效液相色谱-质谱联用技术相结合,建立一种快速且回收率高、精密度好的残留分析方法,实现了稻米中两种杀虫剂及代谢物的同时检测,为样品分析提供技术支持。
1 材料与方法
1.1 材料与试剂
甲醇(色谱纯) 德国Merck公司;甲酸、甲酸铵(均为色谱纯) 美国Fluka公司;NaCl(分析纯)上海试四赫维化工有限公司;乙二胺-N-丙基硅烷(primary secondary amine,PSA)和十八烷基键合硅胶吸附剂(C18)填料(粒径40.0 μm) 美国瓦里安公司;MgSO4(分析纯) 美国Sigma-Aldrich公司;毒死蜱(纯度99%)标准品 农业部环境质量监督检验测试中心;3,5,6-TCP(纯度99.0%)、丁硫克百威、克百威、3-羟基克百威标准品(纯度不低于95%) 德国Dr.Ehrenstorfer公司;实验室用水为Milli-Q高纯水。
1.2 仪器与设备
Survryor系列液相色谱仪 美国ThermoFisher公司;TSQ Quantum Access MaX三重四极杆质谱仪、Multfuge×1离心机 美国ThermoFisher公司;T25 digital ULTRATURRAX®高速匀浆机、Tube Mill control研磨机 德国IKA公司;NSART100脱壳机 佐竹机械有限公司。
1.3 方法
1.3.1 标准储备液和工作溶液的配制
用万分之一天平准确称取5 种化合物的标准品各10.0 mg(精确至0.01 mg)置10.0 mL的容量瓶内,用甲醇溶解定容分别配制成质量浓度为l.0 mg/mL的标准储备液。再将5 种单标准液分别稀释成质量浓度均为10.0 mg/L的混合标准溶液,置于-20 ℃冰箱中保存。
1.3.2 样品前处理方法
1.3.2.1 样品提取
将稻米用研磨机磨成粉末(粒度1~50 μm)后称取5.0 g(精确至0.01 g)样品于250.0 mL离心管中,加入20.0 mL超纯水浸泡30.0 min。充分浸泡后加入25.0 mL乙腈(含0.1%甲酸)置于匀浆机中匀浆2.0 min后分别加入10.0 g MgSO4、1.0 g NaCl,再经5 000 r/min匀浆1.0 min,匀浆后将离心管置于离心机中以3 800 r/min离心3.0 min。
1.3.2.2 样品净化
取上层有机相5.0 mL于15.0 mL离心管中,分别加入1.2 g MgSO4、100.0 mg PSA和100.0 mg C18,用旋涡混合器充分振荡混匀,待净化后再放入离心机中以3 800 r/min离心3.0 min,取1.0 mL上清液过0.22 μm的有机滤膜,滤液待检。
1.3.3 色谱条件
色谱柱:Eclipse XDB-C18柱(150 mm×2.1 mm,3.5 μm);柱温:30.0 ℃;进样量:2.0 μL;流动相:A为含0.1%甲酸的5 mmol/L甲酸铵溶液,B为甲醇;流速:200 μL/min;梯度洗脱程序:0.0~6.0 min,30.0%~95.0% B;6.0~16.0 min,95.0% B;16.0~16.1 min,95.0%~30.0% B;16.1~22.0 min,30.0% B。
1.3.4 质谱条件
扫描模式:正负离子模式自动切换扫描;检测方式:动态多反应监测;电离方式:电喷雾电离(electron spray ionization,ESI);喷雾电压:3 300 V(ESI+),2 300 V(ESI-);鞘气流速:25.0 L/min;鞘气(N2)压力:240.1 kPa;辅助气(N2)压力:43.0 kPa;毛细管温度:350.0 ℃;离子源温度:350.0 ℃。其他质谱参数见表l。

表1 分析物的质谱采集离子信息Table l MS acquisition parameters for analytes
2 结果与分析
2.1 质谱条件优化
为使5 种分析物的色谱分离和质谱响应达到最佳,以甲醇-含0.1%甲酸的5 mmol/L甲酸铵溶液(50∶50,V/V)为流动相,采用“T”三通方式依次对5 种化合物的单标溶液进行优化。电喷雾正离子模式下一级质谱扫描,结果显示质量浓度为1 mg/L的毒死蜱、丁硫克百威、克百威和三羟基克百威标液可形成稳定的[M+H]+峰,在反应离子监测模式下优化碰撞能量等质谱参数后进行子离子扫描,将两对响应值高的碎片离子确定为定性及定量离子;但3,5,6-TCP在正离子模式下灵敏度低,负离子模式扫描可得到响应值高的[M-H]-峰。3,5,6-TCP结构相对稳定,无法形成灵敏度高,稳定性好的碎片离子,因此本实验结果表明3,5,6-TCP在表1质谱条件下产生的准分子离子m/z 196与其产生的碎片离子相同。因此将碎片离子m/z 196确定为定性及定量离子,此结果与Gao等[23]研究结果相同,优化后的质谱参数见表l。
2.2 不同提取体系优化
因毒死蜱和克百威在碱性和中性介质中易发生水解,在酸性溶液中较稳定[25],而3,5,6-TCP是极性较强的化合物,其pKa值为4.55,在水中溶解度高并且在水溶液中易解离[26]。在提取过程中加入适量酸所提供的H+可以通过抑制3,5,6-TCP的电离而降低其极性[16],因此pH值是影响提取效率的最重要的因素之一。
为增加目标化合物在有机相中的溶解度,实验在空白基质中添加量为50.0 µg/kg的5 种混合标准溶液,按照1.3.2节的方法处理后,通过用纯乙腈、含0.1%、0.5%、2.5%和5%的甲酸-乙腈体系溶剂提取,比较不同体积分数的甲酸对5 种化合物的提取效果。图1表明,当提取溶剂中不加甲酸时,5 种化合物的提取回收率都低于80%,在加入一定体积的酸后,各种化合物的提取回收率都不同程度的提高。其中当甲酸的体积分数为0.1%和0.5%时,5 种分析物提取回收率达到90%以上,而甲酸体积分数增加至2.5%时,毒死蜱、丁硫克百威、克百威和3-羟基克百威的回收率显著降低。为减少试剂用量,本实验选用体积分数为0.1%的甲酸-乙腈提取体系。

图1 甲酸体积分数对提取回收率的影响Fig.1 Effect of formic acid concentration on analyte recovery
2.3 线性范围与检出限检测结果
在已优化的仪器条件和方法测定条件下,用流动相配制一系列不同质量浓度的混合标准溶液进行测定,利用外标法对5 种化合物定量。以各目标化合物的质量浓度为横坐标(x,μg/L),定量离子对的峰面积为纵坐标(y)进行线性回归计算,得到的线性方程和相关系数见表2。结果表明,3,5,6-TCP和其余4 种化合物分别在1.0~1 000.0 μg/L和0.2~500.0 μg/L范围内的质量浓度和定量离子的峰面积呈良好的线性关系,线性相关系数范围为0.998 6~0.999 4。在空白样品中添加5 种化合物的标准溶液,以3 倍和10 倍信噪比确定化合物的方法检出限和定量限,结果如表2所示,样品中5种化合物的检出限范围为0.3~1.7 μg/kg,定量限范围为1.0~5.0 μg/kg。

表2 5 种化合物的线性方程、相关系数、检出限与定量限Table2 Linear equations, correlation coefficients (r), limits of detection (LODs) and limits of quantification (LOQs) of the analytes
2.4 方法的回收率和精密度实验结果
参考各个化合物的最高残留限量值,在未检出的稻米样品中分别添加3 个水平的混合标液,每个水平重复6 次,对方法的回收率和精密度进行考察。按照1.3.2节方法处理后进样,计算加标回收率和精密度,结果见表3。由表3可知,5 种化合物的平均回收率范围为72.0%~99.6%,相对标准偏差范围为0.6%~12.0%,回收率和精密度良好,可满足稻米中农药及代谢物残留量检测技术的需要。毒死蜱、丁硫克百威、克百威和3-羟基克百威的加标量为10 μg/kg,3,5,6-TCP添加量为25 μg/kg的条件下,空白样品的加标回收定量离子色谱图见图2。

表3 空白样品中5 种化合物的加标回收率和相对标准偏差(n= 6)Table3 Recoveries and relative standard deviations (RSDs) of the analytes spiked in blank samples (n= 6)
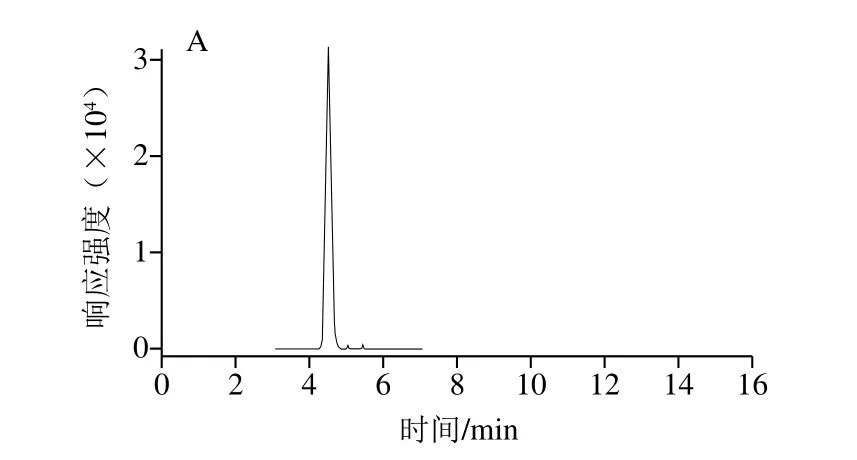

图2 空白样品添标回收的定量离子色谱图Fig.2 Typical SRM chromatograms obtained for spiked blank samples
2.5 实际样品测定结果
采用建立的液相色谱-质谱快速分析方法对各地购买的Y两优372、D95优华占、中嘉早17等10 个不同品种的60 份稻米样品进行测定。其中,每个品种抽出1 份样品加入添加量为10 μg/kg的标准溶液以测定加标回收率考察方法的可靠性和稳定性,剩余50 份用于测定样品中5 种化合物的实际含量。结果显示,10 个不同品种的水稻样品基质中5 种化合物的平均回收率为84.3%~97.5%,相对标准偏差为1.1%~6.4%,完全能够满足分析要求。毒死蜱和3,5,6-TCP在实际样品中的检出量分别为0.002~0.051 mg/kg和0.076~0.112 mg/kg,2 种化合物在样品中的提取离子色谱图见图3。丁硫克百威、克百威和3-羟基克百威在50 份样品中均未检出。

图3 毒死蜱(A)和3,5,6-TCP(B)在大米样品中的提取离子色谱图Fig.3 Extracted ion chromatograms for chlopyrifos (A) and 3,5,6-TCP (B) in polished rice sample
3 结 论
实验利用高效液相色谱-串联质谱法结合QuEChERS建立检测稻米中毒死蜱和丁硫克百威2 种农药及主要代谢物的检测方法。该方法通过比较提取溶剂中不同体积分数的甲酸对提取效率的影响,优化前处理提取过程。目前国内外关于利用气相色谱法[27]、液相色谱法[29]、气相色谱-质谱联用法[28]和高效液相色谱-质谱联用法[30]测定2 种农药的方法报道较多,但其检出限和定量限分别高于1.0 μg/kg和5.0 μg/kg,且无法实现同时测定稻米中毒死蜱和丁硫克百威及代谢物的残留量。尽管本实验所建立的技术对3,5,6-TCP分析灵敏度低于Gao等[23]分析水中代谢物的方法,但比张圆圆等[22]利用高效液相色谱-质谱联用法所得的灵敏度高。实验结果表明,各化合物在水稻基质中的回收率可满足基本的分析要求。本方法前处理过程简便、高效,具有准确性好、精密度高等优点,适用于稻米中毒死蜱和丁硫克百威两种农药及主要代谢物残留量的同时定性与定量分析。
