QuEChERS-超高效液相色谱-串联质谱法测定鸡蛋、鸡肉中氟虫腈及其代谢物残留
2019-01-28邵瑞婷贺小蔚
郝 杰,邵瑞婷,姜 洁,,贺小蔚
(1.北京市食品安全监控和风险评估中心,北京 100041;2.沃特世科技有限公司,北京 100026)
氟虫腈商品名为锐劲特,是法国Rhone-Poulenc公司开发的世界上首个苯基吡唑类杀虫剂[1],主要作用是通过与α-氨基丁酸受体结合,抑制氯离子通道,破坏中枢神经系统从而杀灭昆虫[2]。氟虫腈杀虫谱广,具有触杀、胃毒和中毒内吸作用,与现有的杀虫剂无交互抗性,对已产生常规杀虫剂抗性的害虫有较好的防治效果,可适用于水稻、玉米、棉花及其他广泛经济作物的虫害防治中[3-4]。氟虫腈自推出伊始,就被众多农药专家推荐为代替高毒有机磷农药的选择之一,成为农药界追捧的热点[5]。但随着使用的推广,关于氟虫腈及其在农产品中代谢产物的研究也越发深入,涉及到了剂量评估、毒性监测及环境友好度评价等多方面[6-8]。氟虫腈是一种化学性质活泼的化合物,在施用后,经过水解、光解等作用,会生成3 种代谢产物氟虫腈砜(MB46136)、氟虫腈硫醚(MB45950)和氟甲腈(MB46513)[9]。而经过对代谢物毒性的研究,这三者的毒性要高于氟虫腈原药[10],氟虫腈被世界卫生组织列为“对人类有中等毒性”的化学品。
鉴于氟虫腈对甲壳类水生生物和蜜蜂具有高风险,在环境中降解慢,在保护环境的大背景下,我国农业部于2009年发布公告停止生产销售氟虫腈农药[11]。同时在GB 2763—2016 《食品中农药最大残留限量》中,对植物源性食品中氟虫腈残留量进行了严格的限定[12]。国外方面,欧盟做出规定氟虫腈不得用于人类食品产业链的畜禽养殖过程,也做出了食品中氟虫腈限量的详细规定,包括动物源性食品鸡蛋和鸡肉中0.005 mg/kg的最大允许残留量[13]。但是近年来发现偶有因农药隐性添加而导致氟虫腈阳性检出的情况,而荷兰、德国等欧洲16 国及韩国等地更是爆出了大规模的氟虫腈污染鸡蛋的食品安全事件,并造成了广泛的恶劣影响[14]。
目前,测定食品中氟虫腈的测定方法主要有气相色谱法[15-16]、气相色谱-质谱联用法[17-19]、液相色谱-质谱联用法[20-23]等。GB 2763—2016中规定,氟虫腈的残留标志物为氟虫腈、MB46513、MB46136、MB45950之和;欧盟规定残留标志物为氟虫腈和MB46136之和,均涉及到氟虫腈代谢物的含量测定。而目前的标准方法和报道文献方法中大多集中在原药的测定上,仅有极少部分对氟虫腈代谢物的测定进行方法研究。Cheng Youpu等[24]使用QuEChERS(quick, easy, cheap, effective, rugged, safe)-超高效液相色谱-串联质谱联用法对氟虫腈原药及3 种代谢物进行测定,周昱等[25]使用固相微萃取-气相色谱和气相色谱-质谱联用法对原药和4 种代谢物进行测定,但以上这些研究均应用于蔬果茶叶中,目前鲜见动物源性食品中氟虫腈及其代谢物的测定方法有报道。
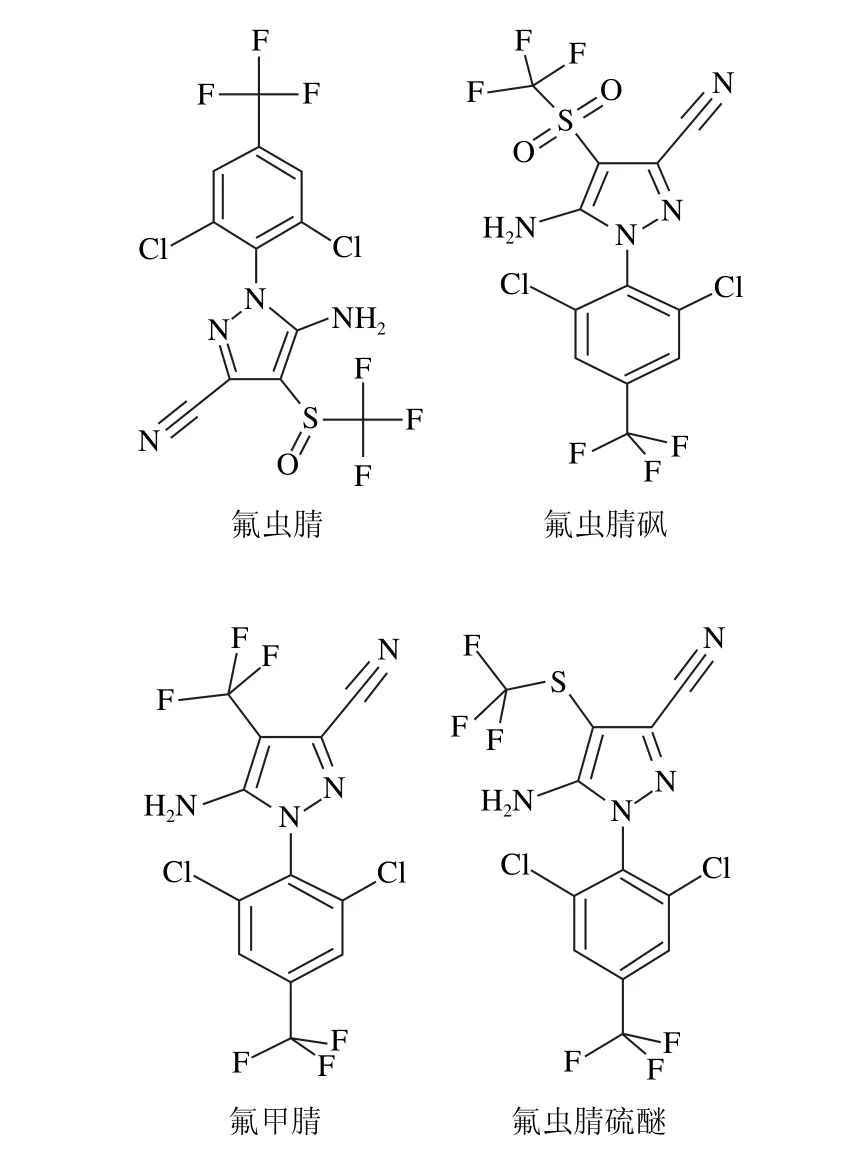
图1 氟虫腈及3 种代谢物结构式Fig.1 Structures of fipronil and its three metabolites
本实验运用QuEChERS法结合超高效液相色谱-串联质谱法,对鸡蛋、鸡肉等动物源性食品基质中氟虫腈以及MB46513、MB46136、MB45950等代谢物的测定进行研究。与常规方法相比,本方法提高了检测效率,扩大了适用范围,并能够监测法规所要求的全部残留标志物的含量。经方法验证,方法灵敏度、精密度和检出限均符合残留分析的要求。
1 材料与方法
1.1 材料与试剂
鸡蛋、鸡肉 市购。
氟虫腈、氟虫腈砜(MB46136)、氟虫腈硫醚(MB45950)、氟甲腈(MB46513) 德国Dr. E公司;甲醇、甲酸、乙酸铵(均为色谱纯) 美国Fisher公司;乙腈、无水硫酸镁、氯化钠、二水合柠檬酸钠、三水合二柠檬酸氢二钠(均为分析纯) 北京化学试剂厂;Oasis PRiME HLB固相萃取柱(6 mL/200 mg)美国Waters公司;实验用水为Milli-Q制备的超纯水。
1.2 仪器与设备
UPLC-TQ-S超高效液相色谱-串联质谱联用仪(配有电喷雾离子源及Masslynx 4.1 SCN 803软件) 美国Waters公司;X1R高速冷冻离心机 美国Thermo公司;Milli-Q纯水仪 美国Merck-Millipore公司。
1.3 方法
1.3.1 标准溶液的配制
准确称取各标准品于10 mL棕色容量瓶中,用乙腈溶解,定容至刻度,配制成1 000 μg/mL的标准储备液,转入棕色瓶中置于-20 ℃环境中保存。根据实验需要用乙腈稀释成混合标准工作液。
1.3.2 超高效液相色谱条件
色谱柱:Waters Acquity BEH C18(100 mm×2.1 mm,1.7 μm);流速 0.4 mL/min;柱温 35 ℃;流动相:A为甲醇,B为5 mmol/L乙酸铵溶液(含0.1%甲酸); 梯度洗脱条件:0~0.5 min 50%~70% A,0.5~3.0 min 70% A,3.0~3.5 min 70%~99% A,3.5~4.5 min 99% A,4.5~5.0 min 99%~50% A,5.0~6.0 min 50% A;进样量2 μL。
1.3.3 质谱条件
电喷雾电离源;负离子模式电离;多反应监测方式检测;毛细管电压1.00 kV;离子源温度150 ℃;锥孔气流量150 L/h;脱溶剂气温度450 ℃;脱溶剂气流量900 L/h。氟虫腈及其代谢物的色谱-质谱参数见表1。
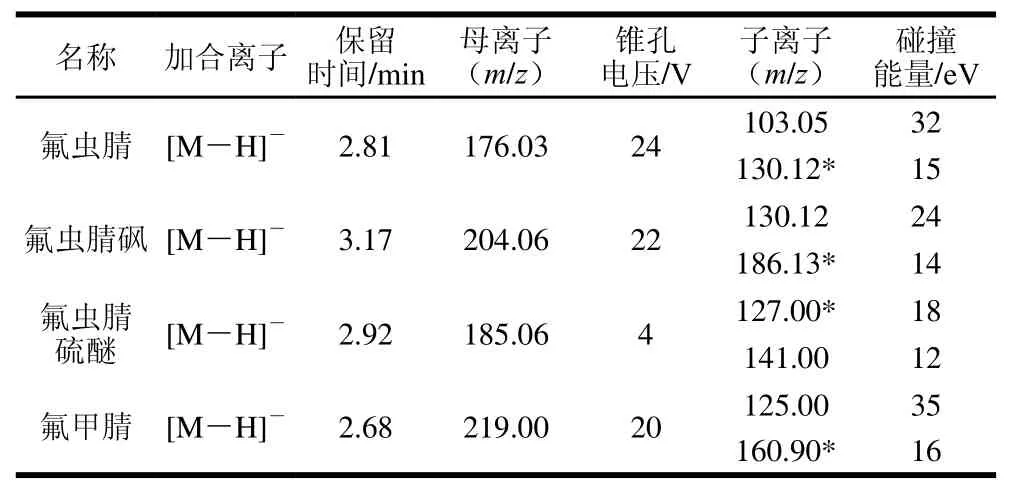
表1 氟虫腈及其代谢物色谱-质谱参数Table1 Chromatographic and MS parameters for fipronil and its metabolites
1.3.4 样品预处理
鸡蛋取内容物,充分打散后,10 000 r/min均质1 min。鸡肉样品搅碎后,10 000 r/min均质1 min。取2 g经充分均质的样品于50 mL旋盖离心管中,加入10 mL水充分涡旋进行分散后,加入10 mL乙腈,混匀后超声提取30 min,随后加入4 g无水硫酸镁、1 g氯化钠、1 g柠檬酸钠和0.5 g三水合二柠檬酸氢二钠,剧烈振摇1 min,于4 ℃、10 000 r/min离心4 min。取0.5 mL乙腈层和0.5 mL水充分混匀后过0.22 μm滤膜,上机测定。
1.4 定性、定量方法
定性方法:按照超高效液相色谱-串联质谱条件测定试样和标准工作溶液,记录试样和标准溶液中氟虫腈及代谢物的色谱保留时间,以相对于最强离子丰度的百分比作为定性离子对的相对丰度,记录浓度相当的试样与标准工作溶液中相应成分的相对丰度。当实验中检出与标准品的色谱保留时间一致的色谱峰,并且相对离子丰度允许偏差不超过GB/T 27404—2008中的规定范围,可以确定试样中检出相应氟虫腈或其代谢物。
定量方法:以基质加标标准曲线的系列质量浓度为横坐标,相应样品在仪器中各化合物色谱峰响应峰面积为纵坐标,做回归曲线。试样中定性检出目标化合物时,将对应色谱峰的响应峰面积代入回归曲线方程中,计算得到试样中该化合物的质量浓度。
2 结果与分析
2.1 超高效液相色谱-串联质谱分析
2.1.1 质谱参数的优化
分别配制30 ng/mL的各化合物标准品,使用电喷雾质谱用蠕动泵持续进样,与适当流速的流动相混合后注入质谱,对氟虫腈及代谢物分别进行质谱参数的确定。由于氟虫腈及代谢物结构中含有较多卤代基,在离子源内易形成负离子,且响应强度较好。因此选择较低的毛细管电压,以降低基质杂质可能带来的干扰。优化锥孔电压使得母离子丰度最大且稳定,开启碰撞气后,优化碰撞能量,选取响应丰度较高、易得到、出峰稳定的几个碎片离子作为子离子。再通过配制空白鸡蛋基质标准溶液,排除易受基质干扰的碎片,得到2 对监测离子对,选择响应丰度较高、干扰较少的作为定量离子对。
2.1.2 分离条件的选择
氟虫腈与其代谢物的化学结构极为接近,且极性均偏弱,在参考已报道的文献资料[26-29]的基础上,因此选择BEH C18色谱柱作为分离介质。对比使用不同流动相配比及梯度设置时,4 个化合物的保留时间和分离度参数。分别对比使用乙腈-水、乙腈-5 mmol/L乙酸铵溶液、甲醇-水、甲醇-5 mmol/L乙酸铵溶液、甲醇-5 mmol/L乙酸铵溶液(含0.1%甲酸)等流动相体系。保留时间结果如表2所示。可以看到使用甲醇-酸化缓冲液的体系时,4 个化合物的色谱行为有分离的趋势。调整洗脱梯度条件,使4个化合物能够达到基线分离,获得合适的色谱分离条件。图1为空白鸡蛋基质提取液添加1 ng/mL标准品所得的总离子流图。
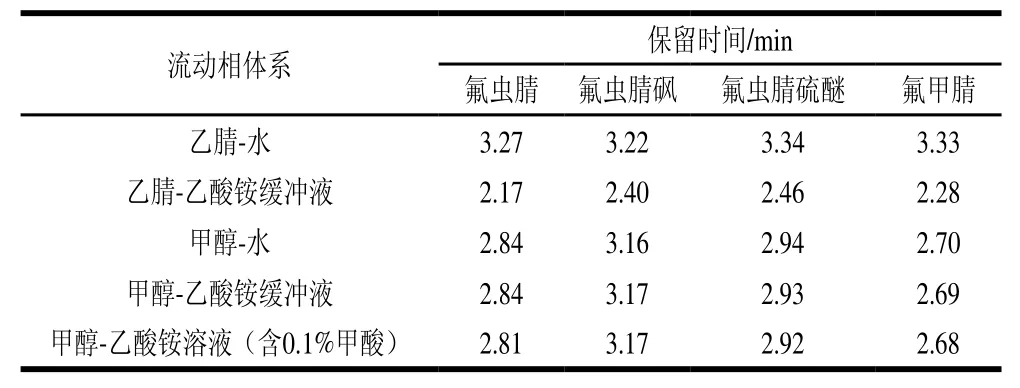
表2 不同流动相组成下各化合物保留时间Table2 Retention times for the analytes under different mobile phase compositions
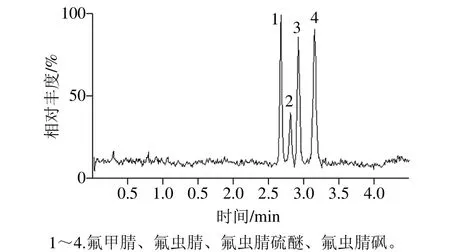
图1 优化条件下的色谱分离图Fig.1 Chromatographic separation under optimized conditions
2.2 前处理技术的优化
2.2.1 提取条件的选择
氟虫腈属于中等偏弱极性化合物,在提取过程中易溶解于有机试剂中。QuEChERS法[30]自发明以来,经不断发展,已成为农药残留分析的首选方法,但QuEChERS推荐方法均主要用于分析植物源性食品,因此,本实验对用QuEChERS法提取鸡蛋等动物源性食品中氟虫腈农药的条件进行比较优化。
实验对比使用乙腈或甲醇直接提取,以及使用QuEChERS法结合不同除水分散剂进行萃取的提取效率。制作添加量为2 μg/kg的加标样品,平行按下列方法分别提取:方法1:加入10 mL 0.2%甲酸-乙腈溶液提取;方法2:加入 10 mL乙腈提取;方法3:先加入10 mL水进行分散后,加入10 mL乙腈提取,使用5 g NaCl除水;方法4:按AOAC法,先加入10 mL水进行分散后,加入10 mL 0.2%甲酸-乙腈提取后,使用4 g MgSO4+1 g NaCl除水;方法5:按CEN法,先加入10 mL水进行分散后,加入10 mL乙腈提取,加入除水缓冲盐(4 g MgSO4+1 g NaCl+1 g Na3Cit+0.5 g 2Na2HCit·1.5H2O),所得的提取液不经净化直接上机测定。4种化合物的回收率对比如图2所示。
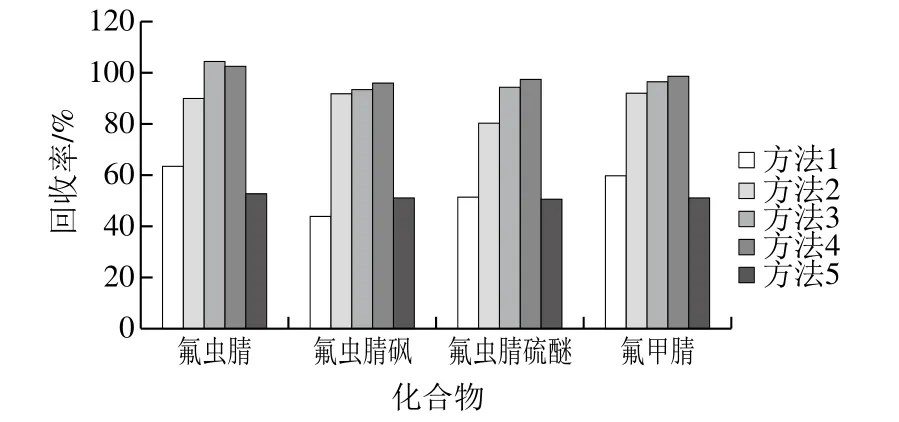
图2 不同提取条件下各化合物提取效率的对比Fig.2 Comparison of analyte recoveries using different extraction methods
从图2可以看出,使用QuEChERS法结合柠檬酸缓冲盐体系的提取效率最佳,这可能是因为QuEChERS法对样品的分散较好,另外,加入缓冲盐能够更加促进盐析过程,使化合物分配向有机相移动,从而提高了提取效率。
2.2.2 净化条件的选择
鸡蛋和鸡肉等动物源性食品,主要含有大量脂肪、蛋白质以及部分脂溶性基质杂质。通过基质分散乙腈提取,可以除去蛋白质的影响,冷冻离心过程可以去除脂肪的影响。针对其余痕量杂质的影响和去除手段,实验考察Waters Oasis PRiME HLB、Agilent EMR、Dikma ProElut PLS等净化方式,取2 mL提取液通过PRiME柱和PLS柱,接收馏出液;取2 mL提取液与50 mg EMR混匀1 min。分别取0.5 mL净化液于0.5 mL水混合后上机测定。从图3可以看出,各净化手段对目标化合物的回收率均无明显影响,同时对比净化前后的谱图,未见有显著杂峰对目标物有影响。采用基质添加样品(2 μg/kg),连续进样后,未见响应有明显变化,因此,采用不净化的方式,对提取液进行适当稀释,并在满足检出限的前提下降低进样量,以达到消除基质干扰的目的。
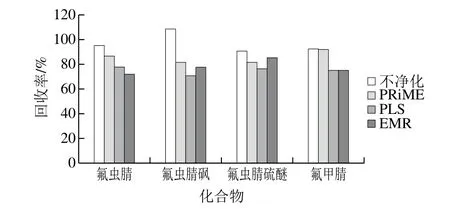
图3 不同净化条件下各化合物回收率对比Fig.3 Comparison of analyte recoveries using different clean-up methods
2.3 方法验证
2.3.1 基质效应
使用空白鸡蛋和鸡肉基质,进行样品前处理、得到空白基质溶液。使用空白基质溶液分别配制质量浓度为0.5、1、2、10、20、50 ng/mL的系列基质配制标准曲线和溶液标准曲线。按如下公式计算评价基质对各化合物的基质效应[31]:

式中:ME为基质效应;A为溶液标准曲线的斜率;B为基质匹配标准曲线的斜率。
若ME<1,则表现为基质抑制效应,ME>1,则为基质增强效应。由表3可知,氟虫腈在鸡肉中有基质抑制效应,氟虫腈砜在鸡蛋中有增强效应,其余基质效应不明显,在测定中可选择基质加标标准曲线法定量。

表3 鸡蛋和鸡肉中各化合物的基质效应Table3 Matrix effects of chicken eggs and meat
2.3.2 线性及灵敏度检测结果
取空白样品,制作分别为1、2、5、10、20 μg/kg的基质加标系列样品,在上述条件下,各化合物的定量离子均能达到信噪比大于10 倍,参考欧盟有关氟虫腈及其代谢物在鸡蛋和鸡肉中的限量值为5 μg/kg[13],且GB 2763—2016中规定其残留标志物为4 种化合物之和[12],因此,将4 种化合物的定量限均定为1 μg/kg,检出限为0.5 μg/kg。线性方程、决定系数、线性范围、检出限及定量限见表4。各化合物在1~100 μg/kg的范围内线性关系良好。
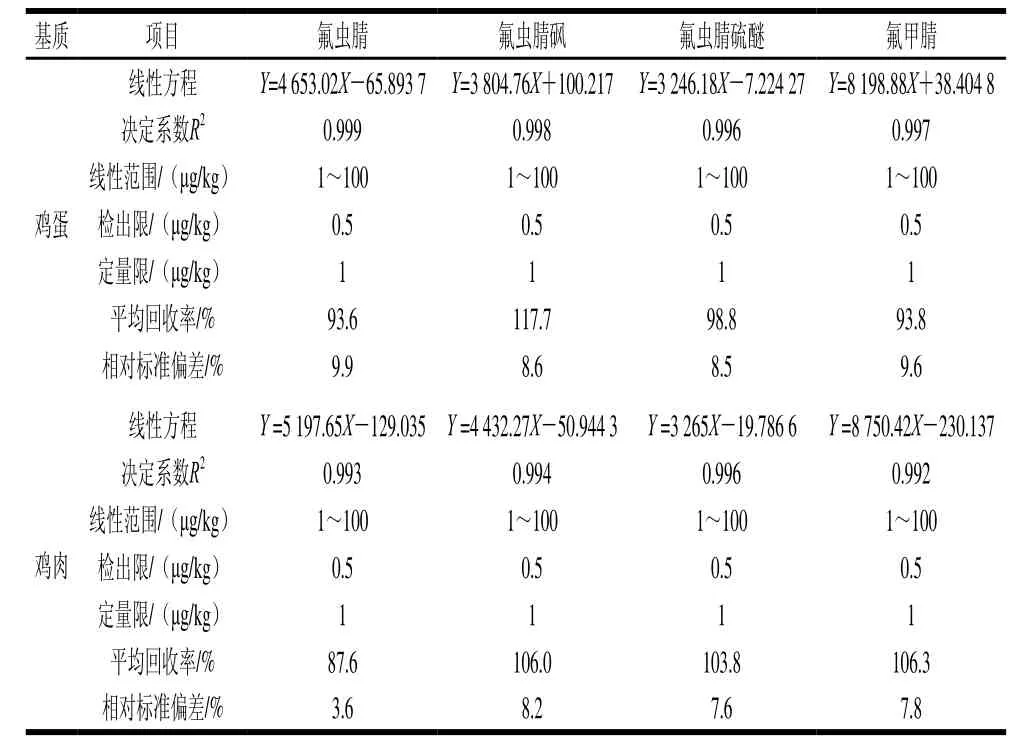
表4 氟虫腈及代谢物的线性方程、决定系数、线性范围、检出限、定量限、平均回收率(n= 6)及精密度数据Table4 Calibration equations, coefficients of determination, liner ranges, LODs, LOQs, average recoveries and precision (RSD, n = 6) for fipronil and metabolites
2.3.3 回收率和精密度实验结果
取空白鸡蛋和鸡肉样品,添加混合标准溶液后混合均匀,得到质量浓度分别为1(定量限)、5(限量值)、10 μg/kg(两倍限量值)3 个水平的基质加标样品,在优化后的条件下测定目标化合物。每个水平平行测定6 次,如表4可知,使用所建立的方法定量测定氟虫腈及代谢物,在鸡蛋中平均回收率为93.6%~117.7%,相对标准偏差为8.5%~9.9%,在鸡肉中平均回收率为87.6%~106.3%,相对标准偏差为3.6%~8.2%,参考GB/T 27404—2008《实验室质量控制规范 食品理化检测》附录F方法确认的技术要求中的相关内容[32],该方法满足残留检测的要求。
2.4 实际样品测定结果
随机抽取市售鸡蛋15 个、鸡肉10 个。应用建立的方法对样品进行测定,结果如图4所示,在某一鸡蛋样品中检出氟虫腈砜30.7 μg/kg。


图4 鸡蛋空白样品和阳性样品的定量离子提取离子流图Fig.4 Quantitative extracted ion chromatograms of standard, blank and positive samples
3 结 论
本研究采用QuEChERS法提取,超高效液相色谱分离,串联质谱法检测,建立鸡蛋、鸡肉中及其3 种代谢物的同步测定方法。与标准方法及已有报道相比,本方法涵盖了GB 2763—2016及欧盟限量规定中的氟虫腈的全部残留标志物检测,并通过色谱条件优化,稀释进样等手段,降低了基质干扰,简化了前处理耗时,达到了快速、准确、可靠的测定,为开展动物源性食品中相关农药残留测定进行探索。经方法学验证,该方法回收率、精密度、线性、测定低限等均满足残留检测方法确认的要求,适用于鸡蛋、鸡肉中氟虫腈及代谢物的快速定量测定。
