沙门氏菌重组酶聚合酶检测方法的建立及应用
2019-01-28刘立兵耿云云姜彦芬刘思颖孙晓霞南汇珠王建昌
刘立兵,耿云云,姜彦芬,刘思颖,孙晓霞,南汇珠,王建昌,
(1.河北出入境检验检疫局技术中心,河北 石家庄 050051;2.河北省检验检疫科学技术研究院,河北 石家庄 050051;3.河北师范大学生命科学学院,河北 石家庄 050024)
沙门氏菌(Salmonella)属于肠道菌科细菌,兼性厌氧菌[1],是一种能够导致人畜共患病的革兰氏阴性杆菌。在世界各国都属于常见的食源性致病菌,在细菌性食物中毒种类中,沙门氏菌引起的食物中毒事件常被列榜首[2-3]。沙门氏菌主要通过人和动物的消化道感染致病,潜伏期通常在4~8 h,引起呕吐、发热、腹泻等症状,在从而引起食物中毒、慢性肠炎等疾病;在中国,由沙门氏菌导致食物中毒事件占全国食物中毒事件的40%~60%[4];在欧洲每年有16万多人感染沙门氏菌,发病率约为0.035%[5];动物饲用了含有沙门氏菌的饲料,会引起鸡白痢、猪霍乱等相应的疾病,最终导致动物死亡[6]。因此,沙门氏菌一直是国内外细菌学领域研究的重点。
沙门氏菌广泛存在于自然界,在常温条件下就可繁殖生长,而且对营养条件的要求很低,在肉类、禽类、蔬菜,蛋类、豆制品中都检测到沙门氏菌[7-8],其中生肉是沙门氏菌污染的主要食品[9]。目前,沙门氏菌的鉴定方法主要采用传统的检测方法[10],分离培养和VITEK全自动鉴定系统,该方法检测周期长,过程费时费力,而且菌落形态受样品复杂程度影响较大,肠杆菌科细菌间的生化反应多有交叉,在检测特异性和敏感性方面有局限性[11]。随着分子生物学技术的发展,沙门氏菌的检测方法也出现了聚合酶链式反应(polymerase chain reaction,PCR)法[7,12]、实时荧光PCR法[13]、环介导等温扩增法[14],这些方法在快速检测和现场检测方面有一定的局限性。重组酶聚合酶扩增(recombinase polymerase amplification,RPA)是一种新型的等温扩增技术。该技术主要通过重组酶与引物结合形成的蛋白-DNA复合物,在双链DNA中定位同源序列,发生链交换反应形成并启动DNA合成,对模板上的目标区域进行指数式扩增。
沙门氏菌的表面有很多外膜蛋白,这些蛋白与细菌进入宿主上皮细胞的能力密切相关。有研究表明,沙门氏菌表面的侵袭蛋白(invasion protein,inv)起到关键性作用[15]。侵袭蛋白是由invA、invB、invC、invD和invE等基因编码组成,invA为沙门氏菌的主要毒力因子,在沙门氏菌的致病过程中起到重要作用[15-16],基于invA基因设计的引物鉴定沙门氏菌,具有属特异性[17]。本研究以invA基因序列为靶序列,设计特异性RPA引物,建立能够快速有效检测沙门氏菌的RPA等温检测方法。
本研究建立的RPA等温检测方法操作简单、反应快速,能够排除人为干扰、交叉污染等不可控因素对沙门氏菌检测的影响;该方法对仪器设备要求低,不需要大型的仪器设备,适合于偏远不发达地区的实验室对沙门氏菌的检测。同时,也为食源性致病的鉴定和检测提供了一个新的方向。
1 材料与方法
1.1 材料
1.1.1 菌株
本实验所用的菌株见表1。

表1 实验用菌株信息Table1 Information about the strains used in this study
1.1.2 材料与试剂
蔬菜、禽类中都能检测到沙门氏菌,而且生肉是沙门氏菌污染的主要食品[7-9],选取生活中常食用的鸡肉、羊肉和西兰花做为模拟样品,由本实验室提供。
Premix Ex Taq 宝生物工程(大连)有限公司;RAA试剂盒(基础型) 浙江泰晶生物科技有限公司;DNA纯化回收试剂盒、细菌基因组DNA提取试剂盒天根生化科技(北京)有限公司;缓冲蛋白胨水(BPW)、沙门氏菌显色培养基、营养肉汤 北京陆桥技术有限责任公司;引物及探针由生工生物工程(上海)股份有限公司合成。
1.1.3 仪器与设备
ABI 7500实时荧光PCR仪 美国ABI公司;DK-8D电热恒温水槽 上海一恒科技有限公司;NanoDrop 2000c核酸分析仪 美国Thermal公司;Fusion Fx5凝胶成像系统 法国Viber Lourmat公司;MIR253恒温培养箱日本三洋公司。
1.2 方法
1.2.1 引物设计
以沙门氏菌invA为靶基因,参考GeneBank上序列进行比对,确定保守序列。设计RPA特异性引物,目的片段大小为200 bp,同时参照文献[18]合成沙门氏菌实时荧光PCR的引物和探针。所有引物和探针由生工生物工程(上海)股份有限公司合成(表2)。

表2 引物探针序列Table2 Primers and TaqMan probe sequences
1.2.2 沙门氏菌的培养及基因组DNA提取
将沙门氏菌(CICC22956)菌株接种到10 mL的营养肉汤中,恒温培养箱37 ℃培养18 h,取菌液进行斜面划线接种至沙门氏菌显色培养基中,37 ℃恒温培养箱培养18 h,传代培养2 次,出现单菌落。
取沙门氏菌纯培养菌液1 mL加入到1.5 mL的离心管中,10 000 r/min 离心2 min,收集沉淀,将菌体沉淀按照细菌基因组DNA提取试剂盒所述方法提取细菌DNA,立即使用或-20 ℃保存备用。同时使用NanoDrop 2000C超微量分光光度计测定浓度。
1.2.3 RPA方法的建立
使用R A A试剂盒(基础型)配制单个反应体系,其中10 μmol/L的RPA-F和RPA-R各2 μL,A Buffer 12.5 μL,模板1 μL,ddH2O 30 μL。将上述47.5 μL体系混匀后加入到装有冻干酶制剂的反应管中,用移液器上下吹打至完全溶解,向反应管中加入2.5 μL B Buffer(280 mmol/L醋酸镁),盖紧后瞬时离心并涡旋后,放入38 ℃水浴锅中反应10、20、30 min和40 min。使用DNA纯化试剂盒对RPA产物进行纯化,取5 μL产物进行2%琼脂糖凝胶电泳并在Fusion Fx5中观察分析电泳结果。
1.2.4 实时PCR方法
按照文献[18]配制沙门氏菌实时PCR体系。反应体系:Premix Ex Taq 12.5 μL,10 μmol/L PCR-F和PCR-R各2 μL(终浓度为0.8 μmol/L),5 μmol/L PCR-Probe 0.9 μL(终浓度为0.18 μmol/L),模板1 μL,ddH2O 6.6 μL。将上述体系充分混匀后放入ABI7500实时荧光PCR仪中,反应程序设置为:95 ℃预变性30 s;95 ℃变性5 s,60 ℃延伸35 s,35 个循环,60 ℃收集荧光信号。
1.2.5 特异性和灵敏性实验
根据1.2.3节建立的最佳反应时间,以表1中所示菌株的DNA作为模板进行RPA反应,确定RPA反应的特异性。
取1 mL纯培养菌液提取的基因组DNA,进行10 倍梯度稀释,以1 µL为模板进行RPA反应,确定该方法的灵敏性。同时与已建立的实时PCR方法的敏感性作比较。
1.2.6 人工模拟污染样品检测
挑取培养的沙门氏菌单菌落于1 mL灭菌的生理盐水试管中,振荡混匀30 s,麦氏浊度仪测定1.00 个麦氏浊度,用生理盐水进行10 倍梯度稀释,选取10-5、10-6、10-7稀释度的菌液200 μL涂于沙门氏菌显色培养基上,并作3 个平行,用于计算纯培养菌的初始浓度。
取羊肉、鸡肉和西兰花样品,经GB 4789.4—2010《食品卫生微生物学检验 沙门氏菌检验》验证3 份样品沙门氏菌均为阴性,作为人工污染的样品,进行检出限分析。选择1~10、10~50、50~100 CFU范围内细菌分别添加到25 g羊肉、25 g鸡肉和25 g西兰花样品中,再添加到225 mL沙门氏菌增菌肉汤中,37 ℃培养,增菌6、8 h后分别取1 mL菌液参照1.2.2节进行细菌DNA的提取,取1 μL作为模板进行检测。
1.3 数据分析
采用1.2.3节建立的RPA方法和1.2.4节实时PCR方法,同时检测1.2.6节人工模拟污染样品的核酸,通过对RPA片段和实时PCR扩增曲线的分析,完成对不同样品、不同污染量和不同增菌时间的人工模拟污染样品的检测。
2 结果与分析
2.1 RPA反应时间的优化
以1 mL菌液提取的DNA为模板,进行RPA最佳反应时间实验,在200 bp处有一条特异性条带(图1),通过Bio1D软件定量分析,划定相同面积的扩增条带,进行产物量对比分析,20 min RPA产物量接近10 min产物量的2 倍,而20 min产物量与30 min和40 min的产物量没有显著差异,所以本研究RPA的最佳反应时间确定为20 min。

图1 沙门氏菌RPA检测时间优化结果Fig.1 Optimization of RPA reaction time for Salmonella detection
2.2 特异性实验结果
以沙门氏菌及表1中其他26 种食源性致病菌基因组DNA作为模板,进行RPA反应,结果表明,只有沙门氏菌出现特异性扩增条带,其他细菌均在200 bp处无扩增条带,说明该方法具有良好的特异性,具体结果如图2和表1所示。
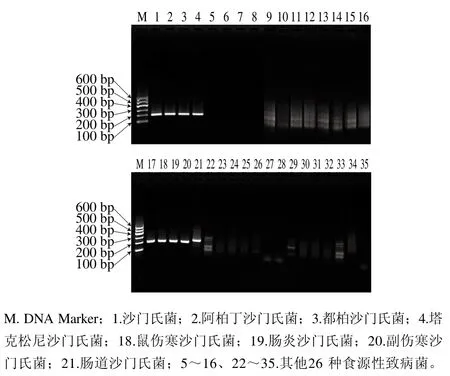
图2 沙门氏菌RPA检测特异性结果Fig.2 Specificity of RPA for Salmonella detection
2.3 灵敏性实验结果
提取1 mL沙门氏菌菌液的核酸,经核酸分析仪测定质量浓度为1.1×102ng/μL,将核酸进行倍比稀释至1.1×10-4ng/μL,分别进行RPA反应和实时PCR。结果表明,RPA反应当质量浓度为1.1×10-3ng/μL时有扩增条带,当质量浓度为1.1×10-4ng/μL时,无任何扩增条带,由此确定RPA反应的最低检测限为1.1×10-3ng/μL; 实时PCR在质量浓度为1.1×10-3ng/μL时检测结果Ct值在31,当质量浓度为1.1×10-4ng/μL时检测结果Ct值为35,无扩增曲线。由此可见,RPA反应和实时PCR的最低检测限一致,都为1.1×10-3ng/μL(图3)。

图3 沙门氏菌RPA和实时荧光PCR检测方法的敏感性实验结果Fig.3 Sensitivities of RPA and real-time PCR for Salmonella detection
2.4 人工模拟污染样品检测结果
人工污染沙门氏菌的羊肉、鸡肉和西兰花样品增菌后,RPA检测结果表明,当样品污染量为4 CUF/25 g,接种时间为6 h,羊肉、鸡肉和西兰花均未检出沙门氏菌,而当接种时间为8 h时,样品均检出沙门氏菌;当样品污染量为14 CFU/25 g,接种时间为6、8 h,羊肉、鸡肉和西兰花均检出沙门氏菌;当样品接种量为59 CFU/25 g,接种时间为6、8 h,所有样品均检出沙门氏菌。所有样品与实时荧光PCR检测结果一致,见表3。
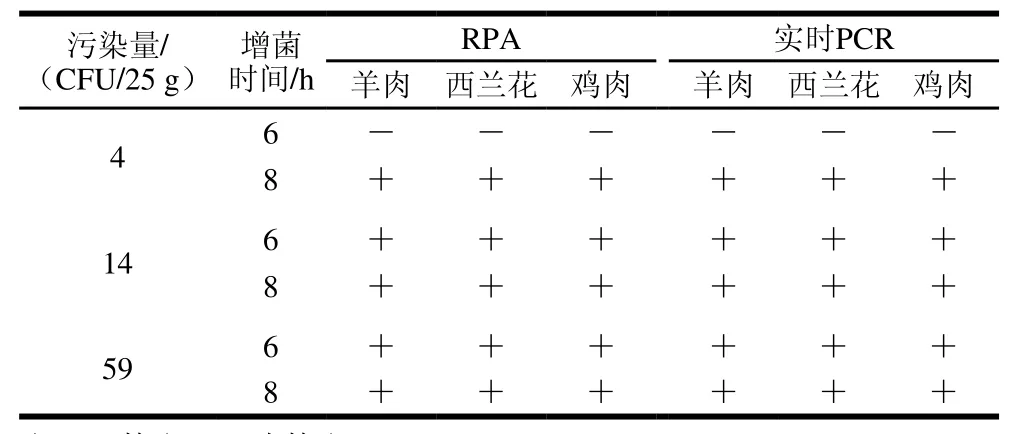
表3 人工污染样品RPA检测结果Table3 Detection of RPA in artificially contaminated samples
3 讨 论
在我国,每年都会发生食源性致病菌中毒事件,沙门氏菌是引起人和动物食物中毒的重要感染源,沙门氏菌的检测在食源性致病菌的检测中处于非常重要的位置。目前,沙门氏菌的检测普遍采用传统的检测方法,检测周期在4~6 d之间,检测周期长,操作复杂,需要经验丰富的检测人员,这些都不足以满足市场的需求。近几年,沙门氏菌的检测也建立了很多分子生物学的方法,如,武晓松等[7]建立了沙门氏菌PCR检测方法,并应用到蔬菜中沙门氏菌的检测;杜雄伟等[13]建立了实时荧光PCR检测肉制品中的沙门氏菌的方法;高琳等[14]建立了交叉引物等温扩增法和环介导等温扩增检测沙门氏菌的方法。但在食源性致病菌的检测方面,由于食品的成分复杂、食品中添加剂及培养基的成分复杂,都会对反应的Taq酶的活性起到一定的抑制作用,影响反应的扩增效率。Jacobsen等[19]研究表明,荧光定量PCR不能有效区分死菌和活菌,所以荧光定量PCR方法不适用于检测加热致死的菌体的样品;其次,这些检测方法都需要昂贵的检测仪器和专业的操作人员,且在快速检测、现场检测以及市场需求方面有一定的局限性。所以建立快速、精准、满足市场需求的检测方法,对我国沙门氏菌的检测非常重要。
RPA作为一种新型的快速检测技术,已经应用到各个领域。在病毒检测方面,Wang Jianchang等[20]建立了猪圆环2型病毒的RPA快速检测方法,并应用到临床样品的检测;在转基因方面,邓婷婷等[21]应用RPA检测转基因水稻中的Cry1Ab/c基因;在真菌方面,Ahmed等[22]应用RPA技术检测致病性钩端螺旋体(pathogenic Leptospira);在细菌方面,Euler等[23]应用RPA技术检测兔热病杆菌(Francisella tularensis)。在寄生虫[24-26]、食品安全[27]、生物安全[28]和癌症[29]等方面RPA技术都已经有研究。RPA是一种等温扩增技术,具有试剂易于保存、反应时间较短、操作简单等优点,并且对仪器设备要求较低,在水浴锅、保温杯,甚至手中即可进行反应[30],适合于食源性致病菌的检测,也便于推广到仪器设备比较匮乏的基层检测机构。
沙门氏菌invA基因具有属特异性,常作为沙门氏菌研究的靶基因,如Radhika等[31]根据invA基因设计了特异性检测致病性沙门氏菌的引物,并在非沙门氏菌中没有检测到invA基因;庞心怡等[32]根据invA基因建立的LAMP检测方法,比PCR方法的灵敏度高100 倍;魏琼[33]根据沙门氏菌的invA基因,建立了沙门氏菌、志贺菌和金黄色葡萄球菌的三重荧光定量PCR。本实验选择invA基因作为沙门氏菌检测的靶基因,设计特异性引物,建立了沙门氏菌的RPA检测方法,即38 ℃水浴锅反应20 min完成检测,特异性强,灵敏性达到1.1×10-3ng/μL。人工污染样品结果表明,经过8 h就可完成不同浓度沙门氏菌的检测。与传统的分离培养方法、实时荧光PCR法及环介导等温扩增方法相比,节约了成本、减少了反应时间、缩短了检测周期,RPA方法适合于食品中沙门氏菌的快速检测。RPA检测方法的建立,为食源性致病菌中沙门氏菌的检测提供了新的技术方向,对我国食品安全监控和进出口食品的检验具有重要意义。
