肾损伤因子-1在脂多糖诱导的HK-2细胞炎症反应中的作用
2019-01-24姜盈盈陈隆望林岳陈新国郑炎焱卢中秋
姜盈盈,陈隆望,林岳,陈新国,郑炎焱,卢中秋
(1.温州医科大学第三临床学院 温州市人民医院 急诊科,浙江 温州 325000;2.温州医科大学附属第一医院 急诊医学中心,浙江 温州 325015)
急性肾损伤(acute kidney injury,AKI)是一种原发性或者继发性导致肾脏功能急剧下降的综合征,是临床上最常见的危急重症之一。许多因素均可诱导AKI,脓毒症是造成重症患者AKI的主要原因之一,其中脂多糖(lipopolysaccharides,LPS)是最重要的诱导因素[1]。肾损伤因子-1(kidney injury molecule-1,KIM-1)是一种最早发现于非洲绿猴中的甲型肝炎病毒受体(he-patitis A virus receptor,HAVCR1)[2-3],后来研究发现也在人类中表达,主要表达于近端小管的受损上皮细胞中并且具有促进肾纤维化的作用[4],在正常人的肾组织细胞和尿液中均不能检测出[5]。虽然KIM-1在多种AKI患者的血清和尿液中检测出,并作为早期诊断的分子标志物,但是其本身的生物学作用以及对肾小管上皮细胞增殖和炎性反应的影响尚未见报道。本研究拟通过体外实验研究LPS处理人肾小管上皮细胞并分析KIM-1的表达在LPS诱导HK-2细胞炎症反应中的作用,以期为脓毒症AKI的诊断和预防探寻新的、简便和可靠的理论依据。
1 材料和方法
1.1 材料 人肾小管上皮细胞系HK-2细胞购于南京凯基生物科技有限公司;Hoechst33342/PI试剂盒购于南京凯基生物科技有限公司;LPS和CCK-8试剂盒购于北京索莱宝生物科技有限公司;兔抗人KIM-1多克隆抗体和兔抗人IL-6多克隆抗体购于美国Abcam公司;兔抗人GAPDH多克隆抗体、HRP标记的羊抗兔IgG多克隆抗体、预染蛋白Marker和ECL化学发光试剂盒购于北京康为世纪生物科技有限公司;TRIzol试剂、2×Taq PCR Mastermix、反转录试剂盒FastQuant RT Kit(With gDNase)、DNA Marker和BCA蛋白定量试剂盒购于北京天根生化科技有限公司;DMEM培养基购于美国Hyclone公司;胎牛血清购于杭州四季青生物工程材料有限公司。
1.2 方法
1.2.1 CCK-8实验:将生长覆盖率至90%左右的HK-2细胞用胰蛋白酶消化,重悬后铺种于96孔板中,铺种密度为103个细胞/孔。LPS处理组中加入不同浓度的LPS,对照组加入同体积无菌PBS缓冲液,转染组按照转染试剂说明书配置siRNA转染混合液后加入细胞培养板中,6 h更换含有100 μg/mL的LPS的完全培养基。5% CO2,37 ℃培养48 h后,加入10 μL的CCK-8溶液;加入CCK-8溶液继续培养4 h后,取上清液于450 nm处测定吸光度,根据同时间点各组OD值计算生长抑制率。
1.2.2 Hoechst33342/PI细胞凋亡双染实验:HK-2细胞生长至90%覆盖率,用胰蛋白酶消化后铺种于6孔板中,转染组于次日进行siRNA转染6 h后,处理组和转染组中加入100 μg/mL的LPS继续培养48 h,收集细胞后低速离心2 min,去上清液后加入1 mL培养基重悬浮细胞并加入10 μL的Hoechst33342荧光染料,混匀后37 ℃避光染色10 min,1 000 r/min离心5 min,去上清后加入1 mL的1×Buffer A,加入5 μL的PI荧光染料后室温避光染色10 min,荧光显微镜下观察并拍照。
1.2.3 RT-PCR实验:HK-2细胞经胰蛋白酶消化和悬浮后铺种于6孔板中,铺种密度为105个细胞/孔,处理组分别加入0、10、50和100 μg/mL的LPS,转染组加入siRNA转染混合液6 h后更换含有100 μg/mL的LPS的完全培养基,37 ℃,5% CO2培养48 h。按照TRIzol试剂说明书步骤提取RNA,核酸蛋白测定仪检测RNA溶液的OD260/OD280,按照cDNA合成试剂盒说明书步骤进行反转录反应,以及Taq酶混合液产品说明书配置PCR反应液,按表1所示引物序列设定扩增程序并进行PCR扩增反应。扩增完成后用2%的琼脂糖凝胶进行电泳分离,凝胶成像系统拍照后用Image J软件对电泳条带进行灰度值分析,并计算目的基因的相对表达量。

表1 RT-PCR引物序列
1.2.4 Western blot实验:药物处理和细胞转染方法同上,37 ℃,5% CO2培养48 h,收集细胞并加入含有PMSF的RIPA裂解液,于冰上裂解1 h后通过BCA法测定总蛋白浓度,加入Loading buffer后煮沸,取等量蛋白进行SDS-PAGE凝胶电泳后,进行半干法转膜和10%脱脂奶封闭,按照抗体说明书推荐比例对一抗进行稀释并于4 ℃对醋酸纤维素膜孵育过夜,PBST清洗后加入HRP标记的二抗室温孵育2 h,PBST清洗后并用ECL反应液孵育,暗室中进行曝光显影定影。
1.3 统计学处理方法 采用SPSS 19.0软件进行统计学分析。计量资料以 ±s表示,2组间比较采用t检验,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 细胞抑制率 HK-2细胞分别加入0、10、50和100 μg/mL的LPS溶液,作用24 h后加入CCK-8并检测细胞生存率,结果显示10、50和100 μg/mL浓度组的LPS均能抑制HK-2细胞增殖,差异均有统计学意义(P<0.05),见图1A。用终浓度为100 μg/mL的LPS溶液处理HK-2细胞,分别处理0 h、24 h和48 h后,CCK-8检测结果表明,在对照组中各时间段OD值差异无统计学意义(P>0.05);在LPS处理组中,处理24 h和48 h后细胞生长均受到一定程度的抑制,与0 h组相比差异具有统计学意义(P<0.05),见图1B。
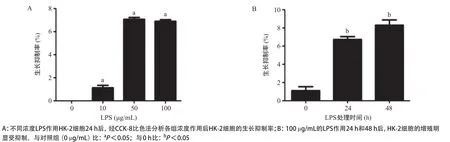
图1 LPS对HK-2细胞增殖的抑制作用
2.2 KIM-1蛋白和基因的表达 HK-2细胞加入终浓度为0、10、50和100 μg/mL的LPS处理48 h后,RT-PCR和Western blot实验结果提示,与对照组(0 μg/mL)比,LPS处理组中KIM-1基因和蛋白的表达均上调,差异均有统计学意义(P<0.05)。在LPS处理组中IL-6在mRNA和蛋白水平也出现上调表达,同时Western blot实验结果与RT-PCR结果一致,见图2。
2.3 细胞凋亡 HK-2经100 μg/mL的LPS处理48 h后,用胰蛋白酶消化并进行Hoechst33342/PI染色,荧光显微镜下观察细胞的荧光强度,实验结果显示对照组中Hoechst33342和PI都呈弱阳性,而在LPS处理组细胞中,Hoechst33342染色呈强阳性,PI染色呈弱阳性,提示LPS处理组细胞主要为细胞凋亡状态,见图3。
2.4 靶向KIM-1基因siRNA转染 HK-2细胞铺种于6孔板,次日转染靶向KIM-1基因的siRNA,6 h后更换含有100 μg/mL的LPS的完全培养基,细胞培养48 h后,RT-PCR和Western blot实验结果显示在siRNA转染组中,KIM-1基因的表达水平明显低于siRNA-NC组,同时IL-6的表达水平也明显低于对照组,差异均有统计学意义(P<0.05),见图4。
2.5 靶向KIM-1基因siRNA转染对增殖的影响 转染靶向KIM-1基因的siRNA的HK-2细胞加入100 μg/mL的LPS后分别培养24 h和48 h,CCK-8实验结果显示在siRNA转染组中,处理24 h和48 h后siRNA-1和siRNA-2组细胞增殖能力均强于siRNA-NC组,差异均有统计学意义(P<0.05),见图5。
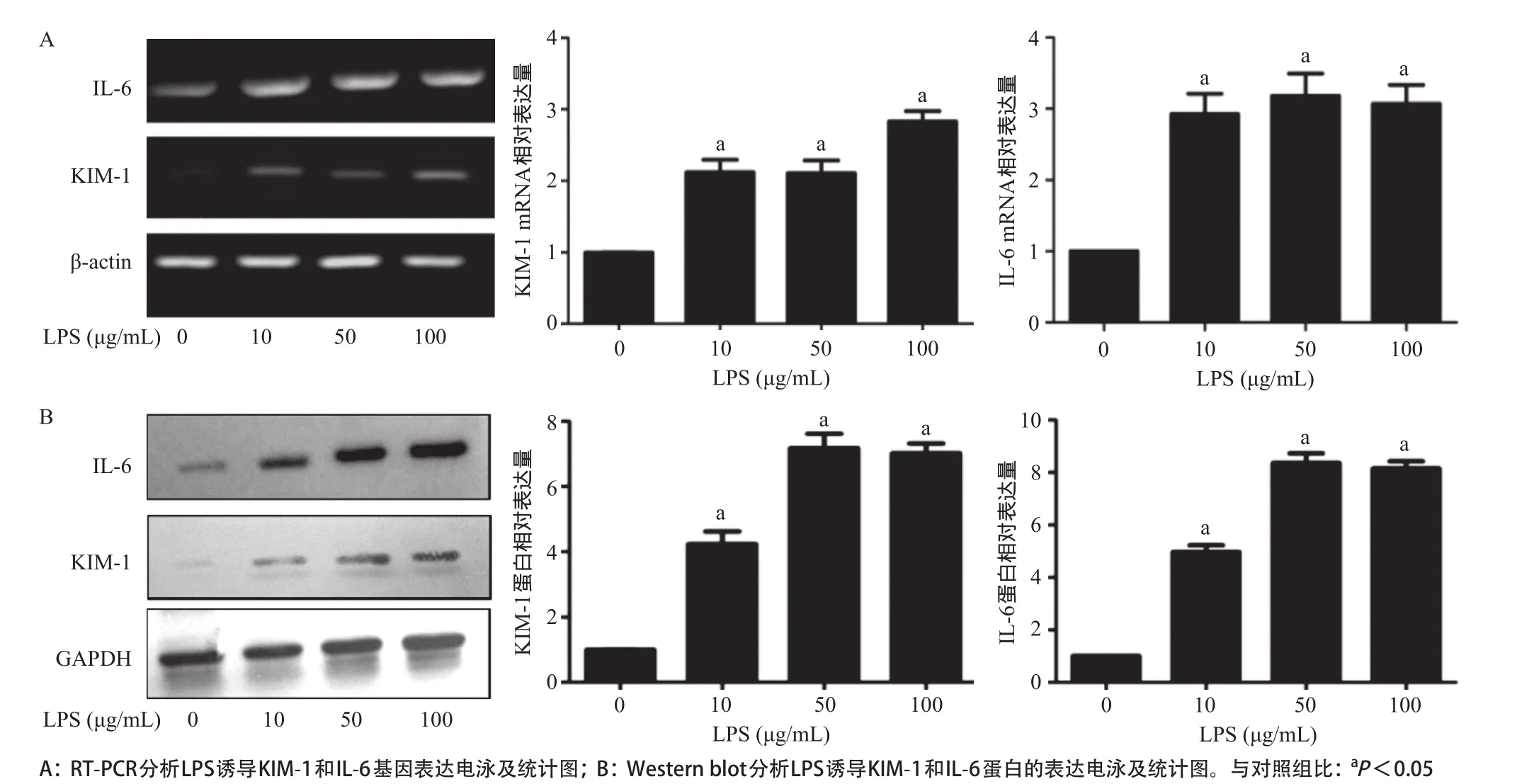
图2 不同浓度LPS处理HK-2细胞后对KIM-1和IL-6基因表达的影响
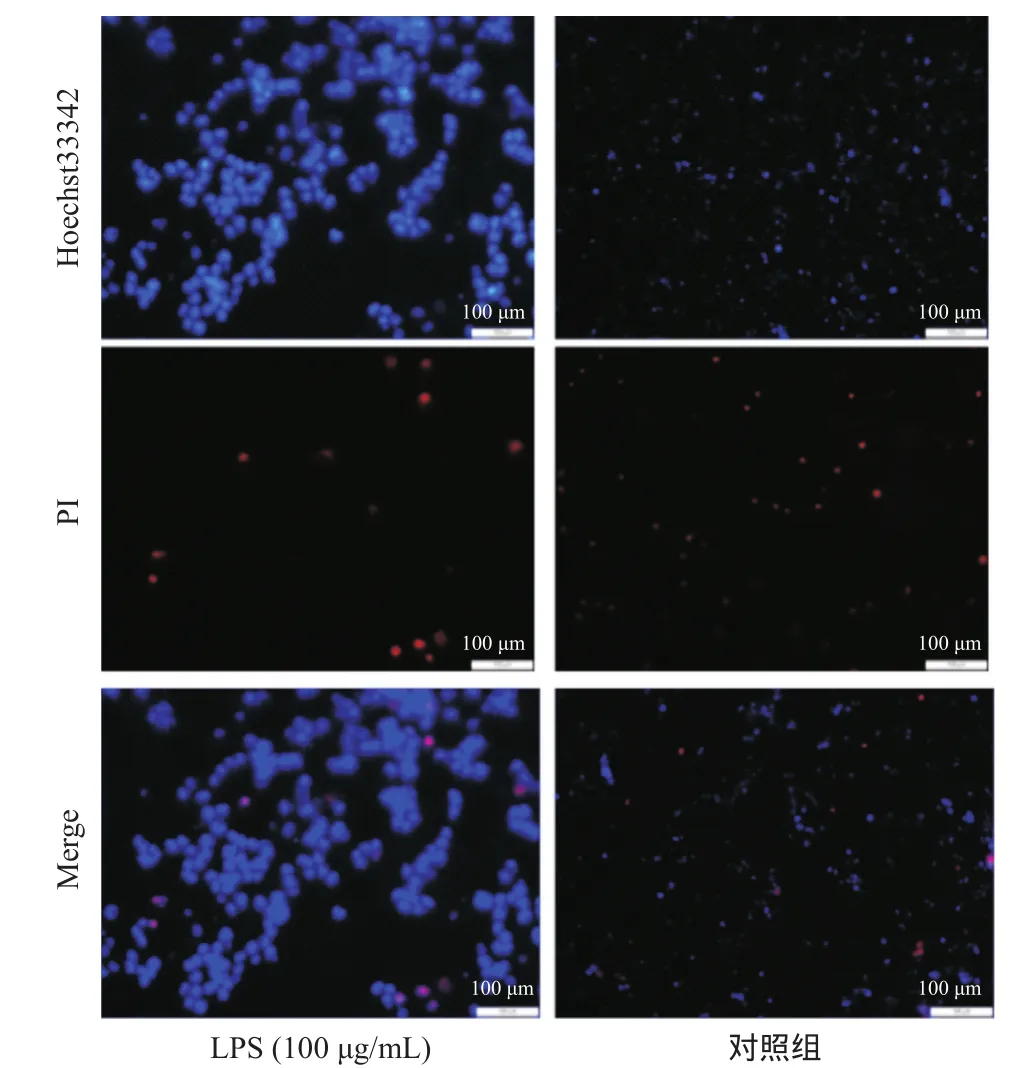
图3 Hoechst33342染色观察LPS处理对HK-2细胞凋亡的影响
2.6 靶向KIM-1基因siRNA转染对细胞凋亡的影响 转染靶向KIM-1基因的siRNA的HK-2细胞加入100 μg/mL的LPS后继续培养48 h,胰蛋白酶消化细胞成单细胞悬液,按照试剂盒说明书进行Hoechst33342染色,荧光显微镜下观察细胞的荧光强度并拍照,结果显示siRNA-1和siRNA-2组中Hoechst33342染色强度均低于siRNA-NC组,提示靶向KIM-1基因siRNA转染可以抑制LPS诱导的细胞凋亡,见图6。
3 讨论
KIM-1是一种跨膜糖蛋白,在各种诱因导致的肾损伤过程中表达上调,并且还与肾损伤修复、炎症细胞浸润及及肾纤维化过程有关。在脓毒症诱导的免疫应答过程中KIM-1出现表达上调,可能作为炎症介导因子参与多种慢性炎症疾病的发生发展。KIM-1是一种由上皮细胞受损后表达于细胞表面的免疫球蛋白超家族成员之一。KIM-1在受伤的上皮细胞中表达增加,并将上皮细胞转移至巨噬细胞处以清除细胞凋亡和坏死细胞,由KIM-1上调表达介导的受损细胞被吞噬细胞所吞噬将影响AKI严重程度[6]。
KIM-1作为一种指标,应用于近端肾小管损伤的早期检测,临床研究发现在确诊AKI患者的血清和尿液中KIM-1含量升高,较敏感,可以做为脓毒症AKI在早期诊断的指标。国内学者通过高糖条件体外培养大鼠肾小管上皮细胞,研究发现高糖组细胞KIM-1的mRNA和蛋白水平于12 h处理后明显上升,KIM-1基因的siRNA转染组细胞中单核细胞趋化蛋白1和纤维连接蛋白表达明显减少,研究结果提示KIM-1可能参与了糖尿病肾病肾间质纤维化进程[7]。还有研究证实HK-2细胞在缺氧复氧模型中KIM-1的表达与HIF-1α相关,而且HIF-1α可以与KIM-1基因启动子区相结合参与基因在转录调控,因此推测KIM-1作为HIF-1α下游分子参与肾损伤和修复过程[8]。
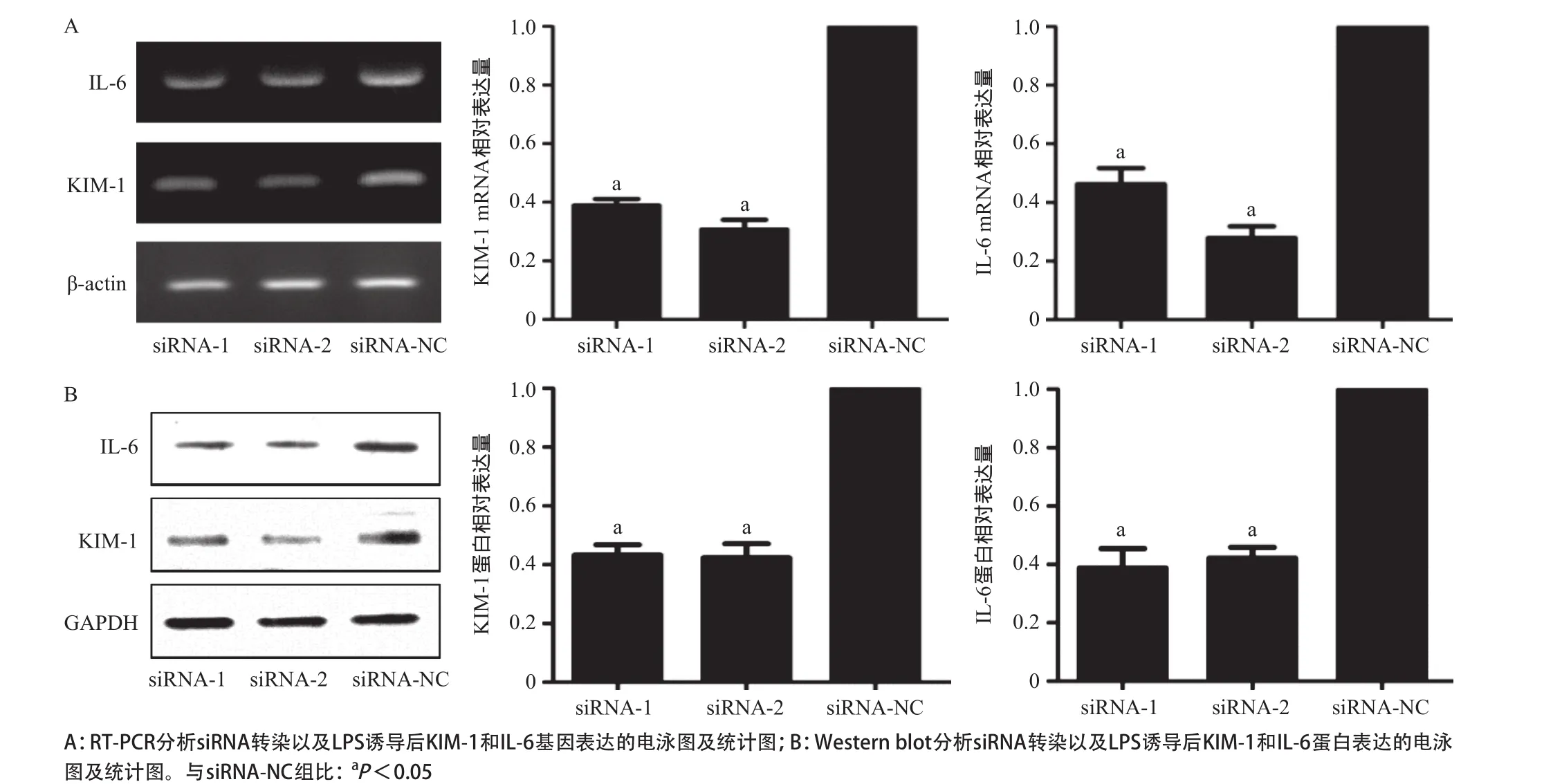
图4 LPS处理的HK-2细胞转染siRNA后对KIM-1和IL-6基因表达的影响

图5 siRNA转染和LPS处理不同时间对HK-2细胞增殖的影响
本研究通过体外实验建立LPS诱导HK-2细胞炎症模型,研究KIM-1在LPS介导的炎症过程中可能发挥的生物学作用及参与的信号途径。结果显示,LPS处理的HK-2细胞出现KIM-1基因mRNA和蛋白水平的上调表达,但是参与的信号途径尚未阐明,不过有报道指出肾素-血管紧张素系统(RAS)和MAPK活化诱导的肾损伤可介导KIM-1的表达,并且RAS阻断剂和p38 MAPK激酶抑制剂可以调节KIM-1的表达[9]。LPS通过诱导MAPK信号途径活化介导下游分子的转录调控已经得到广泛的研究,大肠杆菌LPS通过MAPK活化诱导肠道上皮细胞热休克蛋白25的表达[10],LPS通过激活PI3K/Akt和MAPK信号途径激活Smad途径,通过诱导肝星状细胞转化从而发挥促肝纤维化作用[11],LPS诱导小鼠牙周膜成纤维细胞表达MMP-13需要先通过活化p38信号途径,从而介导转录调控[12]。因此,可以推测LPS可能通过诱导p38 MAPK激酶信号途径活化介导KIM-1的转录翻译调控。

图6 siRNA转染对经LPS处理的HK-2细胞凋亡的影响
IL-6是一种促炎细胞因子,可通过与细胞中IL-6受体结合可溶性刺激靶细胞并介导缺血性AKI和AKI小鼠肺损伤[13-14]。IL-6在缺血性AKI中的作用机制可能与肾小管细胞中反式信号转导和STAT3激活有关[15]。在通过药物干预炎症反应的研究中,有学者报道深低温治疗可以通过抑制STAT-3的磷酸化以及下游IL-6和TNF-α的表达,从而缓解由LPS诱导的小胶质细胞炎症反应,有效保护神经功能[16]。吡格列酮通过调节NF-κB/STAT3、CREB/BDNF途径和中枢5-羟色胺能神经传递,从而减轻LPS诱导的抑郁样行为[17]。在本研究中,LPS处理的HK-2细胞表现出增殖受抑制,并且伴随KIM-1和IL-6 mRNA和蛋白水平的上调表达,但是尚未对其是否存在转录调控作用及其分子机制做相关研究,根据文献报道可能是通过由LPS激活NF-κB/STAT3信号途径活化所介导。本研究实验结果显示KIM-1的下调表达对IL-6的表达水平具有一定的干预作用,但是IL-6的表达水平是否依赖于KIM-1目前尚未见报道,涉及到的信号途径以及转录调控机制需进一步研究。
