膜微粒抑制缺氧无血清诱导的骨髓间充质干细胞的凋亡
2019-01-24金培峰姜盛翁家侃王磊丁露赵凯翔孙成超
金培峰,姜盛,翁家侃,2,王磊,丁露,赵凯翔,孙成超
(1.温州医科大学附属第一医院 心胸外科,浙江 温州 325015;2.浙江大学医学院附属邵逸夫医院 心胸外科,浙江 杭州 310000;3.温州医科大学 机能中心,浙江 温州 325035)
研究表明在心肌梗死(myocardial infarction,MI)后移植骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)能够有效改善心功能[1-2]。由于MI部位的缺血缺氧,在细胞移植后的24 h后BMSCs的凋亡率达到了37.3%,使细胞移植的治疗效果受到严重影响[1],虽然通过基因转染、添加生物因子能提高BMSCs的抗凋亡能力[3],但存在潜在的致癌、细胞毒性的等缺点。因此寻找一种安全有效的提高BMSCs抗凋亡能力的方法,成为亟需解决的问题。
细胞膜微粒(microparticles,MPs)是细胞在激活或凋亡过程中从细胞膜上释放的直径0.1~1.0 μm的膜包裹的小囊泡,包含着原来细胞中所含的多种信号分子、膜脂类、细胞因子、miRNA、DNA、RNA、蛋白质等物质,有广泛的生物学功能[4]。如血液循环中的血小板MPs、内皮细胞MPs,淋巴细胞MPs等在促进血管新生、内皮祖细胞的分化、抑制靶细胞的凋亡中起着非常重要的作用[5]。本研究利用MI后血液循环中的MPs来预处理BMSCs,提高BMSCs的抗凋亡能力,从而改善BMSCs移植治疗MI的效果。
1 材料和方法
1.1 材料
1.1.1 实验动物:32只雌性SD大鼠(体质量200~220 g)用来制作MI模型;3只雄性SD大鼠(体质量60~80 g)用来培养BMSCs。实验动物均由温州医科大学动物实验中心提供,动物使用批准号为SCXK(浙)2015-0001。
1.1.2 主要试剂:IMDM培养基(美国Gibco公司),胎牛血清(美国Gibco公司),AnnexinV/PI凋亡流式试剂盒(美国BD公司),胰酶(美国Sigma公司),厌氧产气袋(日本三菱公司),AZD5363(上海碧云天公司),Evans blue(美国Sigma公司),Hoechst33258试剂盒(美国BD公司),Tunel检测试剂盒(美国罗氏公司),PKH26(美国Sigma公司)。
1.2 方法
1.2.1 大鼠MI模型制作:将雌性SD大鼠在水合氯醛麻醉下和小型动物呼吸机辅助通气下,左进胸结扎左冠状动脉前降支,制作大鼠MI模型[6]。
1.2.2 MI后血液MPs的提取和定量:在大鼠的MI模型建立后的24 h用水合氯醛对大鼠腹腔进行注射麻醉后进行全身肝素化。常规消毒铺巾后,打开腹腔后于腹主动脉取血,将采集到的血液在4 ℃的条件下,分别经过不同转速的梯度离心法去除血细胞、血小板、血浆,从而获取血液中的MPs,最后将MPs用PBS重悬后分装,并用于后续的实验[7]。为明确MI的面积,在大鼠处死后取出心脏,并用Evans blue生物染色剂对心脏进行灌注染色。为明确所获取的血液中MPs的浓度并用于后续的实验,将获得的MPs使用BCA法来测定蛋白浓度,得出其浓度为(2.00±0.23)μg/mL,并将各个样本的蛋白浓度统一调整至2 μg/mL用于后续的实验。
1.2.3 BMSCs的培养:体质量60~80 g的大鼠处死后在无菌条件下分离大鼠的股骨和胫骨,以全骨髓贴壁法分离并培养BMSCs[8],每间隔48 h换一次含10% FBS的IMDM培养基,当细胞密度达到80%~90%融合时,按照1∶2的比例传代培养,取生长状态良好的第3代BMSCs用于本实验研究。
1.2.4 BMSCs对MPs的摄取作用:将获取的MPs用PKH26进行染色后,添加到生长良好的第3代BMSCs的细胞爬片中共培养8 h,再将细胞爬片固定后,用DAPI对细胞核复染,在激光共聚焦显微镜下观察。
1.2.5 细胞凋亡模型的建立和MPs的预处理:当第3代细胞生长达到70%~80%融合时用PBS冲洗2次,加入无血清的IMDM培养基及缺氧处理(置于密闭缺氧罐中,内置耗氧剂),置于37 ℃、5% CO2细胞培养箱内培养6 h。其中正常组(Control组)为完全培养基(IMDM+10% FBS)正常培养;BMSCs在进行缺氧无血清处理前不添加MPs的为阳性对照组(Hypoxia/SD组);将获取MI后血液来源的MPs(浓度为2 μg/mL)来对BMSCs进行预处理12 h,后再进行缺氧无血清处理6 h作为MPs组,再利用Annexin V-FITC/PI染色进行流式细胞仪检测。另外为明确不同浓度下的MPs对Hypoxia/SD条件下BMSCs的抗凋亡效果,分别按照正常浓度(2 μg/mL MPs组)、中等浓度(1 μg/mL MPs组)和低浓度(0.5 μg/mL MPs组)对BMSCs进行预处理后再进行Hypoxia/SD条件下的凋亡处理,并再利用Annexin V-FITC/PI染色进行流式细胞仪检测。
1.2.6 凋亡细胞的形态学检测、Tunel和Westernblot检测:将进行缺氧和无血清处理后的细胞用PBS洗1次,然后加入含Hoechst33342的无血清DMEM培养基,Hoechst33342终浓度为0.1 g/L,室温避光反应10 min。用相差显微镜和荧光显微镜观察,紫外光激发,观察凋亡细胞并拍片。在凋亡细胞的
Tunel检测中,将凋亡处理的BMSCs固定后,加50 μL Tunel反应混合液,充分反应后,再用DAB显色液进行显色。最后按常规方法进行苏木精复染,盐酸乙醇分化,自来水蓝化,系列乙醇脱水,二甲苯透明,封片,显微镜下观察。收集各组经过凋亡处理的细胞,提取蛋白后,用BCA蛋白定量试剂盒测定蛋白浓度,并按20 μg每孔上样,SDS-PAGE电泳,随后将分离的蛋白转膜至PVDF膜上,并经过5%脱脂牛奶室温封闭,分别经过一抗和二抗的孵育,再次洗膜,ECL发光,胶片显影、定影,每个样本重复3次。用Quantity one软件分析条带灰度值,以目的蛋白caspase-3和cleaved-caspase-3的灰度值和内参β-actin的灰度值的比值代表其相对含量。相对灰度值=cleaved-caspase-3/caspase-3,表示cleavedcaspase-3相对含量高低,反应凋亡情况。
1.2.7 细胞凋亡的相关信号通路检测:为明确MPs抑制缺氧无血清诱导的BMSCs凋亡的机制,在信号通路研究中,在MPs预处理前1 h添加1.5 μL AKT信号通路阻断剂AZD5363,经过缺氧无血清凋亡处理后收集各组细胞,用Annexin V-FITC/PI染色进行流式细胞仪检测。
1.3 统计学处理方法 采用SPSS16.0统计软件对数据进行统计学分析。计量资料用 ±s表示,2组间比较用t检验,多组间比较用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 MI面积确定 左室前壁由于前降支的梗阻染色阴性,其MI面积为(37.63±2.06)%,达到本研究要求。
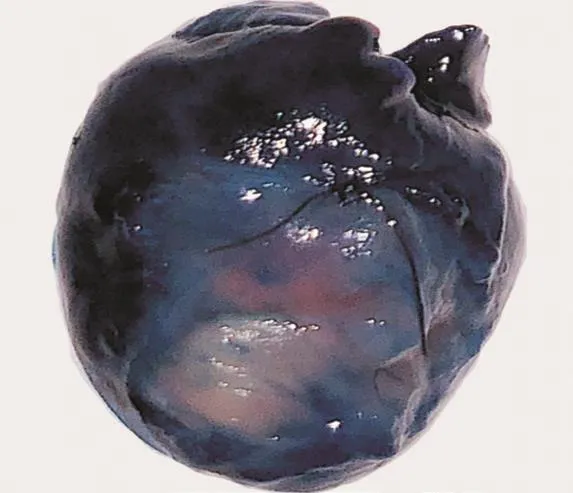
图1 蓝色未着色区域为梗死区域(Evans Blue染色)
2.2 BMSCs对MPs的摄取结果 在对BMSCs和MPs进行共培养8 h后利用激光共聚焦显微镜观察可见细胞质内充满了点状的红染的MPs,见图2。
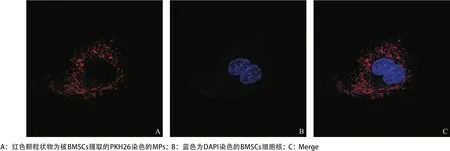
图2 BMSCs摄取经PKH26染色的MPs的激光共聚焦显微镜观察结果(×200)
2.3 MPs对低氧无血清诱导BMSCs的凋亡抑制结果 BMSCs在经过缺氧无血清诱导6 h后发生了细胞凋亡,其主要表现为细胞核的固缩、染色质浓集、细胞变小;MPs能够有效减少低氧无血清诱导BMSCs凋亡细胞的数量,差异有统计学意义(P<0.01),见图3。与MPs组比,Hypoxia/SD组cleavedcaspase 3表达量明显增加,差异有统计学意义(P<0.01),见图4。
2.4 AZD5363抑制MPs抗凋亡结果 与Hypoxia/SD组比,MPs能有效减少缺氧无血清环境诱导的凋亡,差异有统计学意义(P<0.01);与Hypoxia/SD组比,0.5 μg/mL MPs组也有显著的抗凋亡作用,差异有统计学意义(P<0.05),MPs的抗干细胞凋亡作用具有浓度依赖性;AZD+2 μg/mL MPs组的凋亡率显著低于AZD组,差异有统计学意义(P<0.01)。见图5。
3 讨论
MI后MI部位缺血缺氧的微环境是导致移植的BMSCs凋亡的主要原因,从而使BMSCs移植治疗MI的效果受到了很大的限制,因此如何安全而有效地抑制BMSCs在MI部位的凋亡,提高干细胞移植的治疗效率,成为急需解决的问题。MPs可以利用所包涵的miRNA、蛋白等物质介导信息传递,在组织修复、细胞信号传导等起着非常重要的作用[4]。MI后由于机体血流动力学和内环境的剧烈改变,机体产生的MPs会被释放入血,导致外周血液中MPs会大量增加[9],而且研究表明血液中MPs所包含的miRNA,如miR-133a、miR-21等,在促进血管新生、内皮祖细胞的分化、抑制靶细胞的凋亡中起着非常重要的作用[10]。因此在本研究中,我们利用MI后的血液中的MPs的这一特性来对BMSCs进行处理,发现其能有效抑制缺氧无血清诱导的BMSCs的凋亡,并且其抗凋亡的作用呈现浓度的相关性,在生理状态浓度下,其抗凋亡效果最佳。
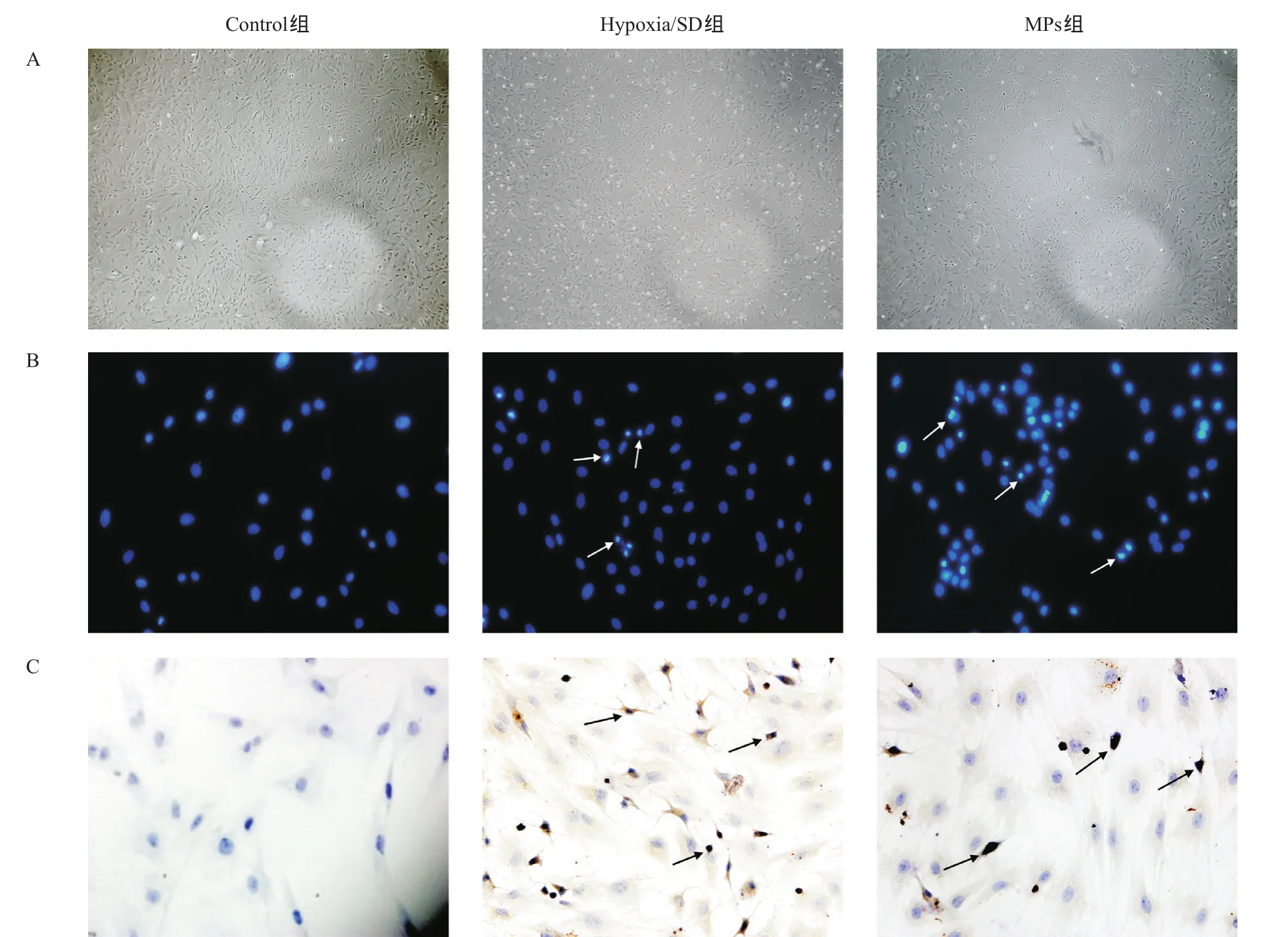

图3 分别利用相差显微镜、Hoechst33342和Tunel染色的方法来观测各组细胞的形态学变化及凋亡细胞的阳性率
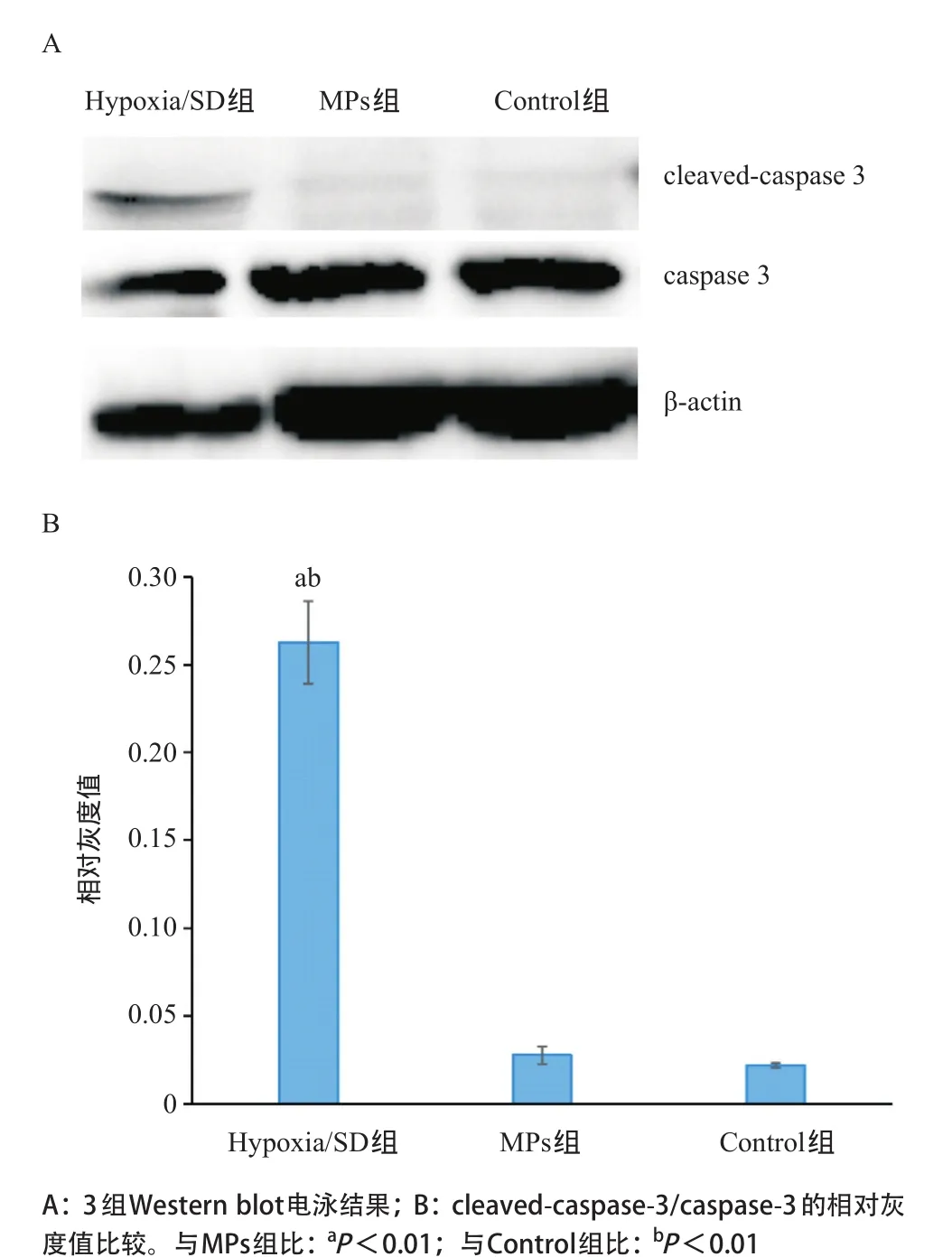
图4 各组cleaved-caspase-3和caspase-3的表达及相对灰度值比较

图5 不同浓度MPs抑制低氧无血清诱导的BMSCs的凋亡和AZD抑制MPs作用的流式细胞仪检测结果及凋亡细胞比例统计
由于MPs可以自体来源,并且在MI后MPs的量能够显著地增加,很好地解决免疫排斥和来源问题,相对于已有的基因转染、添加生物因子来提高BMSCs生物学功能的方法可能存在的致癌、细胞毒性等缺点,MPs在生物安全性方面更加可靠。并且有研究表明MPs对于靶细胞的表观改变是稳定的[11-12],因此MPs是能够成为提高BMSCs抗凋亡能力而改善移植治疗效率的理想因子。
Akt可以通过下游多种途径对靶蛋白进行磷酸化而发挥抗凋亡作用,其可以激活IκB激酶(IκKα),导致NF-κB的抑制剂IκB的降解,从而使NF-κB从细胞质中释放出来进行核转位,激活其靶基因而促进细胞的存活。而AZD5363作为Akt信号通路的抑制剂,能够有效抑制Akt的磷酸化,因此能阻断Akt抗凋亡的信号通路作用。在本研究中AZD+2 μg/mL MPs组的凋亡率显著低于单纯AZD5363预处理后的AZD组,表明MI后血液中的MPs能够有效抑制AZD5363的拮抗作用,表明MPs抑制BMSCs的凋亡作用可能主要通过激活Akt信号通路来实现的。
本研究表明MI后血液中提取的MPs能有效地抑制干细胞在缺氧无血清环境中的凋亡,为今后提高MI后移植BMSCs的治疗效果提供了新的思路。
