CD56阳性对急性早幼粒细胞白血病患者预后的影响
2019-01-24陈月苗俞康郑翠苹周文锦刘珍
陈月苗,俞康,郑翠苹,周文锦,刘珍
(1.温州医科大学定理临床学院 温州市中心医院 血液化疗科,浙江 温州 325000;2.温州医科大学附属第一医院 血液内科,浙江 温州 325015)
CD56抗原通常被认为是神经轴突黏附因子的异构体,CD56抗原表达赋予肿瘤细胞高侵袭性,在中枢神经系统肿瘤多见,而在造血系统肿瘤中亦常出现髓外浸润[1]。部分研究认为,在急性早幼粒细胞白血病(acutepromyelocytic leukemia,APL)患者中CD56抗原阳性可能同高复发率和不良预后有关[2-3]。但目前未见CD56抗原相关的APL治疗建议。本研究分析以全反式维甲酸(all-transretinoic acid,ATRA)联合蒽环类为基础化疗方案的APL患者的临床资料并对其进行远期随访,探讨CD56抗原在APL患者中的表达情况及预后意义。
1 资料和方法
1.1 临床资料 收集温州市中心医院2007年5月至2012年10月间收治的初诊APL患者64例,均经骨髓细胞形态学、组织化学染色、免疫表型分析、细胞遗传学t(15,17)和(或)分子生物学(PML-RARa)检测明确诊断[4],且患者无明显心肺、肝肾等器官功能障碍。64例患者中,男34例,女30例,男女比例为1.1∶1,中位年龄38.5(15~82)岁。所有患者均采用ATRA联合蒽环类药物为基础的方案进行诱导分化治疗,具体为:ATRA 45 mg/(m2·d),分次口服至完全缓解(complete remission,CR);去甲氧柔红霉素12 mg/(m2·d),第1~第3天,静脉注射;必要时加用三氧化二砷10 mg,1次/d。行鞘内注射预防中枢神经系统白血病。巩固方案采取ATRA联合蒽环类或蒽环类单药治疗,维持方案采取ATRA和亚砷酸交替疗法。本研究经本院伦理委员会批准。
1.2 分组方法 根据流式细胞术测定的患者骨髓CD56抗原的表达情况,将患者分成CD56阳性组12例,CD56阴性组52例。
1.3 随访方法 患者每3个月进行骨髓常规及PMLRARa融合基因检测,持续2年,进行疾病复发、缓解的评价。采用查阅住院病历资料或电话联系方式随访。所有病例随访截至2015年12月31日。
1.4 观察指标 观察CD56阳性组和CD56阴性组CD9、CD11b、CD15、CD19、CD117、HLA-DR抗原表达的差异及缓解率、复发率、中位总生存期、3年总生存率、3年无病生存率的差异。诱导缓解治疗后疗效参照文献[4]分为CR、部分缓解、未缓解及复发。复发标准为复查骨髓形态学再次提示原始早幼粒细胞>20%,或骨髓外白血病细胞浸润,或PML-RARa融合基因阴性再次转阳性。总生存(overall survival,OS)期:自患者确诊到死亡或随访终止的时间;无病生存(disease free survival,DFS)期:从CR到APL复发、死亡或随访终止的时间。
1.5 统计学处理方法 应用SPSS19.0软件进行统计分析,计数资料比较采用χ2检验,如有必要,使用连续校正(1≤理论频数<5)或Fisher精确检验(理论频数<1),生存分析使用Kaplan-Meier法及log-rank检验。P<0.05为差异有统计学意义。
2 结果
2.1 免疫特点 64例APL患者中12例CD56阳性,占18.75%,CD56表达的阳性范围为20%~96%。12例CD56阳性者中3例表达CD2,5例表达CD34,与CD56阴性APL患者相比,差异有统计学意义(P<0.05);而CD56阳性组CD9、CD11b、CD15、CD19、CD117、HLA-DR表达与CD56阴性组相比,差异均无统计学意义(均P>0.05),见表1。

表1 APL免疫特点与CD56表达的关系[例(%)]
2.2 CD56表达对预后的影响 本研究对象中3例于诱导缓解期间因经济原因放弃治疗,故61例可评估诱导缓解疗效。CD56阳性组里完成诱导治疗的患者12例,第一疗程获得CR者10例(占83.33%),第二疗程获得CR者1例(占8.33%),未缓解1例,总CR率为91.67%,CR后复发5例(占45.45%)。CD56阴性组完成诱导化疗者49例,第一疗程获得CR者44例(占89.80%),第二疗程获得CR者3例(占6.12%),未缓解2例,总CR率为95.92%,CR后复发9例(占19.15%)。2组CR率差异均无统计学意义(P>0.05),2组复发率差异无统计学意义(P>0.05)。出现髓外复发者在CD56阳性组和阴性组各为3例和2例(分别占27.27%和4.55%),差异有统计学意义(χ2=5.500,P<0.05),浸润部位以中枢神经系统为主,共3例,其次为淋巴结、卵巢,各1例。
CD56阳性组患者在随访期内无失访,CD56阴性组患者在随访期内有3例于诱导期放弃治疗,故2组分别有12例和46例进行OS分析,其中达CR者分别为11和44例,对这55例患者进行DFS分析。3年内CD56阳性组死亡2例,复发5例,CD56阴性组死亡2例,复发6例,死亡患者均为复发后患者。CD56阳性组患者中位OS时间为55.3个月,3年OS、DFS率分别为83.33%、54.55%,CD56阴性组患者的中位OS时间为58.6个月,3年OS、DFS率分别为95.65%、86.36%。2组患者的中位OS时间、3年OS率差异均无统计学意义(χ2=2.249,P>0.05),3年DFS率差异有统计学意义(χ2=4.835,P<0.05),见图1-2。
3 讨论
CD56抗原属超免疫球蛋白家族成员,作为NK细胞表面的特异性标志被提出,后被发现在部分急性髓系白血病(acute myeloid leukemia,AML)细胞的表面亦有表达[5]。它具有独特的临床生物学特性,对急性白血病的预后判断有重要意义[3,6-7]。
本研究发现CD56阳性组患者CD2、CD34表达率较CD56阴性组高,差异有统计学意义(P<0.05),这与之前研究结果[8-10]一致。CD2抗原是T淋巴细胞膜上的一种绵羊红细胞受体,与T淋巴细胞的活化和增殖有关。有研究[11-14]报道,在部分AML中可见CD2表达,以APL中表达较为多见,CD2的表达与早期死亡率高、缓解率低、5年总生存率低相关,被认为是AML预后不良的独立因素。CD34抗原是唾液酸黏蛋白样的I型跨膜磷酸糖蛋白分子,主要在造血干/祖细胞阶段呈特异性表达。在APL患者中CD34表达率低,其阳性表达被认为与APL的变异型有关[15]。另有研究表明,CD34阳性的AML患者多个谷胱甘肽信号调控蛋白的表达异常,从而扰乱了细胞谷胱甘肽的代谢平衡,出现严重的细胞死亡;CD34阳性的APL患者对ATRA敏感性差,首次化疗后完全缓解率较低,预后较差[2,16]。尽管早期阶段CD34、CD2与CD56阳性在APL的伴随表达机制不明,但这提示部分CD56阳性的APL细胞在祖细胞时期没有经历系谱限制,更倾向于是不成熟的、分化差的细胞。
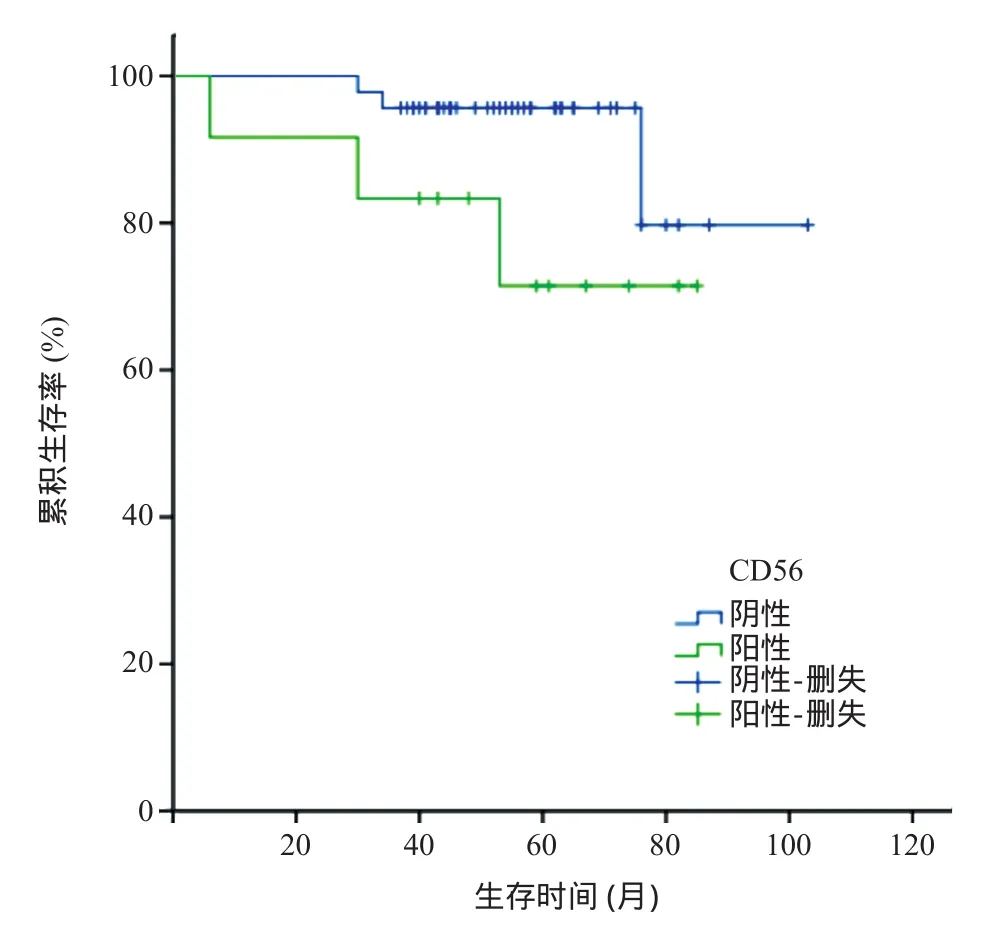
图1 CD56阳性组和CD56阴性组APL患者总生存曲线比较

图2 CD56阳性组和CD56阴性组APL患者无病生存曲线比较
目前,有关CD56表达对APL患者预后的影响还未达成共识。FERRARA等[17]报道100例APL患者中,CD56阳性和阴性组CR率分别为87%和94%,累计髓外复发率分别为13%和8%,差异均无统计学意义,并发现CD56是APL患者OS(62%和86%)的不良影响因素,但不是DFS(22个月和未达到)的不良影响因素。MONTESINOS等[9]对此意见不同,认为CD56阳性不仅影响CR率(CD56阳性组和阴性组分别为85%和92%),还是复发(5年累计复发率,22%和10%)、髓外复发(7%和1%)、5年DFS率(73%和85%)的不良影响因素,但不是5年OS率(78%和84%)的不良影响因素。ONO等[10]的一项多中心研究纳入了239例成人初治APL患者,中位随访时间8.5年,研究显示,CD56表达对APL患者的CR率(CD56阳性组和阴性组分别为91%和95%)、9年累计复发率(39%和24%)、9年累计髓外复发率(5%和1.5%)、9年DFS率(48%和65%)、9年OS率(74%和79%)均无影响,但在初诊白细胞计数≥3.0×109/L的APL患者中,CD56表达者9年累计复发率较阴性者高(CD56阳性组和阴性组分别为54%和29%),9年DFS率均较阴性者低(31%和64%)。我们的研究结果表明,2组APL患者的CR率、复发率差异无统计学意义,但CD56阳性组髓外复发率高于阴性组。是否剔除体力状态评分高分患者可能是各研究者结果不同的原因之一[18]。近年来,随着三氧化二砷、吉妥珠单抗及他米巴罗汀的应用[19],大部分复发的患者能得到更有效的治疗,这可能是CD56表达与否并未影响APL患者OS的原因。
目前APL的异质性逐渐受到重视,本研究发现伴CD56表达的APL患者预后不良,需加强巩固治疗及微小残留病灶监测。其机制尚不明确,TIWARI等[20]报道CD56可以通过激活NF-κB信号通路从而阻止肿瘤细胞凋亡,但这些仍需进一步证实。
