青蒿琥酯对吉西他滨体外抗胰腺癌活性的作用*
2019-01-21华宏军龚道军叶晓华陈燕萍
华宏军, 龚道军, 叶晓华, 陈 媛, 陈燕萍, 韦 祎
(金华市中心医院, 浙江 金华 321000)
胰腺癌是一种恶性程度很高、预后最差的恶性肿瘤,被称为“癌中之王”。由于胰腺癌的侵袭转移能力极高,且目前仍缺少胰腺癌的早期确诊手段,因此多数患者确诊时已是胰腺癌晚期,手术成功率很低,5年生存率远低于10%[1-2]。对于胰腺癌患者而言,系统性化疗是不可或缺的治疗方案[3]。然而很多胰腺癌患者体内的肿瘤细胞对化疗药物并不敏感,采取辅助治疗措施提高肿瘤细胞的化疗敏感性是改善抗肿瘤治疗的重要课题。
吉西他滨(gemcitabine,GEM)属于嘧啶类抗肿瘤药物,其主要代谢物能掺入肿瘤细胞的DNA,从而破坏DNA的功能,激活肿瘤细胞的凋亡途径[4-5]。目前吉西他滨已作为一线化疗药物用于原位及转移性胰腺癌的治疗,然而在化疗过程中经常出现肿瘤细胞对吉西他滨的抵抗性[6-7],因此联合辅助治疗药物改善吉西他滨的抗肿瘤活性具有十分重要的临床意义。
青蒿琥酯(artesunate)是提取自菊科植物黄花蒿叶的天然活性成分,临床主要用于疟疾的治疗。然而近期的研究发现,青蒿琥酯除抗疟作用外,还具有一定的抗肿瘤活性[8-9]。本研究的目的在于探讨青蒿琥酯在体外对吉西他滨抗胰腺癌活性的增效作用并研究其机制。
材 料 和 方 法
1 细胞培养
人胰腺癌细胞系Capan-2购于美国模式培养物保存中心(American Type Culture Collection,ATCC),培养在含10%胎牛血清的DMEM培养基中,在37 ℃恒温培养箱中培养并通入5% CO2。细胞每2~3 d传代1次,传代时,用胰酶消化液使细胞进入悬浮状态并用DMEM培养基洗涤2次,将细胞悬液按1∶3稀释后传代。
2 实验试剂
吉西他滨、噻唑蓝[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT]、青蒿琥酯、二甲亚砜和Annexin V-FITC凋亡检测试剂盒购于Sigma-Aldrich;DMEM培养基购于Gibco;抗鼠双微体蛋白2(murine double minute protein 2,MDM2)、p53、Puma、Noxa、caspase-9、caspase-3、细胞色素C(cytochrome C)、凋亡诱导因子(apoptosis-inducing factor)和GAPDH抗体购于Cell Signaling Technology;JC-1线粒体膜电位染料和线粒体分离试剂盒购于碧云天生物科技有限公司;MDM2小干扰RNA(small interfering RNA,MDM2 siRNA)购于Santa Cruz;ECL显色试剂盒购于Pierce;Lipofectamine 2000购于Invitrogen。
3 方法
3.1MDM2过表达与基因沉默 人MDM2基因的开放阅读框架全长序列经PCR扩增后以分子克隆的方法与质粒pcDNA3.1连接后构建成MDM2重组质粒,用于MDM2的过表达。MDM2 siRNA用于MDM2的基因沉默。质粒及siRNA用Lipofectamine 2000按试剂操作说明书步骤进行转染,简要步骤如下:将2 mg/L质粒或50 nmol/L siRNA用脂质体2000进行包裹后将其加入到无血清培养基进行混合。将贴壁的Capan-2细胞置于该无血清培养基孵育6 h后弃去无血清培养基并加入新鲜的含10%胎牛血清的DMEM培养基培养24 h。
3.2MTT法测定细胞活力 将转染后的Capan-2细胞按每孔5×109接种在96孔板上孵育过夜,之后加入吉西他滨(0~32 μmol/L)和青蒿琥酯(0~160 μmol/L)处理48 h。孵育后在各培养孔中加入20 μL 5 g/L MTT再培养4 h,小心吸去上清液,往孔中加入150 μL 二甲亚砜,充分振荡后在570 nm波长下用酶标仪检测吸光度(A)值。细胞活力结果用各处理组与对照组的A值比值表示。绘制细胞活力-吉西他滨浓度曲线,根据曲线计算吉西他滨对Capan-2细胞的半数抑制浓度(IC50)。
3.3流式细胞术检测细胞凋亡 Capan-2细胞经吉西他滨(1 μmol/L)和青蒿琥酯(10 μmol/L)处理48 h后收集细胞,用生理盐水洗涤2次,按照凋亡检测试剂盒说明书步骤用Annexin V和碘化丙啶(PI)对细胞进行染色孵育20 min。之后采用流式细胞术检测Capan-2细胞的凋亡,凋亡率用Annexin V阳性细胞数占总细胞数的百分比表示。
3.4细胞线粒体膜电位的检测 Capan-2细胞经吉西他滨(1 μmol/L)和青蒿琥酯(10 μmol/L)处理48 h后收集细胞,用生理盐水洗涤2次,加入终浓度为2 mg/L的JC-1染料孵育Capan-2细胞。20 min后,再用生理盐水将Capan-2细胞洗涤3次,之后采用流式细胞术检测JC-1发出的红色荧光,红色荧光强度越强,则表示线粒体膜电位越高[10]。
3.5线粒体分离 转染后的Capan-2细胞经吉西他滨(1 μmol/L)和青蒿琥酯(10 μmol/L)处理48 h后收集细胞,用生理盐水洗涤2次,再使用线粒体分离试剂盒按说明书所示步骤分离移除Capan-2细胞中的线粒体,收集无线粒体的细胞质用以检测其中的细胞色素C和凋亡诱导因子。无线粒体的细胞质中细胞色素C和凋亡诱导因子蛋白水平越高,则说明线粒体细胞色素C和凋亡诱导因子的释放水平越高。
3.6Western blot实验 转染后的Capan-2细胞经吉西他滨(1 μmol/L)和青蒿琥酯(10 μmol/L)处理48 h后收集细胞,用生理盐水洗涤2次,用蛋白提取液提取Capan-2细胞中的总蛋白质。将等量的总蛋白质或3.5所述所得样品用10% SDS-PAGE进行电泳分离。分离完毕后通过电转方法将蛋白质从分离胶上转到PVDF膜上。用5%脱脂奶粉对PVDF进行封闭孵育2 h,之后再将PVDF膜用抗MDM2、p53、Puma、Noxa、caspase-9、caspase-3、cytochrome C、apoptosis-inducing factor和GAPDH抗体孵育过夜。I 抗孵育完毕后的PVDF膜再用带辣根过氧化物酶的 II 抗孵育2 h,蛋白条带用ECL试剂盒显色发光。
4 统计学方法
用SPSS 15.0进行数据处理和统计分析。所有实验重复3次,实验数据用均数±标准差(mean±SD)表示。两组间均数采用非配对双侧t检验进行分析;多组间均数的比较采用单因素方差分析(one-way ANOVA),再用Bonferroni校正的t检验进行多组间均数两两比较。以P<0.05为差异有统计学意义。
结 果
1 青蒿琥酯增强吉西他滨的抗胰腺癌活性
将p53野生型胰腺癌细胞系Capan-2用青蒿琥酯(0~160 μmol/L)进行单独处理,MTT实验结果显示青蒿琥酯单独处理对Capan-2细胞的杀伤活性较弱,10 μmol/L青蒿琥酯单独处理对Capan-2细胞的细胞活力没有明显影响,见图1A,因此将Capan-2细胞用10 μmol/L青蒿琥酯与不同浓度吉西他滨(0~32 μmol/L)进行联合处理,研究青蒿琥酯对吉西他滨的辅助效应。实验结果显示青蒿琥酯能显著增强吉西他滨的抗胰腺癌活性(P<0.05),见图1B,降低吉西他滨对Capan-2细胞的IC50(P<0.05),见图1C。流式细胞术实验结果显示青蒿琥酯能明显促进吉西他滨对Capan-2细胞凋亡的诱导(P<0.05),见图1D。这些结果表明青蒿琥酯能显著增强吉西他滨的抗胰腺癌活性。
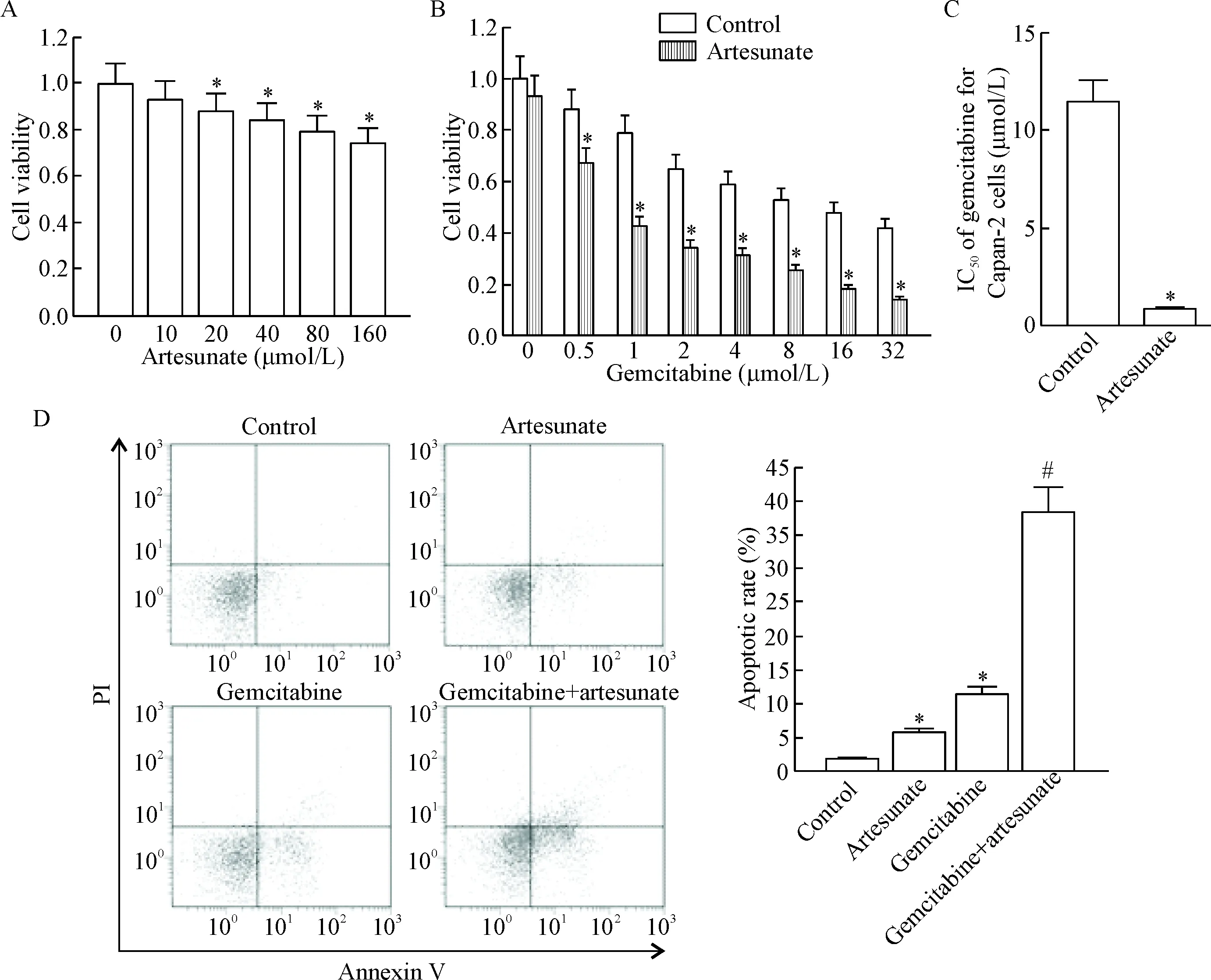
Figure 1.Artesunate enhanced the anti-tumor effect of gemcitabine on pancreatic cancer Capan-2 cells. A: the cytotoxicity of artesunate against Capan-2 cells; B: artesunate increased the cytotoxicity of gemcitabine against Capan-2 cells; C: combination treatment with artesunate decreased the IC50 of gemcitabine for Capan-2 cells; D: artesunate increased the gemcitabine-induced apoptosis of Capan-2 cells. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsgemcitabine group.
图1青蒿琥酯增强吉西他滨的抗胰腺癌杀伤作用
2 青蒿琥酯对吉西他滨的辅助抗胰腺癌活性依赖于MDM2的抑制
Western blot实验结果显示青蒿琥酯能明显抑制Capan-2细胞中MDM2的表达水平(P<0.05),见图2A,表明MDM2是青蒿琥酯的作用靶点。另外,为了研究MDM2对吉西他滨杀伤胰腺癌活性的影响,我们将MDM2过表达质粒或MDM2 siRNA转染入Capan-2细胞中,观察其效果,MDM2质粒和MDM2 siRNA的转染效率见图2A。MTT实验结果显示尽管青蒿琥酯能明显提高吉西他滨对Capan-2细胞的杀伤活性,然而转染MDM2质粒后,青蒿琥酯对吉西他滨的辅助作用受到明显抑制(P<0.05);另一方面,转染MDM2 siRNA直接抑制MDM2的表达水平同样能增强吉西他滨对Capan-2细胞的杀伤活性(P<0.05),见图2B。这些结果表明Capan-2细胞中MDM2表达水平对吉西他滨的抗胰腺癌活性起重要作用,青蒿琥酯通过抑制Capan-2细胞中MDM2的表达提高细胞对吉西他滨的敏感性。另一方面,有研究发现MDM2表达质粒或MDM2 siRNA能明显改变Capan-2细胞中MDM2这一p53内源性抑制分子[11]的表达水平,本研究亦发现单独转染MDM2表达质粒或MDM2 siRNA对p53蛋白水平有显著影响(P<0.05),见图2C。
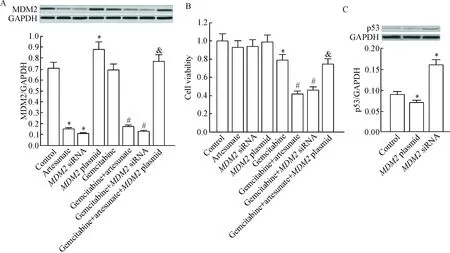
Figure 2.Artesunate promoted gemcitabine-induced cell death in Capan-2 cells through inhibition of MDM2. A: the effects of artesunate (10 μmol/L), gemcitabine (1 μmol/L),MDM2 siRNA (50 nmol/L) andMDM2 plasmid (2 mg/L) on the expression of MDM2 in the Capan-2 cells; B: the effects of artesunate (10 μmol/L), gemcitabine (1 μmol/L),MDM2 siRNA (50 nmol/L) andMDM2 plasmid (2 mg/L) on the viability of Capan-2 cells; C: the effects ofMDM2 siRNA (50 nmol/L) andMDM2 plasmid (2 mg/L) on the protein level of p53 in the Capan-2 cells. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsgemcitabine group;&P<0.05vsgemcitabine+artesunate group.
图2青蒿琥酯通过抑制MDM2表达提高吉西他滨对Capan-2细胞的杀伤活性
3 青蒿琥酯通过MDM2/p53途径提高Capan-2细胞对吉西他滨诱导的凋亡信号的敏感性
鉴于MDM2是p53的内源性抑制分子,诱导p53的降解[11],我们进一步检测青蒿琥酯和吉西他滨对p53表达的影响。Western blot实验结果显示青蒿琥酯联合吉西他滨能显著提高Capan-2细胞p53的蛋白水平(P<0.05);同时,青蒿琥酯也能明显促进吉西他滨处理的Capan-2细胞中Puma和Noxa这2种p53下游调控蛋白[12]的表达水平(P<0.05),见图3A。流式细胞术实验结果显示青蒿琥酯能显著促进吉西他滨诱导的Capan-2细胞线粒体功能障碍,明显降低其线粒体膜电位(图3B)。进一步实验结果显示青蒿琥酯联合处理能明显促进吉西他滨诱导的Capan-2细胞的细胞色素C和凋亡诱导因子从线粒体中释放到细胞质中(图3C),进而显著诱导Capan-2细胞凋亡执行蛋白caspase-9和caspase-3的活化(图3D)。然而,当在Capan-2细胞中转染MDM2质粒使其强制表达后,青蒿琥酯对吉西他滨诱导的线粒体途径凋亡的促进作用明显减弱。这些实验结果表明青蒿琥酯能通过MDM2/p53途径增强吉西他滨对胰腺癌细胞的凋亡诱导活性。
讨 论
吉西他滨是临床上治疗胰腺癌的一线化疗药物,因此如何提高吉西他滨的化疗疗效是目前亟待解决的课题。近期的研究发现将化疗药物与一些天然药物活性成分进行联合治疗能降低肿瘤细胞对化疗药物的抵抗性,有效提高化疗药物的疗效[13-14],因此本研究探讨是否可能通过天然药物联合治疗途径提高吉西他滨对胰腺癌细胞的杀伤活性。
在本研究的实验结果显示尽管青蒿琥酯单独治疗的抗胰腺癌活性较弱,但较低浓度的青蒿琥酯(10 μmol/L)却能明显增强各种浓度吉西他滨对p53野生型胰腺癌细胞的杀伤活性,表明青蒿琥酯能降低p53野生型胰腺癌对吉西他滨的化疗抵抗性,对吉西他滨的化疗起到很好的辅助治疗作用。
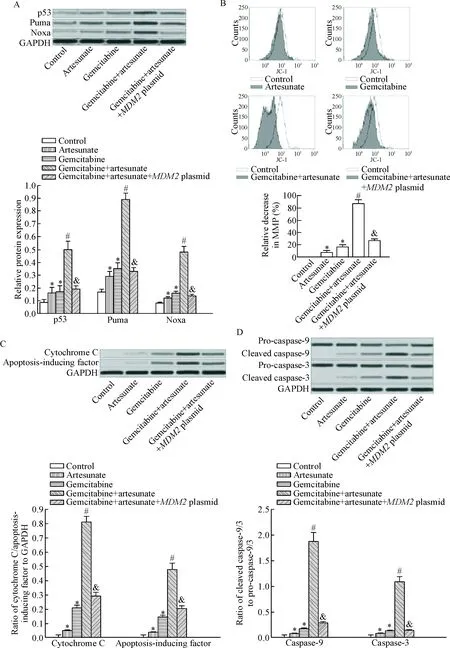
Figure 3.Artesunate increased the sensitivity of Capan-2 cells to the apoptosis signaling induced by gemcitabine. A: artesunate promoted expression of p53, Puma and Noxa in the gemcitabine-treated Capan-2 cells; B: artesunate promoted gemcitabine-induced decrease in mitochondrial membrane potential (MMP) of Capan-2 cells; C: artesunate promoted gemcitabine-induced release of cytochrome C and apoptosis-inducing factor into cytoplasm in Capan-2 cells; D: artesunate promoted gemcitabine-induced activation of caspase-9 and caspase-3 in Capan-2 cells. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsgemcitabine group;&P<0.05vsgemcitabine+artesunate group.
图3青蒿琥酯增强Capan-2细胞对吉西他滨诱导的凋亡信号的敏感性
野生型p53是一种重要的肿瘤抑制性转录因子,能通过促进下游靶基因Puma和Noxa[12]的表达诱导肿瘤细胞发生凋亡。然而,在多种肿瘤细胞中,p53蛋白会发生表达缺失或突变,使p53蛋白丧失对肿瘤的抑制作用。尽管如此,一些胰腺癌细胞的p53仍以野生型形式存在并发挥抗肿瘤活性[15]。因此在胰腺癌的治疗中,p53是一个潜在的重要靶点。在一般情况下,p53蛋白的稳定性和活性受MDM2蛋白的调控。细胞中的MDM2蛋白能与p53发生结合从而抑制p53的生物活性并诱导其发生降解,因此在一般情况下,胰腺癌细胞中的p53蛋白水平维持在一个较低水平。然而当胰腺癌细胞处于化疗药物作用下时,p53蛋白能从MDM2-p53复合物中游离出来,从而增加了其稳定性和细胞内蛋白水平[16]。因此,胰腺癌细胞中的p53蛋白水平受细胞中MDM2蛋白和化疗药物的调控。
在本研究中,我们选择Capan-2这一p53野生型胰腺癌细胞系来研究蒿琥酯的辅助治疗作用。实验结果表明青蒿琥酯能明显降低胰腺癌细胞中MDM2这一p53调节性蛋白的表达水平,从而减弱了MDM2对p53的抑制作用,使更多的p53蛋白在吉西他滨依赖的凋亡信号作用下从MDM2-p53复合物中游离出来。细胞中高水平的p53使Puma和Noxa这些p53下游促凋亡蛋白的表达水平显著升高,诱导胰腺癌细胞进入线粒体途径的凋亡,表现为肿瘤细胞线粒体膜电位的显著下降,线粒体失能,从而使细胞色素C和凋亡诱导因子等凋亡活性分子[17-18]从线粒体中释放到细胞质中,激活细胞的凋亡执行蛋白caspase-9和caspase-3,诱导胰腺癌细胞发生凋亡性死亡。
综上所述,本研究证明了青蒿琥酯能提高吉西他滨对p53野生型胰腺癌细胞的杀伤活性并研究了其机制。这些研究为提高胰腺癌的化疗疗效,提高患者的生存能力提供了新的策略和思路。
