紫草素逆转由肝细胞生长因子诱导的肺癌吉非替尼耐药*
2019-01-21陈子龙卫延明
路 京, 陈子龙, 闵 朕, 卫延明, 赵 丽, 吕 倩, 熊 山
(1渭南市食品药品检验所, 陕西 渭南 714000; 2山东省医学科学院药物研究所, 山东 济南 250062)
近年来肺癌的发病率和死亡率呈逐年上升趋势,并且低龄化趋势也越来越明显。肺癌的临床治疗手段包括手术、放疗、化疗、分子靶向治疗、免疫治疗以及中医药的辅助治疗等[1]。传统的治疗方式缺乏特异性,且不良反应严重,近年来肿瘤的分子靶向治疗为肿瘤治疗开辟了新的方向[2]。表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine enzyme inhibitors,EGFR-TKIs),如吉非替尼(gefitinib,Gef)对有EGFR突变的非小细胞肺癌(non-small cell lung cancer,NSCLC)患者有很好的临床疗效,但是,敏感突变患者在服用靶向药物治疗后1年左右不可避免地出现了耐药,进而导致疾病复发和进展[3],因此,临床上迫切需要研发新的治疗策略来克服吉非替尼耐药。紫草素(shikonin)为中药植物紫草中提取的萘醌类化合物。研究显示,紫草素具有抗肿瘤、抑菌和免疫调节等作用[4-5]。然而,有关紫草素逆转由肝细胞生长因子(hepatocyte growth factor,HGF)诱导的肺癌细胞吉非替尼耐药尚未见报道。因此,本实验重点研究紫草素逆转由HGF诱导肺癌HCC827细胞的吉非替尼耐药,并探讨其可能的分子机制。
材 料 和 方 法
1 材料
人肺癌细胞株HCC827购自中国科学院上海细胞所。紫草素购自上海源叶生物科技有限公司;吉非替尼购自阿斯利康制药有限公司;HGF和DMSO购自Sigma;胎牛血清购自Gibco;RPMI-1640培养基购自吉诺生物医药技术有限公司;MTT购自碧云天生物公司;抗E-钙黏蛋白(E-cadherin)、波形蛋白(vimentin)、GAPDH、p-AKT及β-actin抗体购自Cell Signaling Technology。
2 方法
2.1细胞培养 肺癌HCC827细胞于含10%胎牛血清的RPMI-1640培养液中,置于37 ℃、5% CO2、饱和湿度培养箱中培养。细胞贴壁生长良好,每3 d传代1次。取对数生长期的细胞进行后续实验。
2.2MTT法检测细胞活力 取对数生长期的HCC827细胞,调整细胞悬液的浓度为5.0×107/L,接种于96孔细胞培养板中,每孔加入100 μL的细胞悬液,将培养板放置37 ℃、5% CO2、饱和湿度培养箱中培养过夜,第2天细胞贴壁后,加入药物作用,平行设置6个复孔。放置培养箱中培养后,每孔加入20 μL MTT溶液(2 g/L),继续置于培养箱中孵育4 h后终止培养。弃去培养液,每孔加入150 μL的DMSO,酶标仪于490 nm波长测定每孔的吸光度(A)值,实验重复3次。
2.3Transwell小室实验 取对数生长期的HCC827细胞,消化细胞于无血清培养基中,调整细胞悬液的浓度为8.0×107/L,取200 μL加入含有不同药物浓度的细胞悬液于Transwell小室的上室中,取600 μL含10%胎牛血清的培养基加入Transwell的下室中,每组平行设置3个复孔,将培养板置于37 ℃、5% CO2条件下培养24 h。实验结束后,取出Transwell小室,用棉签擦掉Matrigel及上室未穿膜的细胞,PBS清洗3次后,用甲醇固定10 min,然后用0.1%结晶紫染色30 min,最后在100倍镜下随机选取5个视野计数穿膜细胞数目,实验重复3次。
2.4Western blot法检测相关蛋白表达 收集药物作用后的HCC827细胞,将6孔板中的细胞用4 ℃的PBS洗涤2次后,加入含有蛋白酶抑制剂的RIPA 细胞裂解液于冰上裂解30 min。收集细胞到EP管中,4 ℃、12 000 r/min离心15 min,然后用BCA蛋白定量法测定各组蛋白浓度。将配好的蛋白取15 μg上样,经10% SDS-PAGE后,利用湿法转膜将蛋白转移至PVDF膜上,5% BSA封闭1 h,加入I抗(抗p-AKT、β-actin、E-cadherin、vimentin和GAPDH抗体,均1 ∶1 000稀释), 4 ℃摇床孵育过夜,然后用TBST洗膜3次后,室温下加入对应的II抗摇床孵育1 h后,用TBST洗膜3次,最后用ECL发光试剂盒显影后分析。
3 统计学处理
所有实验均重复3次,实验数据用均数±标准差(mean±SD)表示,应用SPSS 17.0统计软件进行数据分析。多组间比较采用单因素方差分析,组间两两比较应用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 紫草素对HCC827细胞活力的影响
向接种好的HCC827细胞中加入不同浓度(0、 0.5、 1、 2、4和8 μmol/L)的紫草素作用24 h后,MTT法检测细胞活力,结果显示HCC827细胞的生长抑制率分别为1.12%、8.84%、19.51%、41.13%、58.26%和73.52%,计算紫草素的半数抑制浓度(half maximal inhibitory concentration, IC50)为3.06 μmol/L,说明随着紫草素给药剂量的增加,其对HCC827细胞的生长抑制率显著上升,且呈一定的剂量依赖关系(P<0.05,P<0.01),见图1。
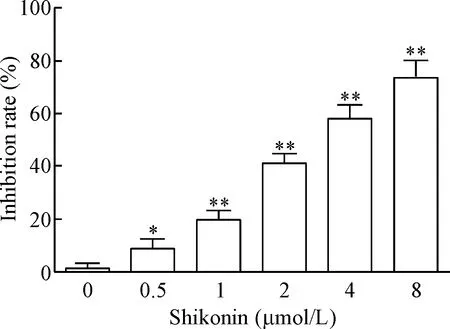
Figure 1. The effect of shikonin on cell viability in different group after 24 h. Mean±SD.n=3.*P<0.05,**P<0.01vs0 μmol/L group.
图1不同浓度的紫草素对HCC827细胞活力的影响
2 HGF诱导HCC827细胞对吉非替尼耐药
HCC827细胞株对吉非替尼敏感,实验中采用MTT法检测吉非替尼的药物敏感性,其IC50为0.51 μmol/L。在本实验过程中,我们通过加入不同浓度的HGF作用HCC827细胞,发现20 μg/L的HGF作用48 h对HCC827细胞吉非替尼耐药最为明显,其IC50为12.71 μmol/L,见图2。
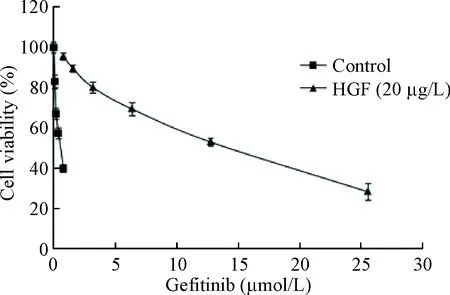
Figure 2. The effects of HGF on the gefitinib resistance to HCC827 cells by measuring the cell viability. Mean±SD.n=3.
图2HGF对HCC827细胞吉非替尼耐药的影响
3 紫草素逆转由HGF诱导的吉非替尼耐药
由上述实验结果可知,20 μg/L的HGF能诱导HCC827细胞吉非替尼耐药。为验证紫草素是否能逆转由HGF诱导的吉非替尼耐药,我们选择0.5 μmol/L的紫草素作为实验浓度(对细胞活力抑制率小于10%),用于紫草素联合吉非替尼的作用。吉非替尼(0.1~32 μmol/L)与紫草素(0.5 μmol/L)联合作用于由HGF诱导吉非替尼耐药的HCC827细胞时,紫草素可恢复HCC827细胞对吉非替尼的敏感性,吉非替尼的IC50值为7.36 μmol/L,见图3。说明紫草素可逆转由HGF诱导的吉非替尼耐药。
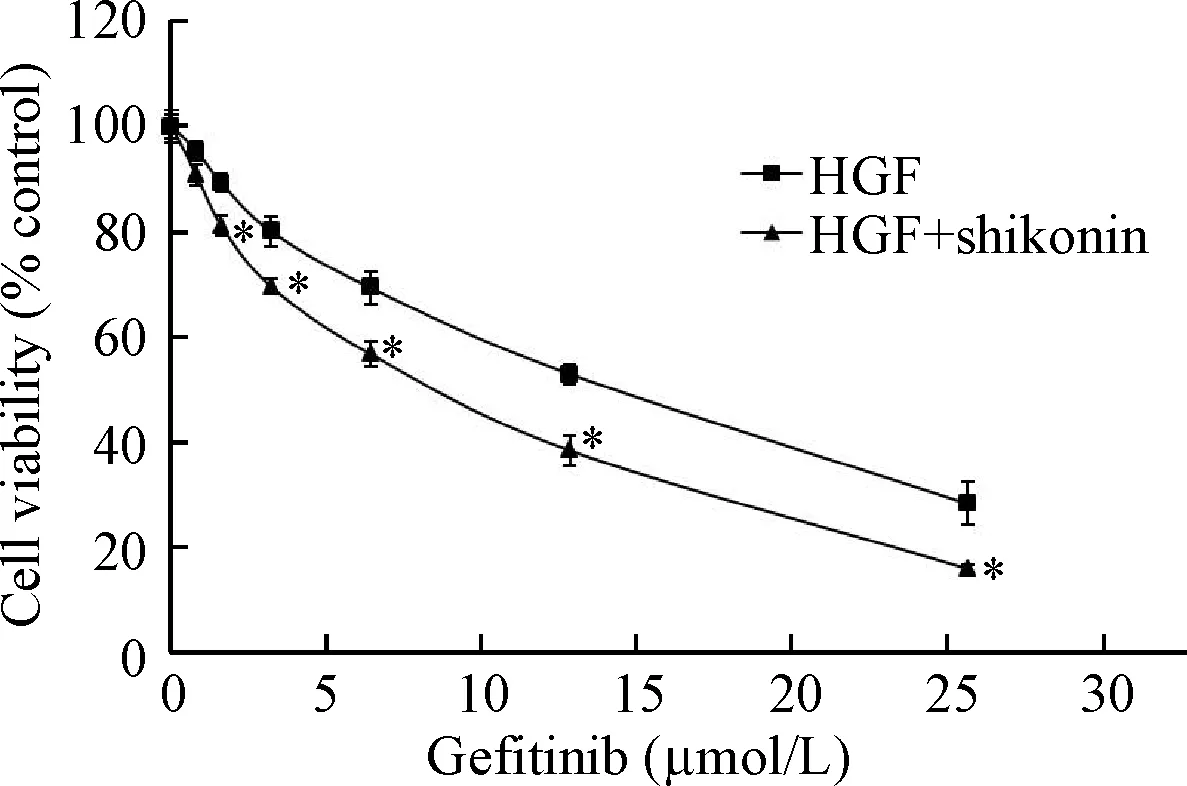
Figure 3.The effects of shikonin on the gefitinib resistance to HCC827 cells by measuring the cell viability. Mean±SD.n=3.*P<0.05vsHGF group.
图3紫草素逆转由HGF诱导的HCC827细胞吉非替尼耐药
4 紫草素联合吉非替尼对HCC827细胞侵袭能力的影响
本研究前期实验结果显示,由于紫草素在浓度高于0.5 μmol/L时,可明显抑制HCC827细胞的活力,因此在本实验中我们选择0.5 μmol/L作为检测其抗侵袭能力的实验浓度,以消除其抗增殖能力对实验结果的影响。Transwell小室实验结果显示,与对照组相比,HGF组能显著提高HCC827细胞的侵袭能力;而在HGF存在的情况下,与吉非替尼组相比,紫草素联合吉非替尼(1 μmol/L)组则明显抑制HCC827细胞的侵袭能力(P<0.01),见图4。
5 紫草素对HCC827细胞上皮间质转化(epithelial-mesenchymal transition, EMT)的影响
用Western blot法检测shikonin对HGF诱导的HCC827细胞EMT标志物E-cadherin和vimentin的影响,实验结果显示,HGF可显著下调HCC827细胞中E-cadherin 蛋白的表达,而上调vimentin的蛋白表达(P<0.01);加入shikonin作用后则可逆转由HGF诱导的HCC827细胞E-cadherin 蛋白表达下调和vimentin蛋白表达的上调(P<0.01),见图5。
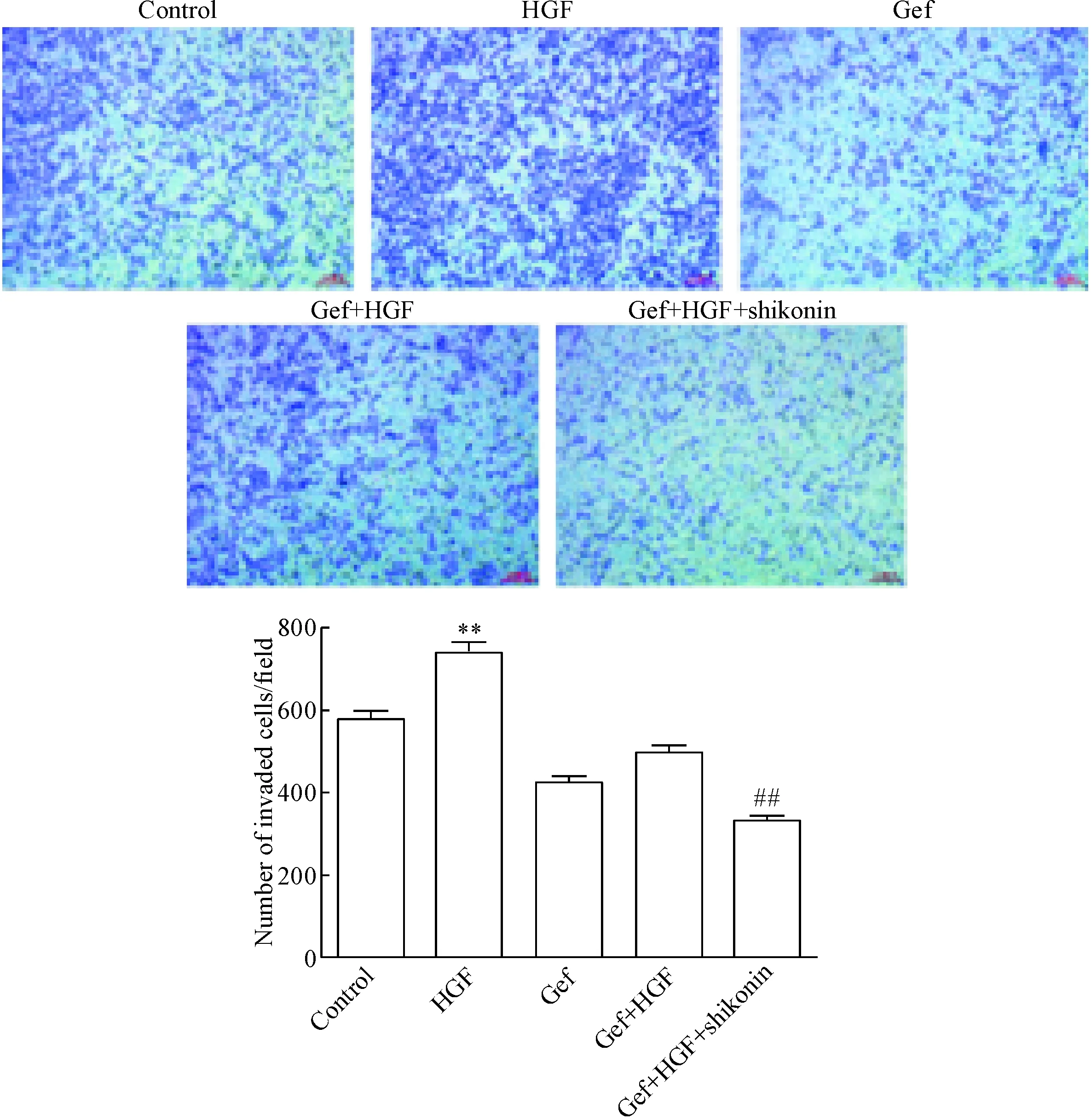
Figure 4.The effect of shikonin on HGF-induced resistance to gefitinib in HCC827 cells was determined by Transwell assay (×200). Mean±SD.n=3.**P<0.01vscontrol group;##P<0.01vsGef+HGF group.
图4紫草素对由HGF诱导的吉非替尼耐药HCC827细胞侵袭能力的影响
6 紫草素对由HGF诱导的吉非替尼耐药HCC827细胞p-AKT蛋白水平的影响
Western blot实验结果显示,用20 μg/L的HGF刺激处理后可激活AKT蛋白磷酸化,使HCC827细胞中p-AKT蛋白水平升高(P<0.05);紫草素联合吉非替尼作用于HGF诱导的HCC827细胞后,与吉非替尼单独作用组相比,能明显抑制由HGF激活的AKT蛋白磷酸化水平,使细胞中p-AKT蛋白表达平降低(P<0.05),见图6。
讨 论
近年来我国肺癌的发病率和死亡率呈明显上升趋势,而且年轻化趋势也越来越明显。早期肺癌发病较为隐匿,不易被察觉,患者往往在确诊时已是晚期,因而失去最佳治疗时机[6]。然而,近年来肿瘤的分子靶向治疗取得了十分显著的疗效,为晚期肺癌患者提供了一种不错的治疗途径,其中,以吉非替尼的应用最为广泛。吉非替尼为口服可逆性小分子酪氨酸激酶抑制剂,可竞争性结合于表皮生长因子受体酪氨酸激酶催化区域上Mg2+-ATP结合位点,抑制EGFR自身磷酸化,从而起到抗肿瘤的作用[7]。在近十年的上市应用中,吉非替尼对EGFR突变的非小细胞肺癌患者有较好的临床疗效,但是初始有效的患者经过一段时间的治疗后,也都不可避免地发生了获得性耐药。因此,探讨吉非替尼耐药发生的分子机制,从而寻找逆转耐药的药物是目前急需解决的关键问题。由于中草药毒副作用较小,是逆转肿瘤多药耐药的研究热点。紫草素是从中药紫草中提取的一类萘醌类化合物,研究表明其有抗肿瘤、抗炎、抑菌和免疫调节等药理作用。最近研究发现紫草素可逆转某些肿瘤的细胞耐药[8-10],但是,有关紫草素是否可逆转由肝细胞生长因子诱导的肺癌吉非替尼耐药未见报道。
近年来研究表明,吉非替尼的耐药机制主要有T790M突变[11]、c-met突变或扩增[12]、上皮间质转化[13]及非小细胞肺癌向小细胞肺癌转化[14]等,其中,上皮间质转化是指肿瘤细胞由上皮表型向间充质表型转化的过程,从而获得侵袭、迁移及耐药的能力,主要表现为E-cadherin等上皮标志物蛋白表达下降和vimentin等间充质标志物蛋白表达上调。詹建伟等[15]等报道HGF可诱导肺癌PC9细胞发生上皮间质转化,姜黄素则逆转了HGF诱导的吉非替尼耐药中的上皮间质转化;Tsai等[16]报道HGF可诱导乳腺癌MDA-MB-231细胞发生上皮间质转化。然而,目前紫草素是否通过EMT途径逆转HGF诱导的肺癌吉非替尼的耐药尚不清楚。
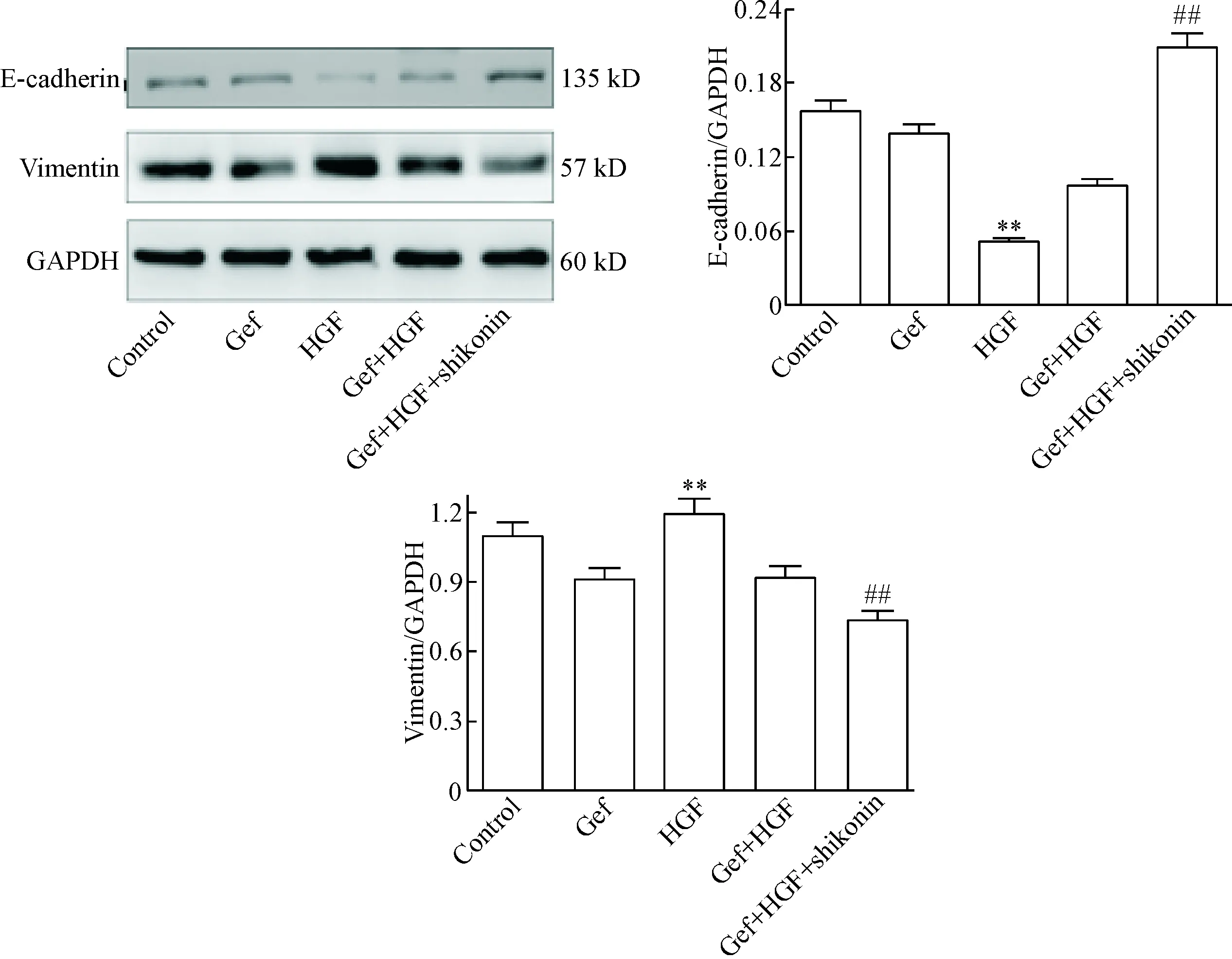
Figure 5.The protein levels of E-cadherin and vimentin in HGF-induced resistance to gefitinib in HCC827 cells treated with shikonin. Mean±SD.n=3.**P<0.01vscontrol group;##P<0.01vsGef+HGF group.
图5紫草素对由HGF诱导的吉非替尼耐药HCC827细胞EMT相关蛋白E-cadherin和vimentin表达水平的影响
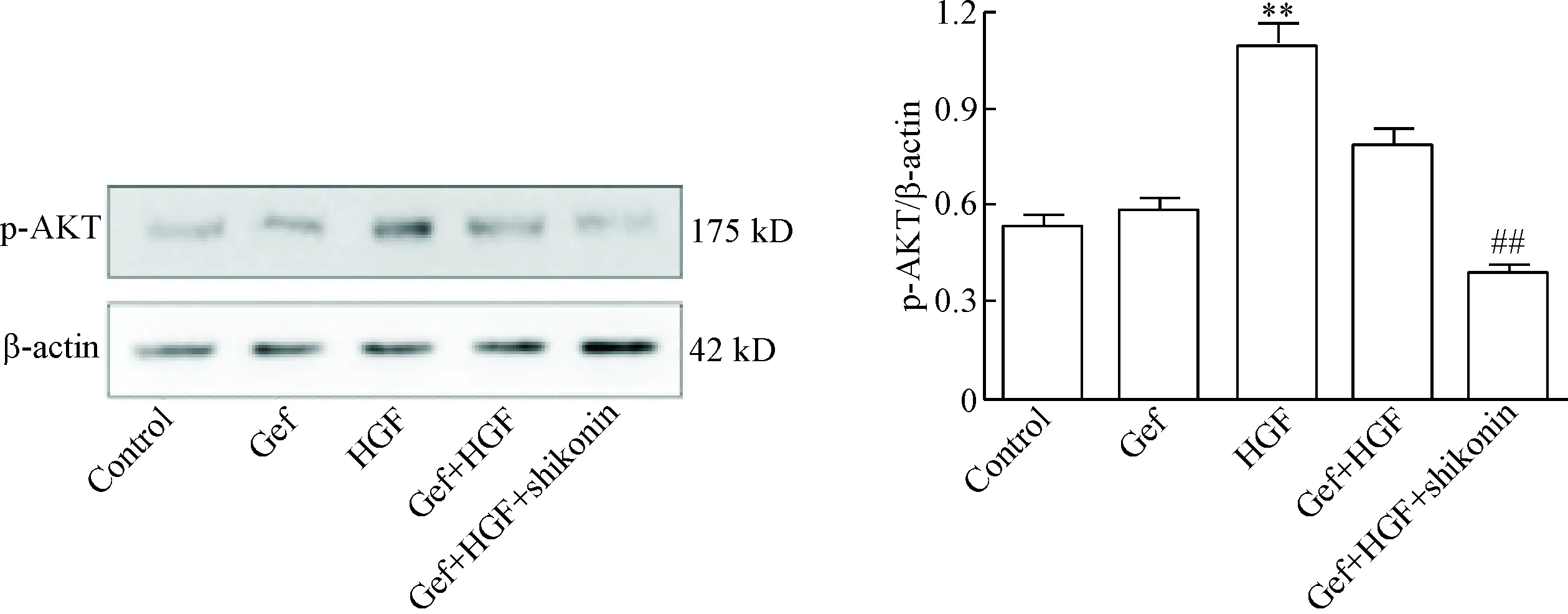
Figure 6.The protein level of p-AKT in HGF-induced resistance to gefitinib in HCC827 cells treated with shikonin. Mean±SD.n=3.**P<0.01vscontrol group;##P<0.01vsGef+HGF group.
图6紫草素对由HGF诱导的吉非替尼耐药HCC827细胞p-AKT蛋白水平的影响
本实验发现20 μg/L HGF对HCC827细胞的生长有明显的促进作用,同时可诱导吉非替尼耐药。紫草素联合吉非替尼作用于HGF诱导耐药的HCC827细胞时其存活率比吉非替尼单独作用时明显降低,说明紫草素能逆转HGF诱导的肺癌吉非替尼耐药。同时,紫草素还能削弱由HGF诱导的HCC827细胞的侵袭能力。检测EMT标志物发现,上皮标志物E-cadherin蛋白表达下降,间充质标志物vimentin蛋白表达上调,说明HGF诱导使肺癌细胞发生EMT。在实验加入紫草素作用后,细胞中上皮标志物E-cadherin蛋白表达较对照组明显上调,而间充质标志物vimentin 蛋白表达则明显下调。此外,HGF可明显增加HCC827细胞中p-AKT蛋白水平的表达,而紫草素联合吉非替尼作用组则明显抑制由HGF激活的AKT磷酸化水平。而在本实验中紫草素和HGF等实验试剂同时在细胞培养液中,它们间是否会存在相互化学反应从而影响各自的作用,使其诱发的耐药性减弱,而并非逆转已有的耐药性,这是我们应该注意的,也需要更加深入的研究来解释这个问题。
综上所述,本实验初步表明紫草素作为一种天然存在的化合物能逆转由HGF诱导HCC827细胞的吉非替尼耐药,其分子机制可能通过逆转上皮间质转化和抑制HGF激活的AKT蛋白磷酸化有关,具体机制有待进一步研究。
