miR-140-3p通过靶向PD-L1抑制非小细胞肺癌A549细胞的活力、迁移和侵袭*
2019-01-21张宇轩李春伟毛文浩朱恪岩邵扬谦邓晓明
张宇轩, 李春伟, 毛文浩, 朱恪岩, 邵扬谦, 邓晓明△
(郑州大学第一附属医院 1中西医结合科, 2肿瘤科, 河南 郑州 450052; 3河南省肿瘤医院甲状腺头颈外科, 河南 郑州 450008)
非小细胞肺癌(non-small-cell lung cancer,NSCLC)约占肺癌的80%~85%左右,由于其早期症状不明显,患者被发现时往往已处于晚期[1-2]。目前,针对NSCLC的主要治疗手段为手术、化疗和放疗[3-4]。然而与小细胞肺癌相比,NSCLC具有对放疗和化疗相对不敏感的特点,尽管极大程度地发展放化疗手段,患者5年存活率仍低于15%[5]。因此,需要大力推进相关科学研究以提高对NSCLC的诊断以及治疗水平。
微小RNA(microRNA,miRNA,miR)是一种长度大约为22 nt的小分子单链非编码RNA,可与下游靶基因mRNA的3’-UTR结合,从而促进其发生降解或者抑制翻译过程[6]。随着对miRNA的深入研究,人们提出miRNA的异常表达模式可被作为具有特异性的临床诊断和治疗预后生物标志物[7]。除此之外,miRNA还可以通过对靶基因的调控而影响致癌基因或肿瘤抑制因子的活性,与肿瘤的发生进程息息相关[8]。文献报道miR-140-3p在多种肿瘤中呈现低表达的现象,在肺癌组织中同样表达下调[9-10]。程序性细胞死亡配体1(programmed cell death ligand 1,PD-L1)与机体免疫应答息息相关,在肿瘤免疫逃逸中扮演着重要角色。因此,本研究将探讨miR-140-3p和PD-L1对NSCLC细胞活力、迁移和侵袭的影响及其具体作用机制,为后续研究NSCLC的诊断及治疗提供科学依据。
材 料 和 方 法
1 材料
人胚肺成纤维细胞HLF-1及肺癌细胞A549和H1299购自北京北纳生物。pcDNA3.0质粒购自淼灵生物;BCA定量、RNA提取和反转试剂盒购自Thermo;TB Green定量试剂购自TaKaRa;胎牛血清和0.25%胰蛋白酶购自Gibco;MTT试剂盒购自上海歌凡生物;兔抗PD-L1和GAPDH单抗购自Abcam;HRP标记的羊抗兔 II 抗购自Cell Signaling Technology;Lipofectamine 2000 购自Invitrogen;Transwell小室购自Corning;miR-140-3p模拟物(mimic)和抑制剂(inhibitor)购自上海吉玛生物;引物由上海生工合成。
2 实验方法
2.1细胞培养 细胞培养于5% CO2、90%相对湿度的37 ℃恒温培养箱,细胞贴合度为70%~80%使用0.25%胰蛋白酶消化传代培养。
2.2RT-qPCR检测细胞内miR-140-3p和PD-L1的表达水平 取生长状态良好的HLF-1、A549和H1299细胞,TRIzol法提取细胞内总RNA,反转录为cDNA,RT-qPCR法检测miR-140-3p和PD-LI mRNA的表达水平。PD-L1上游引物序列为5’-TGACGAGCACACTGAGAA-3’,下游引物序列为5’-AAGGC-AGAATAAGATGGC-3’; GAPDH的上游引物序列为5’-AAGGTGAAGGTCGGAGTCAAC-3’,下游引物序列为5’-GGGGTCATTGATAACAACAATA-3’;U6的上游引物序列为 5’-GCTTCGGCAGCACATATACTAAAAT-3’,下游引物序列为5’-CGCTT CACGAATTTGCGTGTCAT-3’; miR-140-3p的上游引物序列为5’-ACACTCCAGCTGGGAGGC-3’,下游引物序列为5’-CTCAACTGGTGTCGTGGA-3’。以采用2-ΔΔCt法计算miR-140-3p的表达水平。
2.3脂质体介导的细胞转染 将A549细胞按每孔2×105个接种于6孔板,过夜贴壁后,按照Lipofectamine 2000操作说明书转染miR-140-3p mimic、miR-140-3p inhibrtor及相应的mimic control和inhi-bitor control,培养相应时间后进行后续实验。同时构建过表达PD-L1的pcDNA3.1质粒,利用Lipofectamine 2000转染pcDNA3.1-PD-L1及对照空载质粒。
2.4双萤光素酶报告基因实验 以健康人DNA为模板,PCR扩增miR-140-3p与PD-L1结合区域WT-3’-UTR和PD-L1-MUT-3’-UTR的DNA片段,将PCR产物分别与pMIR-REPORT luciferase报告载体分别用SpeⅠ和HindⅢ双酶切后纯化,连接,转化,鉴定,获得PD-L1的含WT-3’-UTR以及MUT-3’-UTR萤光素酶报告质粒。将其分别与miR-140-3p模拟物或抑制剂共转染A549细胞48 h,使用Promega公司双萤光素酶活性检测试剂盒按说明书在单光子检测仪中检测细胞萤光素酶活性。相对萤光素酶活性=萤火虫萤光素酶活性值/海肾萤光素酶活性值。
2.5Western blot分析 收集转染miR-140-3p模拟物和抑制剂的A549细胞,加入裂解液在低温条件下反应1 h,之后12 000 r/min离心10 min收集细胞上清液,使用BCA法检测上清总蛋白浓度。加入5×loading buffer,沸水处理10 min,每个点样孔中加入50 μg蛋白,90 V电泳30 min,120 V继续电泳至溴酚蓝条带迁移至底部。100 V、低温转膜45 min,使用5%脱脂奶粉室温封闭2 h,加入1∶1 000稀释比例的 I 抗4 ℃封闭过夜,加入1∶5 000浓度的 II 抗室温反应2 h,DAB法进行显色反应,并对蛋白条带进行灰度分析。
2.6MTT实验检测细胞活力 取分别转染了miR-140-3p模拟物和pcDNA3.0-PD-L1质粒的A549细胞单悬液,按照每孔5×104个的密度接种于96孔板中,37 ℃培养24 h后加入20 μL 5 g/L的MTT,37 ℃孵育4 h。去除上清,加入150 μL DMSO溶液避光反应10 min,使用酶标仪于490 nm处检测吸光度(A)值。
2.7Transwell实验检测细胞迁移和侵袭能力 取转染miR-140-3p模拟物和pcDNA3.0-PD-L1质粒48 h后的A549细胞单悬液,加入无血清培养基后按照每孔5×103个的密度接种于上层腔室,在下层培养基中加入含有10%的胎牛血清的培养基。37 ℃孵育培养24 h后,使用棉签从上层腔室中转移未发生迁移和侵袭的细胞,其余细胞从下层腔室转移。之后,将得到的细胞使用0.1%的结晶紫染液染色30 min,PBS冲洗3次后使用33%乙酸低温孵育10 min,测量570 nm处的吸光度值并计算迁移细胞个数。侵袭实验在上层腔室加入无血清培养基稀释过的终浓度为1 g/L的基质胶100 μL,置于37℃培养箱中待其凝固,后续操作同迁移实验。每组3个重复,与miRNA对照组相比较,计算细胞相对数值。
3 统计学分析
本研究所有数据采用SPSS 21.0软件分析处理。计量资料以均数±标准差(mean±SD)表示。两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,组间多重比较使用SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 miR-140-3p在非小细胞肺癌细胞系中低表达
RT-qPCR检测了HLF-1、A549和H1299细胞中miR-140-3p的表达水平,结果显示,与HLF-1细胞相比,非小细胞癌A549和H1299细胞中miR-140-3p表达水平显著下调(P<0.05),见图1。因此后续研究选择A549细胞作为研究对象。
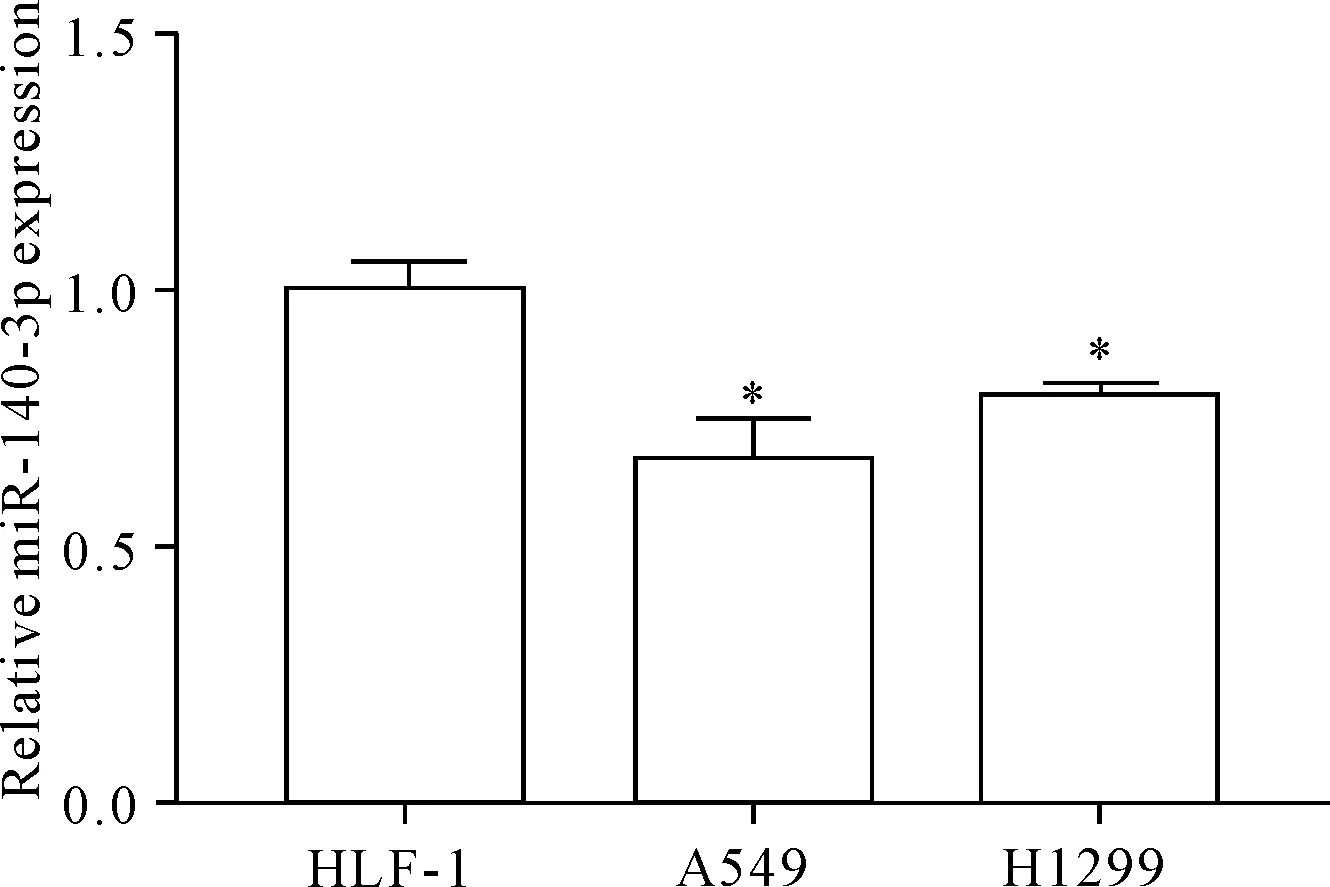
Figure 1. The expression of miR-140-3p in different cell lines detected by RT-qPCR. Mean±SD.n=3.*P<0.05vsHLF-1.
图1RT-qPCR检测miR-140-3p在不同细胞系的表达情况
2 miR-140-3p靶向调控PD-L1
在线软件TargetScan分析发现PD-L1是miR-140-3p的潜在靶标,见图2A。为验证两者之间的靶向调控关系,本研究进行了双萤光素酶报告基因实验并使用Western blot检测了miR-140-3p对PD-L1蛋白表达的影响。将miR-140-3p模拟物或抑制剂与PD-L1 WT-3’-UTR或MUT-3’-UTR共转染A549细胞,36 h后检测细胞的相对萤光素酶活性。结果显示,与转染miR-140-3p模拟物和PD-L1 MUT-3’-UTR组相比,转染miR-140-3p模拟物和PD-L1 WT-3’-UTR的萤光素酶活性显著下调(P<0.05);与转染miR-140-3p抑制剂和PD-L1 MUT-3’-UTR组相比,转染miR-140-3p抑制剂和PD-L1 WT-3’-UTR的萤光素酶活性显著上调(P<0.05),见图2B。Wes-tern blot结果显示,转染miR-140-3p模拟物后,A549细胞内PD-L1的表达水平显著下调;转染miR-140-3p抑制剂后,PD-L1表达量显著回升(P<0.05),见图2C。以上实验表明,PD-L1基因受到miR-140-3p的靶向负调控作用。
3 过表达miR-140-3p抑制A549细胞的活力
将miR-140-3p模拟物转染进入A549细胞,RT-qPCR检测miR-140-3p模拟物效率,MTT法检测其对细胞活力的影响。结果显示,与对照组相比,miR-140-3p模拟物组miR-140-3p相对表达水平显著上调(P<0.05),见图3A;并且miR-140-3p表达量的提高对A549细胞的生长具有抑制作用(P<0.05),见图3B。
4 过表达miR-140-3p抑制A549细胞迁移和侵袭
A549细胞转染miR-140-3p后,Transwell法检测细胞迁移和侵袭能力的变化。与转染对照组相比,miR-140-3p模拟物组的细胞迁移和侵袭个数均显著降低(P<0.05),由此可见,A459细胞内过表达miR-140-3p能够显著抑制迁移和侵袭能力,见图4。
5 PD-L1阻断miR-140-3p对A549细胞的抑制
为明确miR-140-3p和PD-L1的具体作用机制以及对A549细胞的影响,将pcDNA3.0-PD-L1质粒与miR-140-3p mimic共转染A549细胞,用MTT法检测其对细胞活力的影响,Transwell实验检测细胞迁移和侵袭能力的变化。Transwell实验结果显示,与miR-140-3p mimic组和miR-140-3p mimic+vector组相比,miR-140-3p mimic+pcDNA3.0-PD-L1组的细胞迁移和侵袭个数均明显增多(P<0.05),见图5A。MTT实验结果显示,与miR-140-3p mimic组相比,pcDNA3.0-PD-L1和miR-140-3p mimic共转染组的细胞活力得到提高(P<0.05),见图5B。以上结果说明了过表达PD-L1能够阻断miR-140-3p对A549细胞增殖、迁移和侵袭的抑制作用。

Figure 2.Verification of the target relationship between miR-140-3p and PD-L1.A: TargetScan software prediction; B: dual-lucife-rase receptor assay comfirmed the target relationship; C: Western blot was performed to detect the protein level of PD-L1. Mean±SD.n=3.*P<0.05vsmimic control group;#P<0.05vsinhibitor control group.
图2miR-140-3p与PD-L1靶向关系的验证
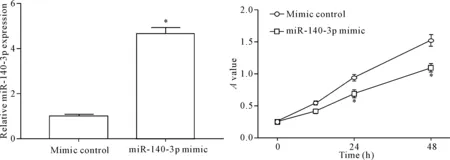
Figure 3.The effect of over-expression of miR-140-3p on the viability of A549 cells. Mean±SD.n=3.*P<0.05vsmimic control group.
图3过表达miR-140-3p对A549细胞活力的影响

Figure 4.The effects of miR-140-3p over-expression on the migration (A) and invasion (B) abilities of A549 cells. Mean±SD.n=3.*P<0.05vsmimic control group.
图4过表达miR-140-3p对A549细胞迁移和侵袭的影响
讨 论
肺癌是常见致死肿瘤之一,其在我国的发病率和致死率均居首位,对国民健康有着巨大威胁[2,11]。非小细胞肺癌占肺癌总类型的80%以上,主要病理组织类型为腺癌和鳞癌[12]。目前,因发病的隐蔽性,大部分就诊患者被发现时已属晚期,治疗效果和预后差,5年生存率极低,因此急需提出一种新的治疗手段提高患者生存率[13]。近些年来,关于肿瘤的免疫治疗相关科学研究取得了巨大进步,研究者发现免疫系统不仅能够参与监管和清除肿瘤细胞,而且在特定的阶段还能够促进肿瘤发生免疫逃逸,因此在机体肿瘤发生进程扮演重要角色[14]。
PD-1是B7-CD28免疫球蛋白家族成员之一,在活化的CD4+T、CD8+T和B细胞等均有表达,与机体的免疫应答息息相关[9, 15-16]。正常情况下,效应T细胞的活化需要TCR和APC表面的共刺激分子结合,而此时机体内的共刺激分子和共抑制分子的水平保持在一定的平衡稳态,从而使T细胞的免疫功能维持在恰当的水平,既能阻挡抗原的侵害又能减少对机体自身的组织损伤。然而,肿瘤可通过异常的代谢调控共抑制分子和相关配体的表达活性,例如PD-1的配体PD-L1和PD-L2,从而抑制T细胞的免疫功能,造成肿瘤对免疫系统监管的躲避,导致并促进肿瘤的发生[15, 17-19]。研究表明,PD-L1在多种恶性肿瘤中均出现高表达[20-22],另外PD-L1 作为单独的靶点,其表达水平高低与肿瘤细胞的生物学特性以及肿瘤的预后存在相关性[23]。Thompson等[24]通过对196肾癌肿瘤组织样品分析发现,PD-L1的上调表达能够促进肿瘤的转移能力并且能够提高4.5倍的死亡风险。由此可见,PD-L1活性的抑制是阻碍肿瘤发生免疫逃避的重要手段之一。
大量研究表明miRNA参与细胞分化、生长和凋亡等多种生物学过程[25],其中miR-140-3p被报道在多种癌症中均出现下调表达,包括非小细胞肺癌[26-28]。本研究发现,miR-140-3p在肺癌A549和H1299细胞中表达显著下调,与上诉文献报道一致。通过TargetScan分析发现,PD-L1是miR-140-3p的潜在靶标,并且双萤光素酶实验证实了靶向关系。将miR-140-3p模拟物转染A549细胞后,PD-L1表达下调,对细胞活力和迁移侵袭能力具有抑制作用;将miR-140-3p模拟物和pcDNA3.0-PD-L1共转染A549细胞发现,miR-14-3p对细胞活力和迁移侵袭能力的抑制作用得到解除,表明PD-L1能够阻断miR-140-3p对A549细胞的抑制。
综上所述,miR-140-3p和PD-L1的异常表达与非小细胞肺癌有着重要联系,本研究主要探讨了两者之间的作用关系以及在非小细胞肺癌中的作用机制,并证实了miR-140-3p可通过靶向PD-L1抑制A549细胞活力、迁移和侵袭。然而,本研究虽然从生物学现象上揭示了肿瘤细胞微环境下PD-L1对A549细胞迁移侵袭的影响和作用,为PD-L1靶点治疗提供理论支持,但是关于PD-L1的参与迁移侵袭具体机制尚不清楚,仍需进一步深入研究。

Figure 5.The effects of PD-L1 over-expression on the viability, migration and invasion of A549 cells. A: the migration and invasion abilities were detected by Transwell assay; B: the cell viability was detected by MTT assoy. Mean±SD.n=3.*P<0.05vsmiR-140-3p mimic group;#P<0.05vsmiR-140-3p+vector group.
图5过表达PD-L1对A549细胞活力、迁移和侵袭的影响
